重庆市南开重点中学2023年高考化学模拟考试试题
试卷更新日期:2024-05-11 类型:高考模拟
一、选择题(本题共14小题,每小题7分,共42分。 在每小题给出的选项中,只有一个选项符合题目要求。)
-
1. 化学与我们的生活息息相关,下列有关说法正确的是( )A、太阳能电池的主要材料是SiO2 B、明矾可用于自来水的杀菌消毒 C、大气中PM2.5比表面积大,吸附能力强,能吸附许多有毒有害物质 D、75%的医用酒精常用于消毒,用95%的酒精消毒效果更好2. 我国古代四大发明是古代劳动人民智慧的结晶。下列说法正确的是
选项
四大发明
制作简介
成分分析
A
黑火药
硝石、木炭和硫磺
爆炸时木炭作还原剂
B
活字印刷
胶泥由等组成
都属于金属氧化物
C
宣纸
由青檀树皮及稻草制作而成
主要成分为蛋白质
D
指南针
由天然磁石制成
主要成分是
A、A B、B C、C D、D3. 下列化学用语正确的是A、丙烷分子的空间填充模型: B、O3分子的球棍模型:
B、O3分子的球棍模型: C、乙醇的核磁共振氢谱图:
C、乙醇的核磁共振氢谱图: D、基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3
4. 下列有关实验方法正确的是A、用X射线衍射实验可获得青蒿素分子的结构 B、用广泛pH试纸测得醋酸溶液的pH为2.0 C、用淀粉溶液检验海水中的碘元素 D、用25 mL碱式滴定管量取16.60 mL高锰酸钾溶液5. 辅酶具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶的说法正确的是( )
D、基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3
4. 下列有关实验方法正确的是A、用X射线衍射实验可获得青蒿素分子的结构 B、用广泛pH试纸测得醋酸溶液的pH为2.0 C、用淀粉溶液检验海水中的碘元素 D、用25 mL碱式滴定管量取16.60 mL高锰酸钾溶液5. 辅酶具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶的说法正确的是( ) A、分子式为 B、分子中含有14个甲基 C、分子中的四个氧原子不在同一平面 D、可发生加成反应,不能发生取代反应6. 一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W原子的最外层电子数等于其总电子数的。下列说法不正确的是( )
A、分子式为 B、分子中含有14个甲基 C、分子中的四个氧原子不在同一平面 D、可发生加成反应,不能发生取代反应6. 一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W原子的最外层电子数等于其总电子数的。下列说法不正确的是( ) A、简单离子半径:W>Y>Z B、X元素的各种含氧酸盐水溶液均显碱性 C、与W同周期的元素中,第一电离能小于W的有5种 D、该锂盐中所有非金属元素均属于元素周期表p区元素7. 某同学利用下图所示装置探究金属的腐蚀与防护条件。
A、简单离子半径:W>Y>Z B、X元素的各种含氧酸盐水溶液均显碱性 C、与W同周期的元素中,第一电离能小于W的有5种 D、该锂盐中所有非金属元素均属于元素周期表p区元素7. 某同学利用下图所示装置探究金属的腐蚀与防护条件。
下列说法不合理的是( )
A、①区Cu电极上产生气泡,Fe电极附近滴加K3Fe(CN)6溶液后出现蓝色,Fe被腐蚀 B、②区Cu电极附近滴加酚酞后变成红色,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色,Fe被腐蚀 C、③区Zn电极的电极反应式为Zn-2e-=Zn2+ , Fe电极附近滴加K3[Fe(CN)6]溶液未出现蓝色,Fe被保护 D、④区Zn电极的电极反应式为2H2O+2e-=H2↑+2OH- , Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色,Fe被腐蚀8. 设为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,2.24L中含有的极性共价键数目为 B、5.6 g铁与足量硫粉反应,转移的电子数为 C、含0.1mol的水溶液中含有的原子数目为 D、的溶液中含铬微粒的数目为9. 用下列装置进行相应实验,能达到实验目的的是( )A
B
C
D




探究Cl-对Fe3+与S2O反应速率的影响
验证石蜡油发生了裂化(或裂解)反应
融化Na2CO3固体
干燥一氯甲烷
A、A B、B C、C D、D10. 对于下列实验,能正确描述其反应的离子方程式是( )A、用Na2SO3溶液吸收少量Cl2: B、向CaCl2溶液中通入CO2: C、向H2O2溶液中滴加少量FeCl3: D、同浓度同体积NH4HSO4溶液与NaOH溶液混合:11. 催化剂催化水煤气变换反应:CO(g)+H2O(g)CO2(g)+H2(g) △H<0,过程示意图如图所示,下列说法错误的是( ) A、过程I、过程II中都有水参与反应 B、该反应反应物总能量高于生成物总能量 C、使用催化剂不能改变水煤气变换反应的△H D、催化过程中既有极性键的断裂和形成,也有非极性键的断裂和形成12. pH计的工作原理(如图所示)是通过测定电池电动势E(即玻璃电极和参比电极的电势差)而确定待测溶液的pH。电池电动势E与待测溶液pH关系为: (E的单位为V,K为常数)。下列说法错误的是
A、过程I、过程II中都有水参与反应 B、该反应反应物总能量高于生成物总能量 C、使用催化剂不能改变水煤气变换反应的△H D、催化过程中既有极性键的断裂和形成,也有非极性键的断裂和形成12. pH计的工作原理(如图所示)是通过测定电池电动势E(即玻璃电极和参比电极的电势差)而确定待测溶液的pH。电池电动势E与待测溶液pH关系为: (E的单位为V,K为常数)。下列说法错误的是 A、计工作时,化学能转化为电能 B、玻璃电极玻璃膜内外的差异会引起电池电动势的变化 C、若玻璃电极电势比参比电极低,玻璃电极反应: D、若测得的标准溶液电池电动势E为 , 可标定常数13. 恒容密闭容器中,与在不同温度下发生反应: , 达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
A、计工作时,化学能转化为电能 B、玻璃电极玻璃膜内外的差异会引起电池电动势的变化 C、若玻璃电极电势比参比电极低,玻璃电极反应: D、若测得的标准溶液电池电动势E为 , 可标定常数13. 恒容密闭容器中,与在不同温度下发生反应: , 达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示: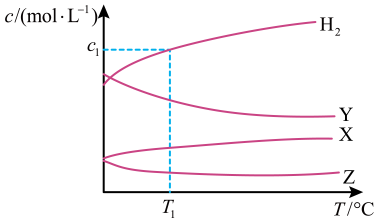
下列说法正确的是
A、该反应的平衡常数随温度升高而增大 B、曲线Y表示随温度的变化关系 C、提高投料比 , 可提高的平衡转化率 D、其他条件不变,与在℃下反应,达到平衡时14. HA是一元弱酸,难溶盐MA的饱和溶液中随c(H+)而变化,不发生水解。实验发现,时为线性关系,如下图中实线所示。
下列叙述错误的是( )
A、溶液时, B、MA的溶度积 C、溶液时, D、HA的电离常数二、非选择题 共58分
-
15. 二氯异氰尿酸钠(结构为
 )是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为 。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
)是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为 。某同学在实验室用如下装置制取二氯异氰尿酸钠(部分夹持装置已略)。
请回答下列问题:
(1)、Cl的价电子轨道表达式为。(2)、仪器a的名称是;仪器D中的试剂是。(3)、A中烧瓶内发生反应的化学方程式为。(4)、装置B的作用是;如果没有B装置,NaOH溶液会产生的不良结果是。(5)、待装置C时(填实验现象),再滴加溶液,反应过程中需要不断通入Cl2的目的是。(6)、实验室测定二氯异氰尿酸钠样品中有效氯的原理如下:准确称取m g样品,配成100mL溶液,取20.00mL所配溶液于碘量瓶中,加入稀和过量KI溶液,充分反应后,加入淀粉溶液,用c mol/LNa2S2O3标准溶液滴定,滴到终点时,消耗Na2S2O3标准溶液的体积为V mL,则样品有效氯含量为%( )
16. 锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。如图是以锗锌矿(主要成分为GeO2、ZnS,另外含有少量的Fe2O3等)为主要原料生产高纯度锗的工艺流程:
已知:GeO2可溶于强碱溶液,生成锗酸盐;GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
(1)、Ge在元素周期表中的位置是 , GeCl4晶体所属类别是。(2)、步骤①NaOH溶液碱浸时发生的离子反应方程式为。(3)、步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为(填“10-15”“15-20”或“20-25”)。编号
加料量(CaCl2/Ge)
母液体积(mL)
过滤后滤液含锗(mg/L)
过滤后滤液pH
锗沉淀率(%)
1
10
500
76
8
93.67
2
15
500
20
8
98.15
3
20
500
2
11
99.78
4
25
500
1.5
12
99.85
(4)、步骤⑤中选择浓盐酸而不选择稀盐酸的原因是。(5)、步骤⑥的化学反应方程式为。(6)、Ge元素的单质及其化合物都具有独特的优异性能,请回答下列问题:①量子化学计算显示含锗化合物H5O2Ge(BH4)3具有良好的光电化学性能。CaPbI3是H5O2Ge(BH4)3的量子化学计算模型,CaPbI3的晶体结构如图所示,若设定图中体心钙离子的分数坐标为( , , ),则分数坐标为(0,0,)的离子是。

②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为rpm,阿伏加德罗常数的值为NA , 则该锗晶体的密度计算式为(不需化简)ρ=g/cm3。
 17. 研究氮的氧化物(如:NO、、)和氮的氢化物都有广泛的用途,如:和可作为运载火箭的推进剂。(1)、已知: 。现将2mol 放入1L恒容密闭容器中,平衡体系中
17. 研究氮的氧化物(如:NO、、)和氮的氢化物都有广泛的用途,如:和可作为运载火箭的推进剂。(1)、已知: 。现将2mol 放入1L恒容密闭容器中,平衡体系中 体积分数()随温度的变化如图所示。
体积分数()随温度的变化如图所示。
①d点v(正)v(逆)(填“>”“=”“<”)。
②a、b、c三点中平衡常数、、由小到大是。
③在时,的平衡转化率为;若平衡时的总压为100kPa,则该反应平衡常数(保留到小数点后1位)。
(2)、NO氧化为的反应为: , 该反应分如下两步进行:Ⅰ. (较快)
Ⅱ. (较慢)
在恒容的密闭容器中充入一定量的NO和 , 保持其它条件不变,控制反应温度分别为和 , c(NO)随t(时间)的变化如图所示。

在反应时间相同时,条件下转化的NO量(填“大于”“等于”“小于”)条件下转化的NO量,其本质原因是(结合反应Ⅰ和Ⅱ的反应热进行分析)。
(3)、肼除了可作火箭的推进剂外,还可用于新型环保电池中,电池工作原理如图所示。
①向移动(填“电极甲”或“电极乙”)。
②该电池的负极反应式为。
18. 以A和芳香烃E为原料制备除草剂茚草酮中间体(Ⅰ)的合成路线如下:
回答下列问题:
(1)、A中所含官能团的名称为。(2)、B→C的反应类型为。(3)、D中碳原子的杂化轨道类型有;其中,电负性最大的元素为。(4)、写出F→G的化学方程式。(5)、B的同分异构体中,满足下列条件的结构有种;其中,核磁共振氢谱有四组峰,且峰面积之比为6∶2∶2∶1的结构简式为。条件:①含有苯环;
②与溶液发生显色反应;
③含有2个甲基,且连在同一个碳原子上。
(6)、利用原子示踪技术追踪G→H的反应过程: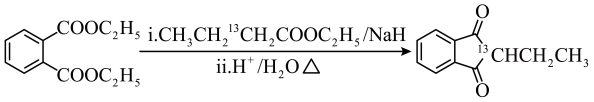
根据上述信息,写出以乙醇和
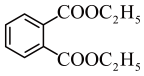 为原料合成
为原料合成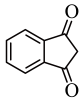 的路线(无机试剂任选) 。
的路线(无机试剂任选) 。