辽宁省辽阳市2024年高考化学第一次模拟考试试卷
试卷更新日期:2024-05-11 类型:高考模拟
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 化学与生活密切相关,下列不涉及化学变化的是( )A、植物油制作奶油 B、太阳能电池发电 C、土豆片遇碘变蓝 D、鸡蛋加热后凝固2. 下列叙述正确的是( )A、熟石膏的化学式:CaSO4·2H2O B、过氧化钠的电子式:
 C、基态氧原子的电子排布图:
C、基态氧原子的电子排布图: D、Ba(OH)2溶液中滴入少量稀硫酸发生反应的离子方程式:
3. 科学家利用FOX-7合成有机物T的反应历程如图所示(部分物质省略),T可用作固体火箭的新型推进剂,下列叙述正确的是( )
D、Ba(OH)2溶液中滴入少量稀硫酸发生反应的离子方程式:
3. 科学家利用FOX-7合成有机物T的反应历程如图所示(部分物质省略),T可用作固体火箭的新型推进剂,下列叙述正确的是( )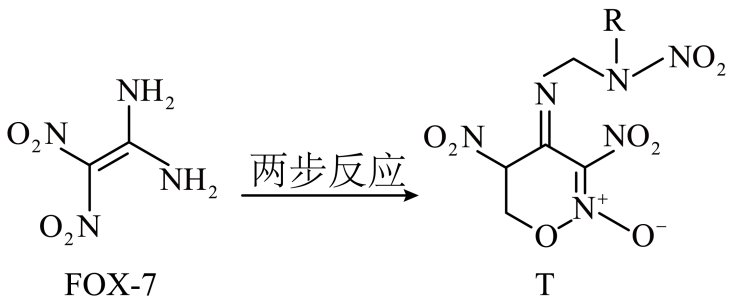 A、FOX-7不能发生加成反应 B、FOX-7不能使酸性KMnO4溶液褪色 C、T属于芳香族化合物 D、已知T中R为乙基,则T含1个手性碳原子4. 下列说法正确的是( )
A、FOX-7不能发生加成反应 B、FOX-7不能使酸性KMnO4溶液褪色 C、T属于芳香族化合物 D、已知T中R为乙基,则T含1个手性碳原子4. 下列说法正确的是( ) A、图甲用
A、图甲用 (杯酚)识别C60和C70 , 操作①②为过滤,操作③为蒸馏
B、图乙装置可用于收集NH3并验满
C、图丙装置可用于干燥MnCl2·4H2O
D、图丁装置可用于探究铁的析氢腐蚀
5. 短周期主族元素X、Y、Z、R的原子序数依次增大,某种性质递变规律如图所示,下列元素性质与元素对应正确的是( )
(杯酚)识别C60和C70 , 操作①②为过滤,操作③为蒸馏
B、图乙装置可用于收集NH3并验满
C、图丙装置可用于干燥MnCl2·4H2O
D、图丁装置可用于探究铁的析氢腐蚀
5. 短周期主族元素X、Y、Z、R的原子序数依次增大,某种性质递变规律如图所示,下列元素性质与元素对应正确的是( ) A、原子半径:F、Cl、Br、I B、电负性:Si、P、S、Cl C、第一电离能:Si、P、S、Cl D、最高化合价:C、N、O、F6. 野生食用菌,是天然的绿色食品,富含多种有益于人体的成分,有的食用菌还有治疗多种疾病的药理作用。下列说法中错误的是( )A、野生食用菌中含有多种多糖体,如β-葡聚糖等,β—葡聚糖与淀粉互为同分异构体 B、野生食用菌中含有多种氨基酸,氨基酸既能与酸反应又能与碱反应 C、野生食用菌中富含多种矿物质和微量元素,如铁、锌等,铁、锌均属于过渡元素 D、野生食用菌所含的蛋白质营养价值高,蛋白质水解的最终产物为氨基酸7. 研究表明:在高压下可发生聚合,甚至改变成键方式。在高压下MgCO3中碳酸根离子形成环状三聚体(如图所示),下列说法正确的是( )
A、原子半径:F、Cl、Br、I B、电负性:Si、P、S、Cl C、第一电离能:Si、P、S、Cl D、最高化合价:C、N、O、F6. 野生食用菌,是天然的绿色食品,富含多种有益于人体的成分,有的食用菌还有治疗多种疾病的药理作用。下列说法中错误的是( )A、野生食用菌中含有多种多糖体,如β-葡聚糖等,β—葡聚糖与淀粉互为同分异构体 B、野生食用菌中含有多种氨基酸,氨基酸既能与酸反应又能与碱反应 C、野生食用菌中富含多种矿物质和微量元素,如铁、锌等,铁、锌均属于过渡元素 D、野生食用菌所含的蛋白质营养价值高,蛋白质水解的最终产物为氨基酸7. 研究表明:在高压下可发生聚合,甚至改变成键方式。在高压下MgCO3中碳酸根离子形成环状三聚体(如图所示),下列说法正确的是( ) A、该种环状三聚体是一种有机阴离子 B、该种环状三聚体中,O的杂化方式有2种 C、高压下,相较于单个碳酸根离子,该种环状三聚体更稳定 D、该种环状三聚体与Mg2+形成的化合物中,化学键种类有极性共价键、离子键及配位键8. 代表阿伏加德罗常数的值。下列说法正确的是( )A、11.2LCO2含π键数目为 B、电解熔融CuCl2 , 阴极增重6.4g,外电路中通过电子的数目为 C、NaCl和NH4Cl的混合物中含1molCl- , 则混合物中质子数为 D、1.7gNH3完全溶于1LH2O所得的溶液中,NH3·H2O微粒的数目为9. 氢键在电池中的应用广泛,可精细调控电极和电解质的性质,提高可充电电池的性能。某可充电电池装置如图所示(其他阴离子不参与反应,已略去)。下列叙述错误的是( )
A、该种环状三聚体是一种有机阴离子 B、该种环状三聚体中,O的杂化方式有2种 C、高压下,相较于单个碳酸根离子,该种环状三聚体更稳定 D、该种环状三聚体与Mg2+形成的化合物中,化学键种类有极性共价键、离子键及配位键8. 代表阿伏加德罗常数的值。下列说法正确的是( )A、11.2LCO2含π键数目为 B、电解熔融CuCl2 , 阴极增重6.4g,外电路中通过电子的数目为 C、NaCl和NH4Cl的混合物中含1molCl- , 则混合物中质子数为 D、1.7gNH3完全溶于1LH2O所得的溶液中,NH3·H2O微粒的数目为9. 氢键在电池中的应用广泛,可精细调控电极和电解质的性质,提高可充电电池的性能。某可充电电池装置如图所示(其他阴离子不参与反应,已略去)。下列叙述错误的是( ) A、放电时,电极X为负极 B、放电时,阳离子向电极Y迁移 C、充电时,电极Y与电源正极连接 D、充电时,电极X的电极反应式为10. 氧化铈(CeO2)常用作玻璃工业添加剂,在其立方晶胞中掺杂Y2O3 , Y3+占据原来Ce4+的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用,CeO2晶胞中Ce4+与最近O2-的核间距为apm。下列说法正确的是( )
A、放电时,电极X为负极 B、放电时,阳离子向电极Y迁移 C、充电时,电极Y与电源正极连接 D、充电时,电极X的电极反应式为10. 氧化铈(CeO2)常用作玻璃工业添加剂,在其立方晶胞中掺杂Y2O3 , Y3+占据原来Ce4+的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用,CeO2晶胞中Ce4+与最近O2-的核间距为apm。下列说法正确的是( )

已知:。
A、已知M点原子的分数坐标为(0,0,0),则N点原子的分数坐标为(1,0,1) B、CeO2晶胞中与Ce4+最近的Ce4+的个数为6 C、CeO2晶体的密度为 D、若掺杂Y2O3后得到n(CeO2):n(Y2O3)=0.6:0.2的晶体,则此晶体中O2-的空缺率为10%11. 下列实验设计及原理都错误的是( )选项
实验设计
原理
A
利用NaOH溶液鉴别Al与Mg
Al会与NaOH溶液反应,而Mg不与其反应
B
分别加热Na2CO3与NaHCO3固体,并将可能产生的气体通入澄清石灰水,鉴别Na2CO3与NaHCO3
碳酸钠受热易分解,生成的CO2使澄清石灰水变浑浊
C
利用苯鉴别碘单质与高锰酸钾
二者在苯中的溶解度不同
D
利用紫色石蕊试液鉴别二氧化碳与二氧化硫
SO2具有漂白性
A、A B、B C、C D、D12. 某小组为探究NaHSO3和NaHCO3溶液的相关性质,进行如下实验:常温下,用pH计测得NaHCO3溶液的pH为9.7,向该溶液中缓慢通入SO2 , 使溶质恰好变为NaHSO3(忽略体积变化,CO2全部逸出),测得NaHSO3溶液的pH为5.28。一段时间后,取少量NaHSO3溶液,滴加BaCl2溶液,产生白色沉淀,加入过量的盐酸,白色沉淀不溶解。下列叙述正确的是( )A、产生的白色沉淀为BaSO3 B、常温下, C、NaHSO3溶液中: D、久置于空气中的NaHSO3溶液的pH可能增大13. 常温下,在MoS2催化下可实现CH4向CH3OH的直接转化。原理如图。下列说法正确的是( ) A、反应过程中,Mo的化合价未发生变化 B、生成甲醇的总反应为 C、MoS2降低了总反应的焓变 D、反应过程中有非极性键的断裂和形成14. 异丁烯(
A、反应过程中,Mo的化合价未发生变化 B、生成甲醇的总反应为 C、MoS2降低了总反应的焓变 D、反应过程中有非极性键的断裂和形成14. 异丁烯( )是重要的化工原料,可由异丁醇(
)是重要的化工原料,可由异丁醇( )脱水制得。异丁醇催化脱水时发生如下反应:
)脱水制得。异丁醇催化脱水时发生如下反应:反应1(主反应):

 (异丁烯,g)
(异丁烯,g)反应2(副反应):2


保持压强为100MPa不变,向一定体积的密闭容器中充入V(异丁醇)的混合气体(不参与反应),平衡时所得异丁醇的转化率、异丁烯的产率与温度的关系如图所示。下列说法错误的是( )
 A、反应1为消去反应,反应2为加成反应 B、保持其他条件不变,升高温度,反应1和反应2平衡均向正反应方向移动 C、100MPa、200℃时,V(异丁醇)起始比值越小,平衡时异丁烯的产率越高 D、100MPa、200℃时,若起始时将V(异丁醇)改为V(异丁醇) , 平衡时异丁烯的产率降低15. 常温下,用HCl(g)调节SrF2浊液的pH,测得在通入HCl(g)的过程中,体系中-lgc(X)(X代表Sr2+或F-)与的关系如图所示。下列说法错误的是( )
A、反应1为消去反应,反应2为加成反应 B、保持其他条件不变,升高温度,反应1和反应2平衡均向正反应方向移动 C、100MPa、200℃时,V(异丁醇)起始比值越小,平衡时异丁烯的产率越高 D、100MPa、200℃时,若起始时将V(异丁醇)改为V(异丁醇) , 平衡时异丁烯的产率降低15. 常温下,用HCl(g)调节SrF2浊液的pH,测得在通入HCl(g)的过程中,体系中-lgc(X)(X代表Sr2+或F-)与的关系如图所示。下列说法错误的是( )
已知:SrF2为微溶于水,溶于盐酸,不溶于氢氟酸、乙醇和丙酮的固体。
A、 B、L2表示的变化情况 C、随着HCl的加入,SrF2溶解度逐渐增大 D、m、n点对应的溶液中均存在二、非选择题:本题共4小题,共55分。
-
16. 黄金除具备货币商品属性外,由于其优良特性,还可用作珠宝装饰、金触媒、超导体等。以含砷金精矿(成分为Au、FeAsS)为原料提炼黄金的工艺流程如图,请回答下列问题:
 (1)、焙烧时,FeAsS转化为两种有毒物质和一种红棕色固体,写出此反应的化学方程式:。(2)、焙烧温度对硫、砷的脱除率的影响如图所示,则最适宜的焙烧温度为℃,原因为。
(1)、焙烧时,FeAsS转化为两种有毒物质和一种红棕色固体,写出此反应的化学方程式:。(2)、焙烧温度对硫、砷的脱除率的影响如图所示,则最适宜的焙烧温度为℃,原因为。 (3)、磨砂的目的是。(4)、氰化过程中,通入O2将Au转化为Na[Au(CN)2](易溶于水),写出该反应的离子方程式:。(5)、滤渣的主要成分为、。(6)、at含Auw%的含砷金精矿通过上述流程(假设Au的损失率为5%)可制得tAu。17. KMnO4是生活中常用的消毒剂。已知在酸性介质中墨绿色的易发生歧化反应,生成和MnO2 , 回答下列问题:(1)、
(3)、磨砂的目的是。(4)、氰化过程中,通入O2将Au转化为Na[Au(CN)2](易溶于水),写出该反应的离子方程式:。(5)、滤渣的主要成分为、。(6)、at含Auw%的含砷金精矿通过上述流程(假设Au的损失率为5%)可制得tAu。17. KMnO4是生活中常用的消毒剂。已知在酸性介质中墨绿色的易发生歧化反应,生成和MnO2 , 回答下列问题:(1)、实验(一)制备KMnO4。
“熔融”时分批加入MnO2粉末的目的是 , “熔融”时不需选用的仪器是(填标号)。
A.铁坩埚 B.玻璃棒 C.泥三角 D.坩埚钳
(2)、“抽滤”时选择乙装置,相对甲,乙的主要优点是(任写一条)。 (3)、“歧化”时锰元素进入产品的百分率约为%(保留三位有效数字),用盐酸代替CO2的后果是。(4)、工业上,常用“电解”代替“歧化”,提高锰元素利用率,电解的总反应方程式为。(5)、实验(二)测定产品纯度。
(3)、“歧化”时锰元素进入产品的百分率约为%(保留三位有效数字),用盐酸代替CO2的后果是。(4)、工业上,常用“电解”代替“歧化”,提高锰元素利用率,电解的总反应方程式为。(5)、实验(二)测定产品纯度。取wgKMnO4溶于水配成250mL溶液,取25.00mL于锥形瓶中,加入适量稀硫酸酸化,用Na2C2O4标准溶液滴定至终点,消耗标准溶液VmL。
下列叙述正确的是____(填标号)。
A、滴定终点时溶液由无色变为紫红色 B、滴定时眼睛始终注视锥形瓶中溶液颜色变化 C、若锥形瓶未干燥,测得结果会偏高 D、本实验需要托盘天平、量筒、容量瓶、滴定管等(6)、该产品的纯度为。18. 氮及其化合物在生产、环保研究等方面用途非常广泛,回答下列问题:(1)、用浓氨水除去Fe(OH)3样品中少量的Cu(OH)2 , 生成[Cu(NH3)4]2+ , 1mol[Cu(NH3)4]2+含molσ键。(2)、硝酸厂尾气可以回收制备硝酸。已知:①
②
, 。
(3)、在隔绝空气的密闭容器中发生反应:FeSO4(aq)+NO(g)Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是____。(填标号)A、溶液颜色不变,反应达到平衡状态 B、其他条件不变,充入少量O2 , 平衡不移动 C、其他条件不变,加少量FeSO4 , 溶液颜色加深 D、其他条件不变,微热,溶液颜色加深(4)、向一恒容密闭容器中充入适量NH3和O2 , 在一定条件下发生反应,氧化产物是N2、NO、NO2、N2O中的一种,达到平衡时改变温度,反应物和生成物的浓度与温度关系如图所示: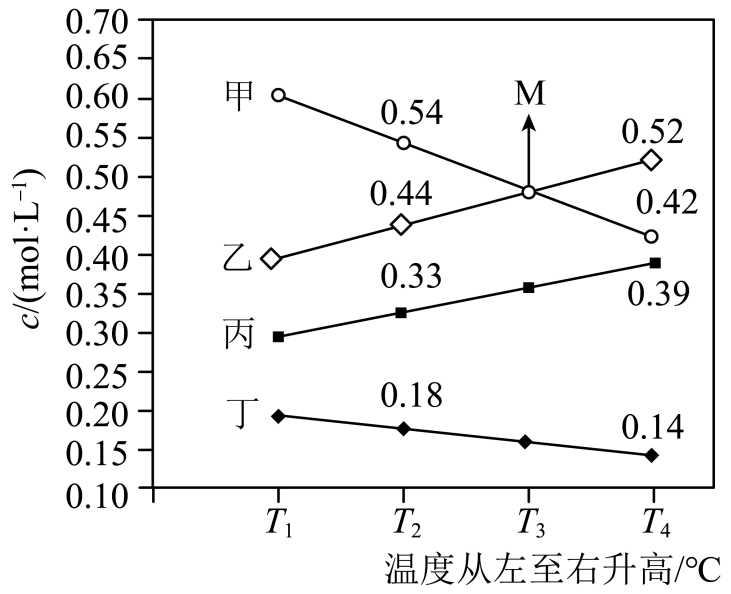
①甲是(填化学式),写出该反应的化学方程式:。
②正反应(填“>”“<”或“=”)0,判断依据是
③T3℃时NH3的平衡转化率为。
19. 有机化合物H为某药物中间体,一种合成化合物H的路线如图。
已知:Ⅰ.(R为烃基或H原子,X为卤素原子,下同)
Ⅱ.

Ⅲ.

回答下列问题:
(1)、A的名称为 , H中含氧官能团的名称为醚键、。(2)、C的结构简式为。(3)、E→F的化学方程式为。(4)、B有多种同分异构体,其中能发生银镜反应和水解反应的芳香族化合物的同分异构体有种(不考虑立体异构),核磁共振氢谱有4组峰的同分异构体的结构简式为。(任写一个)(5)、 的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为和。
的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为和。