广东省湛江市雷州市重点中学2023-2024学年高一下学期化学开学试题
试卷更新日期:2024-05-11 类型:开学考试
一、选择题,本题共16小题,第1-10题每小题2分,第11-16题每小题4分,共44分。每小题只有一个选项符合题意。
-
1. 中华文明源远流长。下列文物主要由合金材料制成的是( )




A.鎏金铜浮屠
B.素面淡黄琉璃茶盏
C.广彩人物纹大瓷碗
D.汉白玉菩萨像
A、A B、B C、C D、D2. 月球土壤中含有Th(钍)元素,是一种天然的放射性核素。2022年,我国科研团队采用和 (铪)熔合蒸发技术合成了新核素 。下列说法错误的是( )A、化学性质不活泼 B、含有176个质子 C、、互为同位素 D、、分别含有142个和117个中子3. 实现下列变化,需要加入氧化剂的是( )A、HCl→Cl2 B、HCl→H2 C、I2→KI D、NaCl→AgCl4. 在明代宋应星所著的《天工开物》中有关火法炼锌的记载,其反应的化学方程式为:。下列说法正确的是( )A、ZnCO3属于氧化物 B、C在该反应中作还原剂 C、Zn是氧化产物 D、CO是酸性氧化物5. 检验芹菜中铁元素的实验操作有:①剪碎芹菜,研磨;②取少量滤液,滴加稀;③加入蒸馏水,搅拌,过滤;④滴加几滴KSCN溶液,振荡,观察。正确操作顺序为( )A、③①④② B、①②③④ C、②①④③ D、①③②④6. 规范操作是实验安全和成功的重要保证。下列操作正确的是( )



A.倾倒液体
B.pH测定
C.从食盐水中获取NaCl
D.闻气体
A、A B、B C、C D、D7. 下列反应的离子方程式书写正确的是( )A、海水提镁中用石灰乳沉镁:Mg2++2OH-=Mg(OH)2 B、用小苏打可以缓解胃酸过多引起的不适 C、用稀盐酸除去铁制品表面的锈层:Fe2O3+6H+=2Fe3++3H2O D、向硫酸亚铁溶液中加入铁粉防止其氧化:Fe3++Fe=2Fe2+8. 实验室用如图所示装置制备干燥的Cl2并探究其性质。其中,a为湿润的淀粉-KI试纸,b为湿润的红纸条。下列说法正确的是( ) A、上述装置用浓盐酸和MnO2反应制备Cl2 , 用向下排空气法收集 Cl2 B、装置乙中为浓硫酸,装置丙中为NaOH溶液 C、一段时间后,装置丁中a变蓝,反应的离子方程式为Cl2+2I-=I2+2Cl- D、装置丁中b褪色,说明Cl2具有漂白性9. 下列各组离子在指定溶液中一定能大量共存的是( )A、滴加KSCN溶液显红色的溶液中:、、、 B、能与Al反应产生的溶液:、、、 C、无色透明溶液中:、、、 D、溶液中:、、、10. 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是( )
A、上述装置用浓盐酸和MnO2反应制备Cl2 , 用向下排空气法收集 Cl2 B、装置乙中为浓硫酸,装置丙中为NaOH溶液 C、一段时间后,装置丁中a变蓝,反应的离子方程式为Cl2+2I-=I2+2Cl- D、装置丁中b褪色,说明Cl2具有漂白性9. 下列各组离子在指定溶液中一定能大量共存的是( )A、滴加KSCN溶液显红色的溶液中:、、、 B、能与Al反应产生的溶液:、、、 C、无色透明溶液中:、、、 D、溶液中:、、、10. 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
环保工程师用熟石灰处理酸性废水
熟石灰具有碱性
B
面包师用小苏打作发泡剂烘焙面包
NaHCO3可与酸反应
C
工人将模具干燥后再注入熔融钢水
铁与H2O高温下会反应
D
用活性炭除去汽车内的异味
活性炭具有吸附性
A、A B、B C、C D、D11. 氯元素是一种重要的“成盐元素”。部分含氯物质的分类与相应化合价关系如图所示。下列说法不正确的是( ) A、存在f→d→b的转化关系 B、a溶液和f溶液混合可以制得b C、d的稳定性差,其溶液久置即为a溶液 D、b具有漂白性,能将湿润的有色布条褪色12. a~f六种短周期主族元素在周期表的位置如下表所示,其中a原子最外层电子数是4。下列叙述正确的是( )
A、存在f→d→b的转化关系 B、a溶液和f溶液混合可以制得b C、d的稳定性差,其溶液久置即为a溶液 D、b具有漂白性,能将湿润的有色布条褪色12. a~f六种短周期主族元素在周期表的位置如下表所示,其中a原子最外层电子数是4。下列叙述正确的是( )a
b
c
d
e
f
A、原子半径大小: B、气态氢化物的稳定性: C、e的氧化物能分别与d、f的最高价氧化物对应水化物发生反应 D、将d的单质加入到e的盐溶液中,能发生置换反应得到e的单质13. 设为阿伏加德罗常数的值。侯氏制碱法涉及和等物质。下列叙述正确的是( )A、1molNH4+含有的电子数目为11NA B、完全分解,得到的分子数目为 C、溶液中,数目为 D、和的混合物中含 , 则混合物中质子数为14. 下列实验操作或现象与实验目的均正确且匹配的是( )选项
实验操作或现象
实验目的
A
固体受热熔化后可以导电
证明是电解质
B
将饱和溶液滴入稀溶液
制备胶体
C
用洁净的玻璃棒蘸取溶液进行焰色试验
检验溶液中含有
D
将铝片插入溶液中,短时间内无明显现象
氧化性:
A、A B、B C、C D、D15. 下表中对“陈述”的解释错误的是( )选项
陈述
解释
A
用于治疗胃酸过多
可与盐酸反应
B
向与反应后的溶液中滴入溶液,产生白色沉淀
与水反应生成氢氧化钠,与反应生成
C
金属钠应保存在煤油中隔绝空气
常温下,金属钠露置在空气中会生成过氧化钠
D
过氧化钠可用作航天员的供氧剂
能和、反应生成
A、A B、B C、C D、D16. 实验室模拟以含铁废渣(主要成分为FeO、Fe2O3 , 杂质为Cu2(OH)2CO3、CuO)为原料制备七水硫酸亚铁(FeSO4·7H2O)的流程如图所示。下列说法错误的是( ) A、“除铜”步骤的反应类型有置换反应和化合反应 B、含铁废渣中的FeO、Fe2O3、CuO均属于碱性氧化物 C、实验室需要500 mL0.1 mol•L-1FeSO4溶液,需要称取7.6 g FeSO4·7H2O配制 D、铜器生锈[主要成分为Cu2(OH)2CO3]的反应原理为:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
A、“除铜”步骤的反应类型有置换反应和化合反应 B、含铁废渣中的FeO、Fe2O3、CuO均属于碱性氧化物 C、实验室需要500 mL0.1 mol•L-1FeSO4溶液,需要称取7.6 g FeSO4·7H2O配制 D、铜器生锈[主要成分为Cu2(OH)2CO3]的反应原理为:2Cu+O2+H2O+CO2=Cu2(OH)2CO3二、非选择题,本题共4小题,共56分。
-
17. 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物的“价一类”二维图的部分信息如图:
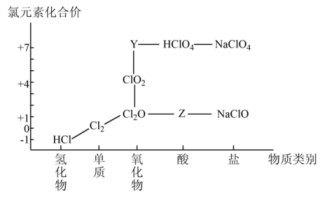
回答下列问题:
(1)、据图中信息,写出Y、Z的化学式:、。(2)、已知高氯酸()是强酸,写出高氯酸溶液与氢氧化钠溶液反应的离子方程式:。(3)、氯气既有氧化性又有还原性,结合上图说明理由:。(4)、二氧化氯()为新时代绿色消毒剂,制备原理为:①按照物质类别对上述反应中的各物质进行分类,未涉及的物质类别是(填序号)。
A.金属氧化物 B.非金属氧化物 C.酸 D.盐
②发生还原反应的产物是(写化学式);该反应(填“能”或“不能”)用稀硫酸代替盐酸。
18. 有X、Y、Z、M、R五种短周期的主族元素,部分信息如下表所示:X
Y
Z
M
R
原子半径/nm
0.086
0.186
0.074
0.099
主要化合价
+4、-4
-2
-1、+7
其它信息
某种核素无中子
某种核素用于考古
短周期主族元素中原子半径最大
(1)、写出X元素中中子数为2的核素的原子符号。(2)、R在元素周期表中的位置是。(3)、Z原子形成的简单离子的半径M原子形成的简单离子半径(填“大于”或“小于”)(4)、化合物Z2M2的阴阳离子个数比是。(5)、元素X与Z可以形成一种离子化合物ZX,写出该离子化合物的化学式;将该离子化合物ZX加入到水中,滴加酚酞可以观察到水溶液显红色,同时有气泡生成,写出该过程发生的化学反应方程式。(6)、下列事实能作为比较元素Y与R的非金属性相对强弱依据的是____。A、元素R的最高正化合价高于Y B、稳定性:XR>YX4 C、元素R最外层电子数多于Y D、酸性HR>H2XO319. 某硫酸厂用硫铁矿焙烧后的烧渣(主要成分为、、 , 不考虑其他杂质)制备绿矾粗产品的流程如下:
已知是酸性氧化物。
回答下列问题:
(1)、流程中两次“操作”的名称是。(2)、“还原”步骤中溶液由黄色变浅绿色,写出溶液变浅绿色的离子方程式。(3)、“调pH至5-6”步骤中,写出生成的离子方程式。(4)、鉴别滤液a中金属阳离子的实验方案如下,按要求填空:操作
现象
结论或离子方程式
步骤1:取少量滤液a进行①(填实验名称)。
火焰呈②。
滤液a中含有。
步骤2:另取少量滤液a于试管中,依次滴入③(填化学式)溶液和氯水。
溶液先无红色,后变红色。
滤液a中含有 , 不含。写出该过程中属于氧化还原反应的离子方程式④。
20. 次氯酸(HClO)消毒液高效安全,适用于一般物体表面消毒、手部消毒,以及地面、空间和环境消毒。如图,在装置D中制得颜色类似于氯气的气体,装置E中得到次氯酸(HClO)。已知气体在42℃以上会发生分解,与水反应生成HClO。 (1)、图中,装置A是采用与浓盐酸反应制取氯气的装置,则装置A中发生反应的离子方程式为 , 装置A为下图的(填标号)。
(1)、图中,装置A是采用与浓盐酸反应制取氯气的装置,则装置A中发生反应的离子方程式为 , 装置A为下图的(填标号)。 (2)、在装置D中,需用干燥纯净的与潮湿的碳酸钠反应制备 , 为获得干燥纯净的 , 装置B、C中应分别盛放、。(3)、D中反应生成的气体进入E装置中生成HClO,该反应的化学方程式为。(4)、装置F中盛装的试剂为 , 该装置的作用为。(5)、实验时,需持续通入干燥空气的作用是
(2)、在装置D中,需用干燥纯净的与潮湿的碳酸钠反应制备 , 为获得干燥纯净的 , 装置B、C中应分别盛放、。(3)、D中反应生成的气体进入E装置中生成HClO,该反应的化学方程式为。(4)、装置F中盛装的试剂为 , 该装置的作用为。(5)、实验时,需持续通入干燥空气的作用是