四川省绵阳南山名校2023-2024学年高一下学期化学入学考试试题
试卷更新日期:2024-05-11 类型:开学考试
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
-
1. 中华文化源远流长、博大精深。下列说法不正确的是( )A、先秦文献《考工记》记录了六类青铜器物的合金成分配比,合金的熔点一般比纯金属的低 B、《本草经集注》中记载了区分硝石()和朴硝()的方法:“以火烧之,紫青烟起,乃真硝石也”,二者可以利用“焰色试验”区分 C、《神农本草经》中提到“白青[]得铁化为铜”,其中白青属于碱 D、“蜡炬成灰泪始干”、“爆竹声中一岁除”中均涉及氧化还原反应2. 下列化学用语正确的是( )A、的电子式
 B、次氯酸的结构式:
C、的电子式
B、次氯酸的结构式:
C、的电子式 D、的结构示意图
D、的结构示意图 3. 日本福岛核废水排海引起舆论风波,核废水中不只含有放射性氚,真正具有伤害性的,还有6种放射性元素,分别是碘、铯和铯、碳、钴和锶。下列叙述正确的是( )A、原子所含中子数与质子数之差为25 B、和互称为同素异形体 C、铯的核外电子数为65 D、和的核外电子数之差为44. 在下列物质中,所含化学键类型相同的一组是( )A、Na2O2、H2O2 B、Na2S、SO2 C、CCl4、CH4 D、NH4Cl、HCl5. 下列物质的性质与用途具有对应关系的是( )A、二氧化硫具有氧化性,可用来漂白织物 B、易液化,汽化时吸收大量的热,液氨可用作制冷剂 C、氧化铝耐高温,制作的坩埚可用来加热熔化碱性物质 D、碳酸氢钠能与碱反应,因此可用作食品膨松剂6. 在某澄清透明溶液中,能大量共存的一组离子是( )A、、、、 B、、、、 C、、、、 D、、、、7. 用表示阿伏加德罗常数的值,下列叙述正确的是( )A、溶于足量水中,转移的电子数为 B、与的混合物中所含中子数为 C、溶液中含有分子的数目为 D、与的混合气体含有原子的数目为8. 部分含氯物质的分类与相应氯元素的化合价关系如图所示。下列说法不正确的是( )
3. 日本福岛核废水排海引起舆论风波,核废水中不只含有放射性氚,真正具有伤害性的,还有6种放射性元素,分别是碘、铯和铯、碳、钴和锶。下列叙述正确的是( )A、原子所含中子数与质子数之差为25 B、和互称为同素异形体 C、铯的核外电子数为65 D、和的核外电子数之差为44. 在下列物质中,所含化学键类型相同的一组是( )A、Na2O2、H2O2 B、Na2S、SO2 C、CCl4、CH4 D、NH4Cl、HCl5. 下列物质的性质与用途具有对应关系的是( )A、二氧化硫具有氧化性,可用来漂白织物 B、易液化,汽化时吸收大量的热,液氨可用作制冷剂 C、氧化铝耐高温,制作的坩埚可用来加热熔化碱性物质 D、碳酸氢钠能与碱反应,因此可用作食品膨松剂6. 在某澄清透明溶液中,能大量共存的一组离子是( )A、、、、 B、、、、 C、、、、 D、、、、7. 用表示阿伏加德罗常数的值,下列叙述正确的是( )A、溶于足量水中,转移的电子数为 B、与的混合物中所含中子数为 C、溶液中含有分子的数目为 D、与的混合气体含有原子的数目为8. 部分含氯物质的分类与相应氯元素的化合价关系如图所示。下列说法不正确的是( ) A、b→a一定需要加还原剂才能进行 B、c可作为一种新型自来水消毒剂 C、f→d可以通过加稀硫酸实现转化 D、一定条件下a和f可能发生反应得到b9. 某小组同学探究和的性质及相互转化,实验如下(夹持装置已略去,气密性已检验)。以下说法错误的是( )
A、b→a一定需要加还原剂才能进行 B、c可作为一种新型自来水消毒剂 C、f→d可以通过加稀硫酸实现转化 D、一定条件下a和f可能发生反应得到b9. 某小组同学探究和的性质及相互转化,实验如下(夹持装置已略去,气密性已检验)。以下说法错误的是( )实验Ⅰ
实验Ⅱ

 A、实验Ⅰ,A中澄清石灰水无明显变化,B中澄清石灰水变浑浊 B、实验Ⅱ,方框中的试剂a为饱和碳酸氢钠溶液 C、实验Ⅱ中,一段时间之后,可观察到烧杯中有细小晶体析出 D、等物质的量的、分别与足量盐酸反应,生成的更多10. 随原子序数的递增,八种短周期元素的原子半径、最高正价或最低负价的变化如图所示。
A、实验Ⅰ,A中澄清石灰水无明显变化,B中澄清石灰水变浑浊 B、实验Ⅱ,方框中的试剂a为饱和碳酸氢钠溶液 C、实验Ⅱ中,一段时间之后,可观察到烧杯中有细小晶体析出 D、等物质的量的、分别与足量盐酸反应,生成的更多10. 随原子序数的递增,八种短周期元素的原子半径、最高正价或最低负价的变化如图所示。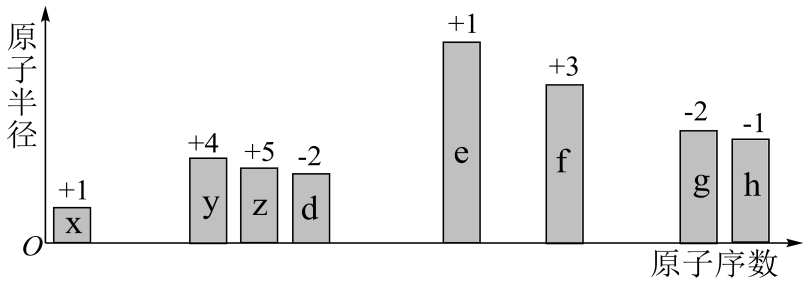
下列叙述正确的是( )
A、离子半径的大小顺序:d<f<e B、d与e组成的化合物一定只含离子键 C、x、z、d组成的化合物一定是共价化合物 D、h、g对应的阴离子还原性:h<g11. 下列离子方程式书写正确的是( )A、与溶液的反应: B、将粉溶解于过量稀硫酸中: C、向溶液中通入少量: D、向中滴加溶液至恰好沉淀完全:12. 气体与足量溶液完全反应后,再加入溶液,发生如下反应:①;②。下列说法正确的是( )A、氧化性: B、若有6.72L完全反应,最终消耗0.2mol C、反应①中被还原的物质是 D、反应②中,1mol参加反应,转移电子的数目为13. 下列实验目的、方案设计和现象、结论都正确的是( )选项
实验目的
方案设计和现象
结论
A
验证浓硫酸的性质
将浓硫酸滴入蔗糖中并搅拌,得到黑色蓬松的固体,并产生刺激性气味的气体
浓硫酸具有强氧化性和脱水性
B
探究钠在空气中久置后所得固体成分
取少量固体,加入蒸馏水,有气体产生
固体中一定含
C
检验某溶液中是否含有
取少量待检液于试管中,滴加新制氯水后滴加溶液,溶液变为红色
该溶液含有
D
检验和浓盐酸反应后是否有酸剩余
取少量反应后的溶液于试管中,依次加入稀硝酸、溶液
产生大量白色沉淀,则盐酸有剩余
A、A B、B C、C D、D14. 一块的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加至溶液中无存在,加热除去多余的。当加入溶液至沉淀量最多时,所得沉淀质量为。则该合金中铁的质量为( )A、 B、 C、 D、二、(本题包括4小题,共58分)
-
15. 短周期主族元素、、、、在元素周期表中的位置如图所示,其中为能壳中含量最高的金属元素。

请用化学用语回答下列问题:
(1)、元素在周期表中的位置: , 的空间结构为形,上述非金属元素形成的简单氢化物中沸点最高的为(用化学式表示)。(2)、、、对应的最高价含氧酸酸性由强到弱的顺序是(用化学式表示)。(3)、与同主族且相邻,、、可形成一个三原子分子,且每个原子均达到8电子稳定结构,则该分子的结构式为;元素氢与元素、元素氢与元素均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,请写出该反应的化学方程式:。(4)、由元素、形成的物质与由元素和元素氢形成的化合物可发生以下反应:
①写出的电子式 , 含有的化学键类型为。
②写出溶液与溶液反应的离子方程式。
16. 是一种高效、安全的消毒剂。实验室制备的原理是用亚氯酸钠固体与纯净、干燥的氯气反应:。如图是实验室用于制备和收集一定量纯净的的装置(部分夹持装置已省略)。 (1)、装有的仪器名称为 , 装置的作用是。(2)、圆底烧瓶中发生反应的离子方程式为 , 在该反应中浓盐酸表现的性质是。(3)、实验中相关气体在不同溶剂中的溶解性如下表所示,装置中的试剂是(填化学式)。(4)、如图是一些常用的气体收集装置,处应选用的收集装置是(填序号)
(1)、装有的仪器名称为 , 装置的作用是。(2)、圆底烧瓶中发生反应的离子方程式为 , 在该反应中浓盐酸表现的性质是。(3)、实验中相关气体在不同溶剂中的溶解性如下表所示,装置中的试剂是(填化学式)。(4)、如图是一些常用的气体收集装置,处应选用的收集装置是(填序号)水
极易溶
可溶
极易溶
难溶
易溶
难溶
 (5)、泡腾片由、固体酸及辅助剂混合制得,是一种家用消毒用品。使用时只需将泡腾片放入水中,分钟即可完全溶解并释放出。泡腾片在使用时需要加水,请补全泡腾片在水中发生反应的离子方程式:
(5)、泡腾片由、固体酸及辅助剂混合制得,是一种家用消毒用品。使用时只需将泡腾片放入水中,分钟即可完全溶解并释放出。泡腾片在使用时需要加水,请补全泡腾片在水中发生反应的离子方程式:=
(6)、若快速制备氯气时,有以下两种方法,①与浓盐酸;②与浓盐酸。若产生等量的 , 则①与②转移的电子数之比为;通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的高低。和在消毒时自身均被还原 , 则的消毒效率是的倍(保留一位小数)。17. 工业上用铝土矿(主要成分是 , 还含有、)提取氧化铝做冶炼铝的原料(纯净的),某研究性学习小组设计了如图提取流程:
请回答下列问题:
(1)、操作①的名称是 , 操作③用到的仪器有酒精灯、三脚架、泥三角、。(2)、写出加入过量溶液发生反应的主要离子方程式:。(3)、流程中的最好选用 , 发生反应的离子方程式为。(4)、写出反应⑤的化学反应方程式 , 上述流程中可以循环利用的物质为(填化学式)。(5)、有一种含铁、硅等元素的矿石,其主要成分的化学式为 , 该物质中+2价铁与+3价铁的物质的量之比为。将该矿石用足量(填盐酸或硫酸)溶解后,加入过量铜粉使溶液中的铁元素全部变为 , 过滤后滤液用的酸性溶液与反应,用去溶液。该矿石中铁元素的质量分数为(用含、、的代数式表示)。18. 利用课学上学到的知识来解决生活中的问题是我们学习的重要目的。(1)、某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。①将鸡蛋壳(主要成分为)泡进食醋中,发现有气泡产生,请写出该反应的离子方程式:。
②同学测出从超市购买的食醋中醋酸()含量为 , 则食醋中醋酸含量为。
(2)、如图是化学实验室浓盐酸试剂标签上的部分内容。丙同学计划用该浓盐酸配制的稀盐酸,现实验仅需要稀盐酸 , 可供选用的仪器有:①胶头滴管:②烧瓶;③烧杯:④药匙;⑤玻璃棒。请回答下列问题:盐酸 化学纯()()
品名:盐酸
化学式:
相对分子质量:
密度:
质量分数:
①配制稀盐酸时,还缺少的仪器有。
②经计算,配制的稀盐酸需要量取上述浓盐酸的体积为(结果保留1位小数)。
③测定所配制的稀盐酸,发现其浓度大于 , 引起误差的原因可能是。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(3)、某同学利用鸡蛋壳和配制好的稀盐酸溶液制备 , 查询相关书籍后,设计了如下装置测定的相对分子质量。
①装置中的饱和溶液可以吸收。
②实验前测得装置(含水)重量为 , 实验完毕后装置(含水)重量为 , 中量筒读数为 , 已知相同条件下密度为 , 计算实验条件下,气体摩尔体积为 , (保留2位小数),请根据以上数据用相对密度法计算的相对分子质量为(保留2位小数)。