重庆市开州区文峰教育集团2023-2024学年九年级下学期化学期中试题
试卷更新日期:2024-05-10 类型:期中考试
一、选择题(本题包括16小题,每小题2分,共32分。每小题只有一个正确答案)
-
1. “构建人类命运共同体”体现了人与自然可持续发展的理念。以下做法不符合这一理念的是( )A、工厂污水处理后排放 B、大肆开采矿物资源 C、推广家用燃料“煤改气” D、提倡垃圾分类和回收利用2. 下列归类正确的是( )A、碱性溶液:氨水、苏打水、肥皂水 B、酸:HCl、H2SO4、NaHSO4 C、化石燃料:煤、可燃冰、生物质能 D、碱:烧碱、熟石灰、纯碱3. 用浓硫酸、水、锌粒等制取氢气并检验氢气的纯度,下列操作或装置正确的是( )A、
 读取液体体积
B、
读取液体体积
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 制取氢气
D、
制取氢气
D、 检验氢气纯度
4. 物质的性质与用途密切相关,下列物质的性质与用途对应关系正确的是( )A、氦气化学性质稳定,可用于制造多用途电光源 B、活性炭具有吸附性,可用于淡化海水 C、熟石灰、苛性钠和浓硫酸均能吸收水分,可用于干燥二氧化碳 D、干冰升华吸热,可用于人工降雨5. 折耳根是川渝人民喜好的菜肴,其内含有鱼腥草素。鱼腥草素不溶于水,溶于乙醇、乙醚等溶剂,有清热解毒、利尿通淋等作用。下列说法错误的是( )A、鱼腥草素由碳、氢、氧三种元素组成 B、个鱼腥草素分子中含有个原子 C、鱼腥草素中氢元素的质量分数最大 D、从折耳根中提取鱼腥草素可用乙醇、乙醚作溶剂6. 下列实际应用中,利用中和反应原理的是( )
检验氢气纯度
4. 物质的性质与用途密切相关,下列物质的性质与用途对应关系正确的是( )A、氦气化学性质稳定,可用于制造多用途电光源 B、活性炭具有吸附性,可用于淡化海水 C、熟石灰、苛性钠和浓硫酸均能吸收水分,可用于干燥二氧化碳 D、干冰升华吸热,可用于人工降雨5. 折耳根是川渝人民喜好的菜肴,其内含有鱼腥草素。鱼腥草素不溶于水,溶于乙醇、乙醚等溶剂,有清热解毒、利尿通淋等作用。下列说法错误的是( )A、鱼腥草素由碳、氢、氧三种元素组成 B、个鱼腥草素分子中含有个原子 C、鱼腥草素中氢元素的质量分数最大 D、从折耳根中提取鱼腥草素可用乙醇、乙醚作溶剂6. 下列实际应用中,利用中和反应原理的是( )①用石灰石处理实验室的废盐酸 ②用碳酸水改良碱性土壤 ③用熟石灰和硫酸铜配制波尔多液 ④用氢氧化钠溶液处理泄漏的浓硫酸
A、①② B、③④ C、①④ D、②④7. 下表是一些食物的pH,胃酸过多的病人空腹时最宜食用的是( )物质
柠檬
苹果
牛奶
玉米粥
pH
2.1~2.8
2.6~3.7
6.3~6.6
7.1~8.0
A、柠檬 B、苹果 C、牛奶 D、玉米粥8. 食品安全与人体健康密切相关,下列做法不会损害人体健康的是( )A、用氧化钙作人体补钙剂 B、用氢氧化钠溶液中和胃酸过多 C、用含小苏打的发酵粉焙制糕点 D、用亚硝酸钠代替食盐加到腊肉香肠中9. 下列化学方程式符合题意且书写正确的是( )A、工业上用高温煅烧石灰石的方法制生石灰:CaCO3 CaO+CO2 B、正常雨水的pH小于7的原因:CO2 +H2O=H2CO3 C、医疗上用氢氧化镁中和过多胃酸: Mg(OH)2+HCl=MgCl2+H2O D、证明铁是金属活动性顺序表中氢之前的金属:2Fe+6HCl=2FeCl3+3H2↑10. “中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是: ,下列说法错误的是( )A、反应中C发生氧化反应 B、该反应为置换反应 C、该不锈钢合金的硬度小于纯铁 D、该不锈钢中还含有铁和碳11. 构建元素化合价和物质类别的二维图是学习化学的一种重要方法。下图是碳元素的“价类二维图”,下列说法错误的是( ) A、B和D的反应为放热反应 B、A可能是最简单的有机物 C、B、C都具有还原性 D、E、F都可一步转化为D12. 化学是一门以实验为基础的科学,下列实验操作、现象及对应的结论正确的是( )
A、B和D的反应为放热反应 B、A可能是最简单的有机物 C、B、C都具有还原性 D、E、F都可一步转化为D12. 化学是一门以实验为基础的科学,下列实验操作、现象及对应的结论正确的是( )选项
A
B
C
D
实验操作




实验现象
烧杯中溶液的pH值减小
甲中木条无明显变化,乙中木条熄灭
气球变鼓
天平指针不发生偏转
实验结论
氢氧化钠和盐酸发生了中和反应
呼出气体中二氧化碳含量更高
氢氧化钠能与二氧化碳发生反应
化学反应遵守质量守恒定律
A、A B、B C、C D、D13. 钪(Sc)是一种“工业的维生素”。图为钪在元素周期表中的相关信息及其原子的结构示意图。下列说法正确的是( ) A、钪元素在周期表中位于第四周期 B、钪的相对原子质量是21 C、原子结构示意图中x=10 D、钪属于非金属元素14. 如图两圆相交部分是物质相互反应,下列对反应现象的叙述,错误的是( )
A、钪元素在周期表中位于第四周期 B、钪的相对原子质量是21 C、原子结构示意图中x=10 D、钪属于非金属元素14. 如图两圆相交部分是物质相互反应,下列对反应现象的叙述,错误的是( ) A、a处形成浅绿色溶液 B、b处无明显现象 C、c处产生蓝色沉淀 D、d处溶液呈红色15. 实验是学习化学的重要手段。下列实验方法不能达到实验目的的是( )
A、a处形成浅绿色溶液 B、b处无明显现象 C、c处产生蓝色沉淀 D、d处溶液呈红色15. 实验是学习化学的重要手段。下列实验方法不能达到实验目的的是( )方案
实验目的
实验方法
A
鉴别NaOH固体和NH4NO3固体
加水溶解,比较温度
B
鉴别稀盐酸和稀硫酸
分别加入BaCl2溶液,观察现象
C
除去CO2中的HCl
通入NaOH溶液中
D
除去FeCl2溶液中CuCl2
加入过量的铁粉,过滤
A、A B、B C、C D、D16. 下列图像分别与选项中的操作相对应,其中合理的是( )A、 向一定质量二氧化锰固体中加一定质量过氧化氢溶液
B、
向一定质量二氧化锰固体中加一定质量过氧化氢溶液
B、 少量氧化钙放入过量饱和石灰水中并恢复至原温
C、
少量氧化钙放入过量饱和石灰水中并恢复至原温
C、 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉至过量
D、
向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉至过量
D、 向一定量的稀盐酸中加入氢氧化钠溶液
向一定量的稀盐酸中加入氢氧化钠溶液
二、填空题(本大题包括5个小题,共21分)
-
17. 在H、O、C、Na、Cl、Ca六种元素中,选择元素组成物质,用化学式填空:(1)、用于金属表面除锈的酸;(2)、改良酸性土壤的碱;(3)、作干燥剂的氧化物;(4)、相对分子质量最小的氧化物 .18. 我国承诺:2030年“碳达峰”,2060年“碳中和”,即通过各种方式抵消排放二氧化碳的量,重新实现碳平衡。(1)、碳封存:二氧化碳可被压缩成液态封存在地质结构中,从微观角度解释二氧化碳被压缩成液态后,分子间间隔变(填“大”或“小”)。(2)、碳转化:一定条件下,可将二氧化碳和氢气在催化剂表面转化为清洁的液体燃料甲醇(化学式为CH3OH)和水,消耗440t的二氧化碳可转化成t甲醇。(3)、碳捕捉:科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环的过程如下图所示。

①为确定步骤2中碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量(填溶液名称),若观察到试管内有气泡产生,则分解不完全。
②上述设想的优点有(填序号)。
a.原料易得且可循环使用 b.充分利用太阳能 c.可全地域全天候使用
19. 甲、乙两种物质的溶解度曲线如图所示。请回答下列问题: (1)、t2℃时,将100g水加入盛有40g甲物质的烧杯中,充分溶解后,得到甲的(填“饱和”或“不饱和”)溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,甲溶液的溶质的质量分数(填“变大”、“不变”或“变小”)。(2)、t2℃时,将甲和乙的饱和溶液降到t1℃,析出晶体的质量关系正确的是____(填序号);A、甲>乙 B、甲=乙 C、甲<乙 D、不能确定(3)、现有t1℃时甲的饱和溶液m1g和乙的饱和溶液m2g,下列关系一定成立的是(填序号)。
(1)、t2℃时,将100g水加入盛有40g甲物质的烧杯中,充分溶解后,得到甲的(填“饱和”或“不饱和”)溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,甲溶液的溶质的质量分数(填“变大”、“不变”或“变小”)。(2)、t2℃时,将甲和乙的饱和溶液降到t1℃,析出晶体的质量关系正确的是____(填序号);A、甲>乙 B、甲=乙 C、甲<乙 D、不能确定(3)、现有t1℃时甲的饱和溶液m1g和乙的饱和溶液m2g,下列关系一定成立的是(填序号)。A两溶液中溶质的质量分数相等
B分别升温至t2℃,所得溶液中溶质的质量分数相等(不考虑水的挥发)
C保持t1℃不变,分别加入等质量的水,所得溶液中溶质的质量分数相等
20. 金属材料在生产生活中有广泛的用途。(1)、古代典籍中“银针验毒”反应原理之一是: , X化学式为。(2)、三星堆遗址新出土重要文物500多件,有高2.62米的青铜大立人。高3.95米的青铜神树、金面具及玉石器和象牙等,青铜属于(填“金属”或“复合”)材料。(3)、如图,用W型玻璃管进行模拟工业炼铁的实验,下列说法正确的是____(填字母)。 A、要先加热玻璃管,再通一氧化碳 B、a处黑色粉末变为红色 C、a处发生的是置换反应 D、尾气可用燃着的酒精灯将其点燃或用气球收集起来(4)、向Cu(NO3)2、AgNO3的混合溶液中加入一定量的Zn粉,充分反应后过滤,得到无色滤液和滤渣。下列说法不正确的是____(填序号)。A、滤渣中一定有Zn、Cu、Ag B、反应后溶液质量一定增大 C、取少量滤液,加入足量的稀盐酸,不会产生白色沉淀21. 中国芯彰显中国“智”造。芯片的基材主要是高纯硅,下图是用粗硅原料(含氧化镁等杂质,不考虑其他杂质与酸反应)制备高纯硅的一种简易流程。
A、要先加热玻璃管,再通一氧化碳 B、a处黑色粉末变为红色 C、a处发生的是置换反应 D、尾气可用燃着的酒精灯将其点燃或用气球收集起来(4)、向Cu(NO3)2、AgNO3的混合溶液中加入一定量的Zn粉,充分反应后过滤,得到无色滤液和滤渣。下列说法不正确的是____(填序号)。A、滤渣中一定有Zn、Cu、Ag B、反应后溶液质量一定增大 C、取少量滤液,加入足量的稀盐酸,不会产生白色沉淀21. 中国芯彰显中国“智”造。芯片的基材主要是高纯硅,下图是用粗硅原料(含氧化镁等杂质,不考虑其他杂质与酸反应)制备高纯硅的一种简易流程。 (1)、操作m的名称是。(2)、为加快粗硅与稀盐酸反应的速率,可采取的措施是(写一条即可)。(3)、操作m后,所得溶液中含有的阳离子为(填离子符号)。(4)、上述流程中,可以循环利用的物质是(填化学式)。(5)、SiCl4与H2反应的化学方程式是。
(1)、操作m的名称是。(2)、为加快粗硅与稀盐酸反应的速率,可采取的措施是(写一条即可)。(3)、操作m后,所得溶液中含有的阳离子为(填离子符号)。(4)、上述流程中,可以循环利用的物质是(填化学式)。(5)、SiCl4与H2反应的化学方程式是。三、实验题(本大题共2小题,共11分)
-
22. 请根据所学知识回答下列问题:



实验一:电解水实验
实验二:气体制备
实验三:粗盐提纯
(1)、实验一中,试管甲中电极与电源的(填“正”或“负”)极相连。(2)、若用实验二中的装置制取并收集氧气,其中仪器A的名称是:;写出A中发生反应的化学方程式。(3)、实验三中,先称取5.0g粗盐,将粗盐逐渐加入盛有10mL水的烧杯中,边加边搅拌,一直加到粗盐不再溶解,称量剩余粗盐质量为1.0g。经过滤和蒸发后得到精盐3.0g。①精盐的产率为。
②上述粗盐提纯实验中,若精盐产率偏大可能的原因是(填字母)。
A.溶解时量取水仰视读数
B.过滤时滤纸破损
C.蒸发结晶时水分未蒸干
23. 我国制碱工业先驱侯德榜发明了“侯氏制碱法”,为纯碱和氮肥工业技术的发展作出了杰出的贡献。纯碱的用途非常广泛,某化学兴趣小组的同学对它产生了浓厚的兴趣,设计了如下两个实验,并对反应后试管中残留废液进行探究。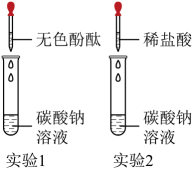
已知:硫酸钠溶液呈中性
(1)、【实验1】往盛有碳酸钠溶液的试管中滴加无色酚酞溶液、观察到溶液变成色。(2)、【实验2】往盛有碳酸钠溶液的试管中滴加稀盐酸,发生反应的化学方程式为;同学们对实验2的废液中溶质成分进行探究。(3)、【提出问题】废液中所含溶质是什么?【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl;
猜想二:废液中的溶质可能是NaCl、Na2CO3;
猜想三:废液中的溶质可能是。
(4)、【设计实验】同学们为验证猜想,设计了如下实验:方案一:
实验操作与现象
化学方程式
实验结论
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生
猜想二正确
(5)、方案二:小明取少量废液于试管中,并向试管中加入下列物质,能够验证猜想一正确的药品是____(填字母序号);A、镁条 B、氢氧化铜 C、硝酸银溶液 D、碳酸钠溶液(6)、【进行讨论】某同学在做实验2时,将稀硫酸当成稀盐酸进行实验,以下证明碳酸钠过量的操作及实验现象的叙述错误的是____(填字母序号)。A、加入紫色石蕊溶液后,溶液呈蓝色 B、继续加入稀硫酸,产生气泡 C、将pH试纸放入反应后的溶液中,测得pH为10 D、加入过量硝酸钡溶液产生白色沉淀,再加入过量稀硝酸产生气泡,固体部分溶解四、计算题(本大题包括1个小题,共6分)
-
24. 氯酸钾不仅可用于实验室制取氧气,还可用于摄影药剂、火箭、导弹推进剂等。实验室制备氯酸钾的原理为: 。若将Cl2通入一定量的KOH溶液恰好完全反应,反应后加入57.4g水,得到溶质质量分数为4.9%的KClO3溶液500g。试计算。(1)、氯酸钾中钾元素与氧元素的质量比为(填最简整数比)。(2)、将所得500g质量分数为4.9%的氯酸钾溶液通过蒸发溶剂的方法浓缩为浓度为24.5%的溶液,需要蒸发水的质量为g(蒸发过程中所有溶质均未达到饱和)。(3)、所用KOH溶液中溶质的质量分数是多少?(通过化学方程式进行计算,写出计算过程,结果保0.1%)。