广东省2024年高考化学模拟试卷(一)
试卷更新日期:2024-05-01 类型:高考模拟
一、选择题
-
1. 中华文化源远流长。下列文物主要由金属材料制成的是( )
文物




选项
A.西周五祀卫鼎
B.唐三彩陶罐
C.东周漆木尊
D.汉代玉璧
A、A B、B C、C D、D2. 岭南文化包罗万象,新旧文化相互交融。下列有关岭南文化的说法不正确的是( )A、“戏剧文化”:现代粤剧舞台上灯光光柱的形成是因为丁达尔现象 B、“节日文化”:深圳新年烟花秀中绚烂的颜色来自焰色试验 C、“茶艺文化”:沏泡工夫茶利用了萃取原理,水作萃取剂 D、“粤菜文化”:制作正宗盐焗鸡所用的粗盐由海水晒制而成,涉及复杂的化学变化3. 科技是第一生产力,近年我国科学家在诸多领域做出了卓越成就。下列说法正确的是( )。A、核地研院发现月壤中“嫦娥石”富含稀有元素钇,和互为同素异形体 B、“天舟四号”配置砷化镓太阳能电池,其能量转化形式为太阳能转化为电能 C、中科院化学所研制纳米四氧化三铁晶体材料,该晶体为金属晶体 D、杭州亚运会主火炬塔使用废碳再生的“绿色零碳甲醇”燃料,该燃料不含碳元素4. 反应是我国科学家发明的低压高效电催化还原的新方法。下列有关说法正确的是( )A、氯离子的结构示意图为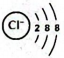 B、NaClO的电子式为
B、NaClO的电子式为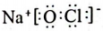 C、CO是非极性分子
D、的结构式为
C、CO是非极性分子
D、的结构式为 5. 下列有关氨气的制备、干燥、收集以及尾气处理操作和装置正确的是( )
5. 下列有关氨气的制备、干燥、收集以及尾气处理操作和装置正确的是( )
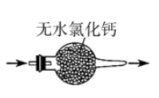


A.制备
B.干燥
C.收集
D.尾气处理
A、A B、B C、C D、D6. 下列猜想对应的实验方案以及验证猜想成立的现象均正确的是( )选项
猜想
实验方案
验证猜想成立的现象
A
苯酚能与溶液反应
向苯酚浊液中加入适量固体
苯酚浊液变澄清
B
某溶液中一定含有
取少量该溶液,先滴加少量溶液,再滴加足量稀盐酸
产生白色沉淀且沉淀不溶于稀盐酸
C
加热条件下能与反应
将灼热的铜丝插入无水乙醇中
铜丝由红色变成黑色
D
浓具有漂白性
向滴有酚酞的NaOH溶液中加入浓
溶液红色褪去
A、A B、B C、C D、D7. 只利用下列实验药品,不能达到实验目的的是( )实验目的
实验药品
A
探究温度对化学平衡的影响
与混合气体、冷水、热水
B
验证乙醇的消去产物是乙烯
乙醇、酸性高锰酸钾溶液、浓硫酸
C
证明牺牲阳极法保护铁
、、酸化的食盐水、溶液
D
比较水和四氯化碳分子的极性
、、
A、A B、B C、C D、D8. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。关于对乙酰氨基酚的说法错误的是 A、含有羟基、酮羰基、氨基三种官能团 B、分子中所有原子不可能共平面 C、1mol该有机物最多能与2mol NaOH发生反应 D、可发生取代反应、氧化反应、加成反应9. 利用浓缩海水,模拟侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和NH4Cl,实验流程如下。
A、含有羟基、酮羰基、氨基三种官能团 B、分子中所有原子不可能共平面 C、1mol该有机物最多能与2mol NaOH发生反应 D、可发生取代反应、氧化反应、加成反应9. 利用浓缩海水,模拟侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和NH4Cl,实验流程如下。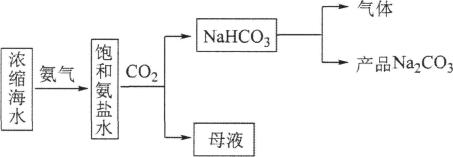
下列说法错误的是( )
A、将饱和氨盐水雾化后与CO2反应可使反应更快更充分 B、制备NaHCO3的化学方程式为NH3 +NaCl+ H2O+CO2=NaHCO3↓+NH4Cl C、流程中“气体”可循环利用 D、将“母液”低温蒸发结晶可得纯净的NH4Cl10. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )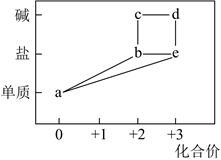
A、 可与 反应生成 B、 既可被氧化,也可被还原 C、可将 加入浓碱液中制得 的胶体 D、可存在 的循环转化关系11. 设为阿伏加德罗常数的值。与性质相似,可作为水产养殖中的供氧剂,一般由悬浊液与溶液反应制得。下列叙述正确的是( )。A、含有极性键 B、含阴阳离子总数为 C、的溶液,的数目为 D、与水反应生成转移电子数目为12. 光催化氧化甲烷制甲醛的机理如图所示。设为阿伏加德罗常数的值。下列说法不正确的是( )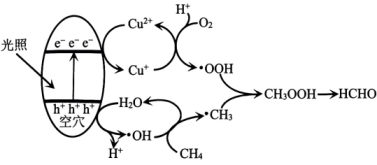 A、在光催化剂表面会发生反应 B、为中间产物 C、上述过程中有非极性键的断裂与生成 D、每生成30gHCHO,总反应转移电子数目为13. 某种镁盐具有良好的电化学性能,其阴离子结构如图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法正确的是( )
A、在光催化剂表面会发生反应 B、为中间产物 C、上述过程中有非极性键的断裂与生成 D、每生成30gHCHO,总反应转移电子数目为13. 某种镁盐具有良好的电化学性能,其阴离子结构如图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法正确的是( ) A、该阴离子中含有配位键 B、第一电离能Z>X>Y C、W与X形成的最简单化合物为极性分子 D、可以通过电解Q氯化物的方法制备Q14. 天然海水中主要含有、、、、、、、等离子。火力发电时燃煤排放的含的烟气可利用海水脱硫,其工艺流程如图所示。下列说法错误的是( )
A、该阴离子中含有配位键 B、第一电离能Z>X>Y C、W与X形成的最简单化合物为极性分子 D、可以通过电解Q氯化物的方法制备Q14. 天然海水中主要含有、、、、、、、等离子。火力发电时燃煤排放的含的烟气可利用海水脱硫,其工艺流程如图所示。下列说法错误的是( ) A、“氧化”时,溶液的pH减小 B、“反应、稀释”时会有气体放出,此气体为 C、天然海水呈弱碱性的原因之一: D、实验中,可用饱和溶液除去中的杂质15. 常温下,用如图所示装置,分别向溶液和溶液中逐滴滴加的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。下列说法正确的是
A、“氧化”时,溶液的pH减小 B、“反应、稀释”时会有气体放出,此气体为 C、天然海水呈弱碱性的原因之一: D、实验中,可用饱和溶液除去中的杂质15. 常温下,用如图所示装置,分别向溶液和溶液中逐滴滴加的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。下列说法正确的是
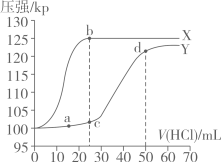 A、X曲线为溶液与盐酸反应的压强变化曲线 B、c点的溶液中: C、用pH试纸测得c点的pH约为8,可知: D、a、d两点水的电离程度:16. 一种利用金属磷化物作为催化剂,将转化成甲酸钠的电化学示意图如下所示,阴极生成和一种气体。下列说法错误的是( )
A、X曲线为溶液与盐酸反应的压强变化曲线 B、c点的溶液中: C、用pH试纸测得c点的pH约为8,可知: D、a、d两点水的电离程度:16. 一种利用金属磷化物作为催化剂,将转化成甲酸钠的电化学示意图如下所示,阴极生成和一种气体。下列说法错误的是( ) A、a为电源负极 B、由左侧室向右侧室移动 C、阴极的电极反应式为 D、理论上,当电路中转移时,阴极室质量增加
A、a为电源负极 B、由左侧室向右侧室移动 C、阴极的电极反应式为 D、理论上,当电路中转移时,阴极室质量增加二、非选择题
-
17. 氯酸钾为无色或白色晶体,是一种强氧化剂。某化学小组制取氯酸钾并进行有关探究实验。(1)、I.制取氯酸钾
利用如下左图所示的实验装置进行实验。回答下列问题:
装置A中盛装浓盐酸的仪器名称是。
 (2)、装置A中发生反应的离子方程式为。(3)、氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为(填化学式)。已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置B所得溶液中提取氯酸钾晶体的实验操作是蒸发浓缩、、洗涤、干燥。(4)、在不同条件下KClO3可将KI氧化为I2或KIO3。室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
(2)、装置A中发生反应的离子方程式为。(3)、氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为(填化学式)。已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置B所得溶液中提取氯酸钾晶体的实验操作是蒸发浓缩、、洗涤、干燥。(4)、在不同条件下KClO3可将KI氧化为I2或KIO3。室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:试管编号
1
2
3
4
0.20mol·L-1KI/mL
1.0
1.0
1.0
1.0
KClO3(s)/g
0.10
0.10
0.10
0.10
6.0mol·L-1H2SO4/mL
0
3.0
x
9.0
蒸馏水/mL
9.0
6.0
5.0
0
取少量反应后溶液滴加淀粉溶液
无现象
变蓝
变蓝
无现象
①3号试管实验中x的值为;1号试管实验的作用是。
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为。
③由该系列实验可得出的结论是。
18. 及其水合物在建筑、工业农业、医药中有着广泛应用。一种以铁菱镁矿(主要成分是 , 还含有、及少量)为原料制备的工艺流程如图所示: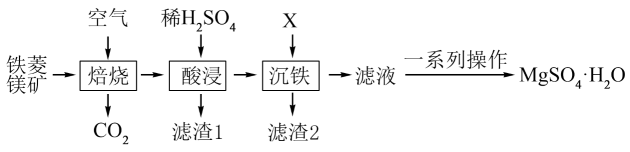
回答下列问题:
(1)、“焙烧”时通常要将矿石粉碎,目的是。写出该过程中发生氧化还原反应的化学方程式。(2)、“滤渣1”的主要成分是。(3)、从物质分离提纯的角度考虑,“沉铁”时“X”应选用下列物质中的____(填字母)。A、氨水 B、NaOH溶液 C、MgO D、(4)、25℃时,为保证“沉铁”充分,至少要将溶液的pH调节到(已知:①25℃, , ;②一般认为,离子浓度小于时该离子即沉降完全)。检验“沉铁”充分的实验方法是。(5)、根据的溶解度随温度变化的情况(如图所示),由“滤液”获得的“一系列操作”是将温度控制在67.5℃以上,蒸发结晶、、、干燥。 (6)、除外,人们发现也有着广泛应用。
(6)、除外,人们发现也有着广泛应用。①可看作是中的一个O原子被S原子取代的产物,的空间结构是。
②的晶胞是与构成的长方体,在晶胞中的位置如图所示。已知晶胞的体积为V , 阿伏加德罗常数的值为 , 晶体的摩尔体积(列出计算式)。
 19. 甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。已知涉及
19. 甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。已知涉及 反应如下:
反应如下:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
积碳反应(的歧化和的裂解反应是催化剂积碳的主要成因,可导致催化活性降低),反应如下:
反应Ⅳ:
反应Ⅴ:。回答下列问题:
(1)、。(2)、在360℃时,在固定容积的容器中进行上述反应(不考虑积碳反应),平衡时和的转化率及和的产率随变化的情况如图1所示。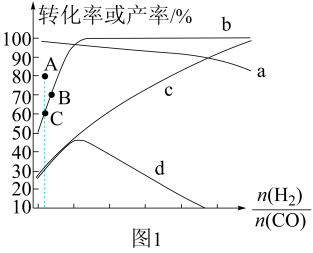
①图中表示转化率、产率变化的曲线分别是、(填标号),A、C两点的值相同,C点通过改变温度达到A点,则A、C两点温度大小为。
②按向恒容容器内投料,初始压强为 , 若仅发生Ⅰ、Ⅱ两个反应,达到平衡时总压为 , 的平衡转化率为a,反应Ⅰ的(用分压表示,分压=总压×物质的量分数)。
(3)、已知各反应的平衡常数随温度的变化曲线如图2所示,相同时间内甲烷产率随温度升高的变化曲线如图3。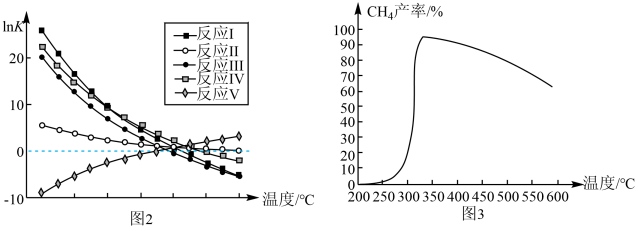
由图2可知,的歧化反应属于(填“吸热”或“放热”)反应,相同时间内的产率在温度高于330℃时降低的可能原因之一是催化剂活性降低,高温导致催化剂活性降低的原因是。
20. F是合成吡啶类农药的重要中间体,其主要合成路线如下: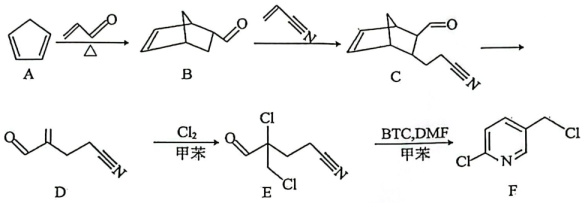 (1)、B的分子式为 , 其环上的含氧取代基是(写名称)。化合物H是B的同分异构体,分子中含有苯环,核磁共振氢谱上有4组峰,峰面积比为 , 则H的结构简式为(写一种)。(2)、关于B→C的反应,下列说法不正确的是____。A、该反应属于加成反应 B、反应过程中有碳原子由杂化转变为杂化 C、化合物B和C均有3个手性碳原子 D、化合物B易溶于水(3)、根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
(1)、B的分子式为 , 其环上的含氧取代基是(写名称)。化合物H是B的同分异构体,分子中含有苯环,核磁共振氢谱上有4组峰,峰面积比为 , 则H的结构简式为(写一种)。(2)、关于B→C的反应,下列说法不正确的是____。A、该反应属于加成反应 B、反应过程中有碳原子由杂化转变为杂化 C、化合物B和C均有3个手性碳原子 D、化合物B易溶于水(3)、根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
示例
, 酸性
还原反应
a
水解反应
b
氧化反应(生成有机产物)
(4)、参考以上合成路线,以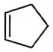 和乙烯为原料设计制备
和乙烯为原料设计制备 的合成路线(无机试剂和有机溶剂任用,有机物用结构简式表示)。
的合成路线(无机试剂和有机溶剂任用,有机物用结构简式表示)。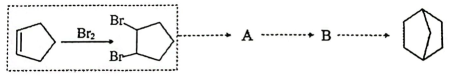
①相关反应涉及到卤代烃的消去反应,其化学方程式为。
②最后一步反应中,有机反应物B为(写结构简式)。