湖北省荆荆宜三校2023年5月高考联考化学试题
试卷更新日期:2024-04-30 类型:高考模拟
一、单选题
-
1. 化学与人类生产、生活密切相关。下列有关物质用途的说法错误的是( )A、三聚氰胺可用作食品添加剂 B、使用聚四氟乙烯活塞的滴定管可以装碱性溶液 C、可以向牙膏中添加Na2PO3F、NaF和SrF2等预防龋齿 D、运输水果的过程中,可以在包装盒内加入浸泡过高锰酸钾溶液的硅藻土2. 下列化学用语表示正确的是( )A、中子数为16的磷原子: B、乙烯的空间填充模型
 C、氧原子核外电子轨道表示式:
C、氧原子核外电子轨道表示式: D、乙醇的键线式:
D、乙醇的键线式: 3. 奥司他韦是目前治疗甲流的常用药物之一,其结构如图所示。下列有关该物质的说法错误的是( )
3. 奥司他韦是目前治疗甲流的常用药物之一,其结构如图所示。下列有关该物质的说法错误的是( ) A、该物质具有碱性 B、该物质在碱性条件下的水解产物有2种 C、该物质能使酸性高锰酸钾、溶液褪色 D、该物质可形成分子内氢键和分子间氢键4. 茶多酚是茶叶中多酚类物质的总称,具有抗癌、抗衰老等功能。茶叶的手工制作过程非常复杂:“采回的鲜茶叶,要及时、均匀地薄摊在洁净的竹匾上……要用火力均匀的木炭火在锅内手工翻炒、烘焙……”。下列有关说法正确的是( )A、“翻炒”时,木炭火的温度越高越好 B、用开水刚泡制的茶水pH=7 C、瓷器茶杯属于新型的无机非金属材料 D、茶多酚能有效清除人体的活性氧自由基,起到抗衰老作用5. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、9g羟基所含电子数目为10NA B、pH=13的NaOH溶液中含有的Na+数目为NA C、在含4molSi-O键的SiO2晶体中,氧原子数目为2NA D、0.5molNF3中孤电子对的数目为0.5NA6. 金属M在潮湿的空气中会形成一层致密稳定的3M(XY)2•MZX3。X、Y、Z为短周期主族元素,X的原子序数是Y的8倍,基态X和Z的未成对电子数相同,M是人体的必需微量元素之一。1molMZX3含有60mol质子。下列说法正确的是( )A、3M(XY)2•MZX3中Z原子采用sp3杂化 B、同周期元素中第一电离能比X大的有3种 C、基态M原子核外电子排布式为[Ar]4s2 D、氢化物的沸点:X>Z7. 一种用氢气制备双氧水的反应原理如图所示,已知钯(Pd)常以正二价形式存在。下列有关说法正确的是( )
A、该物质具有碱性 B、该物质在碱性条件下的水解产物有2种 C、该物质能使酸性高锰酸钾、溶液褪色 D、该物质可形成分子内氢键和分子间氢键4. 茶多酚是茶叶中多酚类物质的总称,具有抗癌、抗衰老等功能。茶叶的手工制作过程非常复杂:“采回的鲜茶叶,要及时、均匀地薄摊在洁净的竹匾上……要用火力均匀的木炭火在锅内手工翻炒、烘焙……”。下列有关说法正确的是( )A、“翻炒”时,木炭火的温度越高越好 B、用开水刚泡制的茶水pH=7 C、瓷器茶杯属于新型的无机非金属材料 D、茶多酚能有效清除人体的活性氧自由基,起到抗衰老作用5. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、9g羟基所含电子数目为10NA B、pH=13的NaOH溶液中含有的Na+数目为NA C、在含4molSi-O键的SiO2晶体中,氧原子数目为2NA D、0.5molNF3中孤电子对的数目为0.5NA6. 金属M在潮湿的空气中会形成一层致密稳定的3M(XY)2•MZX3。X、Y、Z为短周期主族元素,X的原子序数是Y的8倍,基态X和Z的未成对电子数相同,M是人体的必需微量元素之一。1molMZX3含有60mol质子。下列说法正确的是( )A、3M(XY)2•MZX3中Z原子采用sp3杂化 B、同周期元素中第一电离能比X大的有3种 C、基态M原子核外电子排布式为[Ar]4s2 D、氢化物的沸点:X>Z7. 一种用氢气制备双氧水的反应原理如图所示,已知钯(Pd)常以正二价形式存在。下列有关说法正确的是( ) A、H2、O2和H2O2都是非极性分子 B、反应①②③均为氧化还原反应 C、反应②中每产生1mol[PbCl2O2]2- , 转移2mol电子 D、[PbCl4]2-和HCl均为该反应的催化剂8. 对下列劳动项目的解释错误的是( )
A、H2、O2和H2O2都是非极性分子 B、反应①②③均为氧化还原反应 C、反应②中每产生1mol[PbCl2O2]2- , 转移2mol电子 D、[PbCl4]2-和HCl均为该反应的催化剂8. 对下列劳动项目的解释错误的是( )选项
劳动项目
解释
A
用SO2漂白纸浆
SO2具有还原性
B
用铝制容器贮运浓硝酸
铝遇浓硝酸钝化
C
模具注入熔融钢水之前必须干燥
铁与H2O在高温下会反应
D
用固体管道疏通剂(主要成分为NaOH和铝粉)疏通管道
与铝粉和NaOH溶液反应产生气体有关
A、A B、B C、C D、D9. 氟锑酸(HSbF6)是石油重整中常用的催化剂,酸性比纯硫酸要强2×1019倍,被称为超强酸。实验室可通过SbCl5+6HF=HSbF6+5HCl制得,且HSbF6在HF中容易生成[H2F]+[SbF6]-。下列说法错误的是( )A、HF的电子式为 B、[H2F]+的空间结构为V形
C、基态氯原子核外电子的运动状态有9种
D、基态Sb和F原子中电子占据能量最高的轨道形状相同
10. 用下列实验装置进行相应实验,其中不能达到实验目的的是( )
B、[H2F]+的空间结构为V形
C、基态氯原子核外电子的运动状态有9种
D、基态Sb和F原子中电子占据能量最高的轨道形状相同
10. 用下列实验装置进行相应实验,其中不能达到实验目的的是( )



A.乙醇脱水制乙烯
B.分离碘单质和NaCl
C.验证稀硝酸的还原产物为NO
D.制取少量Cl2
A、A B、B C、C D、D11. 利用硫钨矿(主要成分是CaWO4 , 还含有FeS、SiO2等)制取Na2WO4和单质硅的工艺生产流程如图。已知:常温下,Ksp(CaWO4)=1.0×10-8 , Ksp(CaCO3)=1.0×10-9。
下列说法正确的是( )
A、焙烧时发生反应的方程式为4FeS+7O22Fe2O3+4SO2 B、滤渣的主要成分是Si和CaCO3 C、“溶浸”时,可以用烧碱溶液代替纯碱溶液 D、若滤渣中含有CaWO4 , 则滤液中c()=10c()12. 某笼形络合物Ni(CN)x(NH3)y(C6H6)z结构中,金属离子与CN-连接形成平面层,两个平面层通过NH3分子连接,中间的空隙填充大小合适的分子(如C6H6),其基本结构如图(H原子未画出)。下列说法正确的是( ) A、该结构是晶胞结构单元 B、x:y:z=2:1:1 C、金属离子的配位数都是4 D、该笼形络合物A的晶胞密度为g/cm313. 下列实验操作和现象均正确,且能推出相应结论的是( )
A、该结构是晶胞结构单元 B、x:y:z=2:1:1 C、金属离子的配位数都是4 D、该笼形络合物A的晶胞密度为g/cm313. 下列实验操作和现象均正确,且能推出相应结论的是( )选项
实验操作
现象
结论
A
向甲苯中加入溴水,充分振荡
溴水褪色
甲苯能与溴水反应
B
常温下,将Mg、Al与NaOH溶液组成原电池
电流计指针偏转,Mg电极上有气泡产生
Al金属活动性强于Mg
C
石蜡油加强热,将产生的气体通入Br2的CCl4溶液
溶液由橙红色变为无色
气体中含有不饱和烃
D
室温下,用pH计测得同浓度Na2SO3、NaHSO3溶液的pH
Na2SO3溶液的pH大于NaHSO3溶液的pH
结合H+的能力比的强
A、A B、B C、C D、D14. 我国某科研团队设计了一种新型能量存储/转化装置(如图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。已知Zn(OH)2与Al(OH)3的性质相似。下列说法正确的是( ) A、制氢时,太阳能直接转化为化学能 B、制氢时,每产生1molH2 , X电极的质量增加2g C、供电时,Zn电极发生的反应为Zn-2e-+2OH-=Zn(OH)2 D、供电时,电子流向为:Zn电极→用电器→X电极15. 室温下,向Na2CO3和NaHCO3的混合溶液中逐滴加入少量BaCl2溶液,溶液中lgc(Ba2+)与lg的变化关系如图所示。已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11;Ksp(BaCO3)=2.6×10-9。下列说法错误的是( )
A、制氢时,太阳能直接转化为化学能 B、制氢时,每产生1molH2 , X电极的质量增加2g C、供电时,Zn电极发生的反应为Zn-2e-+2OH-=Zn(OH)2 D、供电时,电子流向为:Zn电极→用电器→X电极15. 室温下,向Na2CO3和NaHCO3的混合溶液中逐滴加入少量BaCl2溶液,溶液中lgc(Ba2+)与lg的变化关系如图所示。已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11;Ksp(BaCO3)=2.6×10-9。下列说法错误的是( ) A、a对应溶液的c(H+)小于b B、b对应溶液的c()=2.6×10-6mol•L-1 C、向a点溶液中通入CO2可使a点溶液向b点溶液转化 D、a对应的溶液中存在:2c(Ba2+)+c(Na+)>3c()+c(Cl-)
A、a对应溶液的c(H+)小于b B、b对应溶液的c()=2.6×10-6mol•L-1 C、向a点溶液中通入CO2可使a点溶液向b点溶液转化 D、a对应的溶液中存在:2c(Ba2+)+c(Na+)>3c()+c(Cl-)二、实验题
-
16. 碳酸镧La2(CO3)3(Mr=458)可用于治疗高磷酸盐血症。为白色粉末、难溶于水、分解温度900℃。在溶液中制备时,形成水合碳酸镧La2(CO3)3•xH2O,如果溶液碱性太强,易生成受热分解的碱式碳酸镧La(OH)CO3。已知酒精喷灯温度可达1000℃。回答下列问题:(1)、
Ⅰ.某化学兴趣小组利用NH3和CO2通入LaCl3溶液中拟制备La2(CO3)3•xH2O
装置的连接顺序是a→ , ←b(填接口字母)。 (2)、装置乙用到的玻璃仪器(除导气管外)有。(3)、生成水合碳酸镧的化学方程式为。(4)、Ⅱ.碳酸氢钠与氯化镧反应可制取碳酸镧
(2)、装置乙用到的玻璃仪器(除导气管外)有。(3)、生成水合碳酸镧的化学方程式为。(4)、Ⅱ.碳酸氢钠与氯化镧反应可制取碳酸镧①为了高磷血症患者的安全,通常选用NaHCO3溶液而不选用Na2CO3 , 其优点是。
②T℃时,碳酸镧的溶解度可表示为1.0×10-7mol/L,HCO的电离平衡常数为6.0×10-11。请计算反应2LaCl3+3NaHCO3La2(CO3)3↓+3NaCl+3HCl的平衡常数K=。
(5)、Ⅲ.测定La2(CO3)3•xH2O中是否含有La(OH)CO3将装置A称重,记为m1g。将提纯后的样品装入装置A中,再次将装置A称重,记为m2g,将装有试剂的装置C称重,记为m3g。按如图连接好装置进行实验。
实验步骤:①打开K1、K2和K3 , 缓缓通入N2;
②数分钟后关闭 , 打开 , 点燃酒精喷灯,加热A中样品;
③一段时间后,熄灭酒精灯,打开K1 , 通入N2数分钟后,冷却到室温,关闭K1和K2 , 称量装置A。重复上述操作步骤,直至装置A恒重,记为m4g(此时装置A中为La2O3)。称重装置C,记为m5g。
实验步骤②中关闭 , 打开(填写止水夹代号)。(6)、根据实验记录,当= , 说明制得的样品中不含有La(OH)CO3。三、有机推断题
-
17. 有机物
 是重要药物中间体,其合成线路如图所示:
是重要药物中间体,其合成线路如图所示:
回答下列问题:
(1)、I中含有个手性碳原子;Ⅲ中含氧官能团名称为。(2)、反应②的反应类型为;V的结构简式为。(3)、反应⑤的化学方程式为。(4)、由反应④~⑦可推测(Boc)2O的作用为。(5)、同时满足以下条件的Ⅲ的同分异构体有种。①含有苯环,能使FeCl3溶液显色;
②核磁共振氢谱中有6个化学环境相同的氢原子。
写出一种核磁共振氢谱中峰面积之比为6:2:1:1同分异构体的结构简式。
(6)、参照上述信息和所学知识,将下列合成线路补充完整。
四、工业流程题
-
18. 分铜液净化渣主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,一种回收工艺流程如图所示:

已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有Na2TeO3、Na3AsO4。
②“酸浸”时,锑元素反应生成难溶的Sb2O(SO4)4浸渣。
回答下列问题:
(1)、碲(Te)元素位于元素周期表第周期族;SbCl3的VSEPR模型名称为。(2)、“碱浸”时,加快碱浸的措施有(写两种)。(3)、向碱浸液加入盐酸调节pH=4,得到的滤液中As元素最主要的存在形式为____(常温下,H3AsO4的各级电离常数为Ka1=6.3×10-3、Ka2=1.0×10-7、Ka3=3.2×10-12)。A、H3AsO4 B、 C、 D、(4)、“氯盐酸浸”时,SO2的作用。(5)、SbCl3“水解”生成SbOCl的化学方程式为;实验室配制SbCl3溶液的方法是。五、原理综合题
-
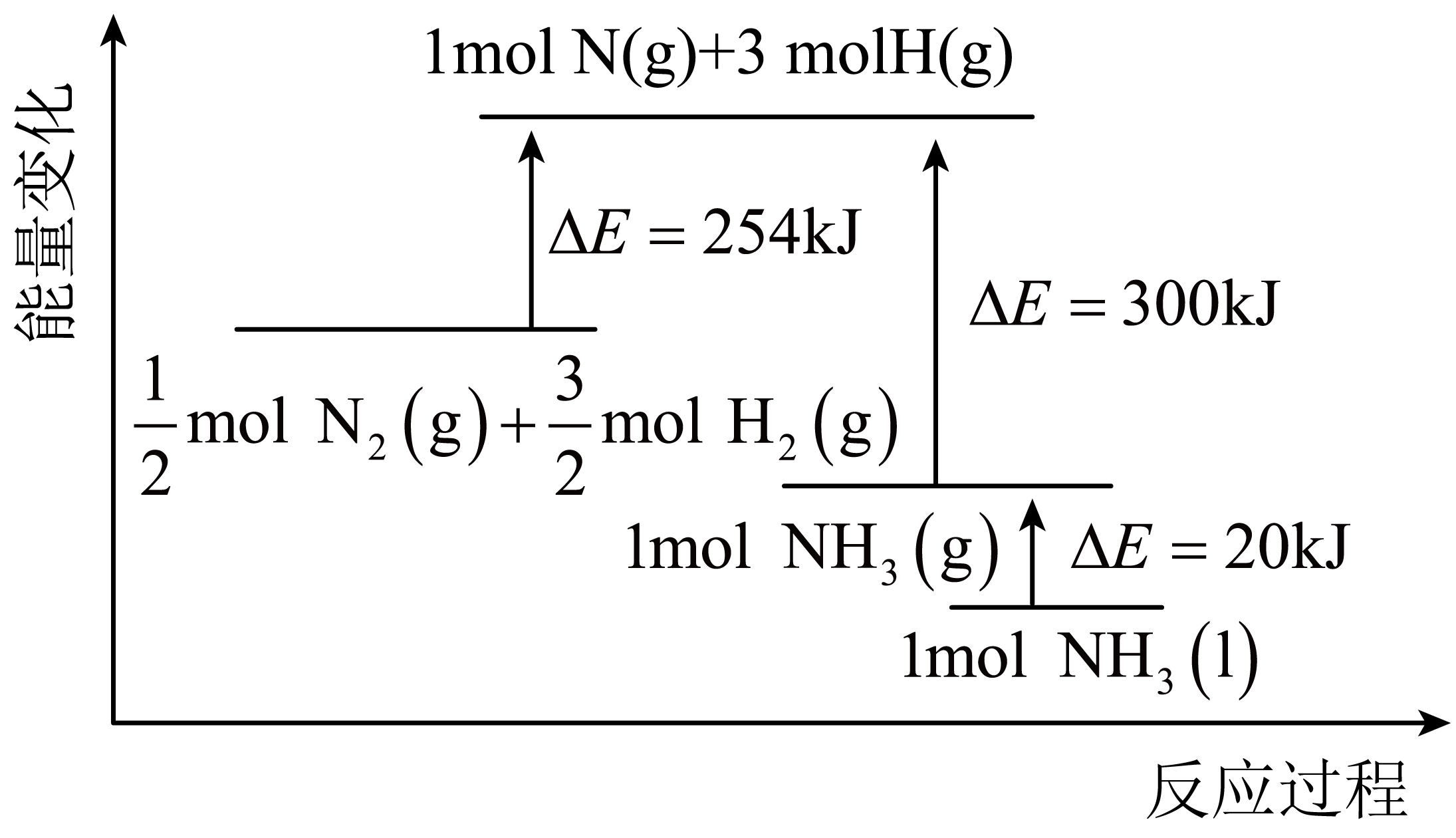
19. 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家。(1)、反应的能量变化如图所示。则N2(g)与H2(g)制备NH3(1)的热化学方程式为。
 (2)、关于合成氨工艺的理解,下列正确的是____。A、合成氨工业常采用的反应温度为400~500℃左右,可用勒夏特列原理解释 B、使用更高效的催化剂,可以提高平衡时NH3的量 C、合成氨工业采用10MPa~30MPa,是因常压下N2和H2的转化率不高 D、用铜氨溶液处理原料气中CO杂质的反应为:[Cu(NH3)2]++CO+NH3[Cu(NH3)3CO]+ ΔH<0,其适宜的生产条件为低温高压(3)、恒压密闭容器中,起始时n(H2):n(N2)=3:1,不同温度(T)下平衡混合物中NH3(g)物质的量分数随压强的变化曲线如图所示:
(2)、关于合成氨工艺的理解,下列正确的是____。A、合成氨工业常采用的反应温度为400~500℃左右,可用勒夏特列原理解释 B、使用更高效的催化剂,可以提高平衡时NH3的量 C、合成氨工业采用10MPa~30MPa,是因常压下N2和H2的转化率不高 D、用铜氨溶液处理原料气中CO杂质的反应为:[Cu(NH3)2]++CO+NH3[Cu(NH3)3CO]+ ΔH<0,其适宜的生产条件为低温高压(3)、恒压密闭容器中,起始时n(H2):n(N2)=3:1,不同温度(T)下平衡混合物中NH3(g)物质的量分数随压强的变化曲线如图所示:
①A点的温度迅速从T1变为T2 , 则此时浓度商QK(T2)(填“>”“<”或“=”)。
②Kp(B):Kp(A)=(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
③合成氨逆反应速率方程为:v(逆)=k(逆) , 式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为。
(4)、电化学法也可合成氨。如图是用低温固体质子导体作为电解质,用Pt−C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
①Pt−C3N4电极反应产生NH3的电极反应式。
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因。
-
-
-