广东省汕头市潮阳第一中学2023-2024学年高一下学期4月期中考试化学试题
试卷更新日期:2024-04-30 类型:期中考试
一、单选题(1-10题每小题2分;11-16题每小题4分)
-
1. 下列选项涉及的过程中能实现化学能直接转化为电能的是( )A、水力发电
 B、太阳能发电
B、太阳能发电  C、微生物燃料发电
C、微生物燃料发电 D、电动汽车充电
D、电动汽车充电 2. 2023年是我国实施新型基础设施建设的重要时期,在包括5G基站建设、城际高速铁路和城市轨道交通等领域都取得瞩目成就,其中涉及各种化学材料。下列相关说法错误的是( )A、中国自主研发的首个5G微基站射频芯片的主要材料是Si B、高铁动车的车厢厢体由不锈钢和铝合金制成,不锈钢和铝合金均属于金属材料 C、国产飞机C919用到的氮化硅陶瓷是新型无机非金属材料 D、歼-20战斗机在长春航展上完美亮相,其机身采用的碳纤维是有机高分子材料3. “十五”时期,碲化镉(Cde)薄膜电池研究被列入国家高技术研究发展计划(863计划)重点项目。碲化镉太阳能电池较单晶硅太阳能电池有制作方便、成本低廉和重量较轻等优点。下列说法错误的是( )A、和的核外电子数之差为2 B、的中子数比质子数多24个 C、和互为同素异形体 D、硅位于元素周期表中金属元素区与非金属元素区的分界线处,常用作半导体材料4. NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4L氨气中含有的共价键数目为3NA B、将含2molH2SO4的浓硫酸与足量的焦炭反应,转移电子数目为4NA C、含1molHNO3的浓硝酸与足量的Cu反应转移电子数为NA D、1L0.1mol/L的氨水中,NH3分子、NH3·H2O分子共0.1NA5. 1827年,英国科学家法拉第进行了喷泉实验。在此启发下,兴趣小组利用以下装置,进行如下实验。其中,难以达到预期目的的是( )
2. 2023年是我国实施新型基础设施建设的重要时期,在包括5G基站建设、城际高速铁路和城市轨道交通等领域都取得瞩目成就,其中涉及各种化学材料。下列相关说法错误的是( )A、中国自主研发的首个5G微基站射频芯片的主要材料是Si B、高铁动车的车厢厢体由不锈钢和铝合金制成,不锈钢和铝合金均属于金属材料 C、国产飞机C919用到的氮化硅陶瓷是新型无机非金属材料 D、歼-20战斗机在长春航展上完美亮相,其机身采用的碳纤维是有机高分子材料3. “十五”时期,碲化镉(Cde)薄膜电池研究被列入国家高技术研究发展计划(863计划)重点项目。碲化镉太阳能电池较单晶硅太阳能电池有制作方便、成本低廉和重量较轻等优点。下列说法错误的是( )A、和的核外电子数之差为2 B、的中子数比质子数多24个 C、和互为同素异形体 D、硅位于元素周期表中金属元素区与非金属元素区的分界线处,常用作半导体材料4. NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4L氨气中含有的共价键数目为3NA B、将含2molH2SO4的浓硫酸与足量的焦炭反应,转移电子数目为4NA C、含1molHNO3的浓硝酸与足量的Cu反应转移电子数为NA D、1L0.1mol/L的氨水中,NH3分子、NH3·H2O分子共0.1NA5. 1827年,英国科学家法拉第进行了喷泉实验。在此启发下,兴趣小组利用以下装置,进行如下实验。其中,难以达到预期目的的是( ) A、图1:喷泉实验 B、图2:干燥 C、图3:收集 D、图4:制备6. 如图所示,托盘天平左、右两盘分别放有规格大小完全相同的锥形瓶,向两个锥形瓶中分别加入相应的试剂,然后塞上带导管的单孔塞并通过导管连通两瓶,调节天平平衡。下列有关说法正确的是( )
A、图1:喷泉实验 B、图2:干燥 C、图3:收集 D、图4:制备6. 如图所示,托盘天平左、右两盘分别放有规格大小完全相同的锥形瓶,向两个锥形瓶中分别加入相应的试剂,然后塞上带导管的单孔塞并通过导管连通两瓶,调节天平平衡。下列有关说法正确的是( ) A、若左瓶试剂为食盐晶体,右瓶试剂为烧碱固体,一段时间后,天平指针会向左偏转 B、若左瓶试剂为浓氨水,右瓶试剂为酚酞溶液,一段时间后,右瓶中的溶液会变红 C、若左瓶试剂为浓氨水,右瓶试剂为浓硫酸,一段时间后,导管中部会产生大量白烟 D、若左瓶试剂为浓硫酸,右瓶试剂为石蕊溶液,一段时间后,右瓶中的溶液会变红7. 往FeCl3和BaCl2的混合溶液中通入SO2 , 溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( )A、该实验表明FeCl3有还原性 B、白色沉淀为BaSO3 C、该实验表明SO2有漂白性 D、反应后溶液酸性增强8. 已知升温、增大浓度、加大压强和使用催化剂均可以提高化学反应的速率。现把镁条投入盛有稀盐酸的试管中,试管外壁用手一摸感到发烫,而且产生氢气的速率变化情况(v)和反应进行的时间(t)的关系如图所示,则下列说法正确的是( )
A、若左瓶试剂为食盐晶体,右瓶试剂为烧碱固体,一段时间后,天平指针会向左偏转 B、若左瓶试剂为浓氨水,右瓶试剂为酚酞溶液,一段时间后,右瓶中的溶液会变红 C、若左瓶试剂为浓氨水,右瓶试剂为浓硫酸,一段时间后,导管中部会产生大量白烟 D、若左瓶试剂为浓硫酸,右瓶试剂为石蕊溶液,一段时间后,右瓶中的溶液会变红7. 往FeCl3和BaCl2的混合溶液中通入SO2 , 溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( )A、该实验表明FeCl3有还原性 B、白色沉淀为BaSO3 C、该实验表明SO2有漂白性 D、反应后溶液酸性增强8. 已知升温、增大浓度、加大压强和使用催化剂均可以提高化学反应的速率。现把镁条投入盛有稀盐酸的试管中,试管外壁用手一摸感到发烫,而且产生氢气的速率变化情况(v)和反应进行的时间(t)的关系如图所示,则下列说法正确的是( ) A、如果使用催化剂,反应结束后会产生更多质量的气体 B、t2时刻的速率大于t1时刻的速率主要原因是反应物的量较多 C、t2~t3速率变化的主要原因是盐酸的浓度逐渐减小 D、t2时恰好完全反应9. 下列实验操作和现象与结论或目的对应错误的是( )
A、如果使用催化剂,反应结束后会产生更多质量的气体 B、t2时刻的速率大于t1时刻的速率主要原因是反应物的量较多 C、t2~t3速率变化的主要原因是盐酸的浓度逐渐减小 D、t2时恰好完全反应9. 下列实验操作和现象与结论或目的对应错误的是( )选项
操作和现象
结论或目的
A
用红色激光笔照射烧杯中的液体,在与光束垂直的方向观察到一条光亮的“通路”
验证液体为胶体
B
将分装在两支试管中,向一支试管中滴加足量盐酸,向另一支试管中滴加足量溶液,边滴边振荡,最终沉淀消失
验证为两性氢氧化物
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
将浓硫酸加入蔗糖中形成多孔炭并有刺激性气味
浓硫酸具有氧化性和脱水性
A、A B、B C、C D、D10. 汽车受到猛烈碰撞时,安全气囊内的固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示。下列说法错误的是( ) A、属于离子化合物 B、的分解反应属于放热反应 C、表示2mol固体的能量 D、作为安全气囊的气体发生剂,具有产气快、产气量大等优点11. 一种麻醉剂的分子结构式如图所示。其中, 的原子核只有1个质子;元素 、 、 原子序数依次增大,且均位于 的下一周期;元素 的原子比 原子多8个电子。下列说法不正确的是( )
A、属于离子化合物 B、的分解反应属于放热反应 C、表示2mol固体的能量 D、作为安全气囊的气体发生剂,具有产气快、产气量大等优点11. 一种麻醉剂的分子结构式如图所示。其中, 的原子核只有1个质子;元素 、 、 原子序数依次增大,且均位于 的下一周期;元素 的原子比 原子多8个电子。下列说法不正确的是( )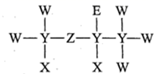 A、 是一种强酸 B、非金属性: C、原子半径: D、 中, 的化合价为+2价12. 若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A、 是一种强酸 B、非金属性: C、原子半径: D、 中, 的化合价为+2价12. 若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( ) A、 与浓硫酸反应,只体现 的酸性 B、a处变红,说明 是酸性氧化物 C、b或c处褪色,均说明 具有漂白性 D、试管底部出现白色固体,说明反应中无 生成13. 部分含氮物质的分类与相应氮元素的化合价关系如图所示。下列说法错误的是( )
A、 与浓硫酸反应,只体现 的酸性 B、a处变红,说明 是酸性氧化物 C、b或c处褪色,均说明 具有漂白性 D、试管底部出现白色固体,说明反应中无 生成13. 部分含氮物质的分类与相应氮元素的化合价关系如图所示。下列说法错误的是( ) A、a可经催化氧化生成b B、b为红棕色,可转化为c C、b、c会造成光化学烟雾,酸雨,污染环境 D、d的溶液与Cu反应可生成b或c14. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )A、 放入水中: B、 通过灼热铁粉: C、铜丝插入热的浓硫酸中: D、 通入酸性 溶液中:15. 2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如图所示:下列说法正确的是( )
A、a可经催化氧化生成b B、b为红棕色,可转化为c C、b、c会造成光化学烟雾,酸雨,污染环境 D、d的溶液与Cu反应可生成b或c14. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )A、 放入水中: B、 通过灼热铁粉: C、铜丝插入热的浓硫酸中: D、 通入酸性 溶液中:15. 2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如图所示:下列说法正确的是( ) A、图中能量转化方式只有2种 B、H+向a极区移动 C、b极发生的电极反应式N2+6H++6e-=2NH3 D、a极上每产生22.4 L O2流过电极的电子数为4NA16. 沸石分子筛选择性催化还原的循环过程如图所示。下列说法正确的是( )
A、图中能量转化方式只有2种 B、H+向a极区移动 C、b极发生的电极反应式N2+6H++6e-=2NH3 D、a极上每产生22.4 L O2流过电极的电子数为4NA16. 沸石分子筛选择性催化还原的循环过程如图所示。下列说法正确的是( ) A、反应过程中催化剂未参与电子得失 B、步骤一中与的物质的量之比为 C、每生成理论上消耗 D、所有步骤均有氧化还原反应发生
A、反应过程中催化剂未参与电子得失 B、步骤一中与的物质的量之比为 C、每生成理论上消耗 D、所有步骤均有氧化还原反应发生二、非选题(本题包含4小题,共56分)
-
17. 某实验小组为验证NO2与水反应的产物与课本方程式中的产物是否一致,设计如下装置进行实验(夹持装置已略去,装置气密性已检验)。

实验步骤如下:
步骤I:打开K1、K3、K5 , 关闭K2、K4 , 通入一段时间N2 , 关闭K1﹔
步骤II:打开K2 , 加入足量浓硝酸,同时打开pH传感器和c(NO)传感器,记录数据如下:[pH越小表示c(H+)越大]

步骤III:5min后,打开K4 , 用注射器将少量空气注入三颈烧瓶,关闭K4。
回答下列问题:
(1)、仪器a的名称为。(2)、“步骤I”中“通入一段时间N2”的目的是。(3)、“步骤II”中“打开K2 , 加入足量浓硝酸”时,可观察到:圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,同时烧瓶上方有红棕色气体产生,化学方程式为;片刻后,三颈烧瓶内的导管口有气泡冒出。(4)、“步骤III”中“用注射器将少量空气注入三颈烧瓶”的目的是检验(填化学式)。(5)、根据“步骤II”的数据采集和“步骤III”的实验现象,得到NO2与水反应的离子方程式为。
(6)、有同学认为该实验不严谨,传感器所记录的数据结果也可能是因为造成的。18. 绿矾(FeSO4⋅7H2O))是一种重要的药物,也是一种工业原料。一种以黄铜矿(主要成分是CuFeS2 , 含SiO2、Al2O3等杂质)为原料制备绿矾的流程如图:
回答下列问题:
(1)、“焙烧”时,需将黄铜矿粉碎,其目的是;高温“焙烧”过程中生成了三种氧化物,其化学方程式是。(2)、滤渣1的主要成分为(填化学式,下同);滤渣2的主要成分为。(3)、“一系列操作”为:、、过滤、洗涤、干燥。(4)、硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为。(5)、绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中。19. Ⅰ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):化学键
H—H
Cl—Cl
O=O
C—Cl
C—H
O—H
H—Cl
E/(kJ·mol-1)
436
247
x
330
413
463
431

请回答下列问题:
(1)、如图表示某反应的能量变化关系,则此反应(填“吸收”或“放出”) kJ能量(用含有a、b的关系式表示)。(2)、反应H2(g)+O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=。(3)、历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为。(4)、Ⅱ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):实验序号
A溶液
B溶液
①
20mL 0.1mol·L-1H2C2O4溶液
30mL 0.1 mol·L-1KMnO4溶液
②
20mL 0.2mol·L-1H2C2O4溶液
30mL 0.1mol·L-1KMnO4溶液
该实验探究的是因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是(填实验序号)。
 (5)、若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min内,v(MnO4-)= (假设混合液体积为50mL)。(6)、除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定来比较化学反应速率。(7)、小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②。20. 任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、电能等不同形式的能量。(1)、H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN—H会放出能量391kJ,则在反应N2+3H22NH3中,每生成2molNH3(填“吸收”或“放出”)热量kJ。(2)、Mg、Al设计成如图所示原电池装置:
(5)、若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min内,v(MnO4-)= (假设混合液体积为50mL)。(6)、除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定来比较化学反应速率。(7)、小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②。20. 任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、电能等不同形式的能量。(1)、H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN—H会放出能量391kJ,则在反应N2+3H22NH3中,每生成2molNH3(填“吸收”或“放出”)热量kJ。(2)、Mg、Al设计成如图所示原电池装置:①若溶液为硫酸溶液,Mg为极,正极电极反应式为 ;
②若溶液为氢氧化钠溶液,负极的电极反应为。
 (3)、电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。
(3)、电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。
①石墨1为(填“正极”或“负极”);
②正极的电极反应式为。
③若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为。