广东省湛江市雷州市雷州八中,雷州二中,雷州三中2023-2024学年高二下学期4月期中考试化学试卷
试卷更新日期:2024-04-30 类型:期中考试
一、选择题:本题共16个小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 下列有关晶体的说法正确的是( )A、任何晶体中,若含有阳离子就一定有阴离子 B、离子晶体中只含有离子键 C、分子晶体的熔沸点较高 D、共价晶体中只含有共价键2. 下列各组多电子原子的原子轨道能量高低比较中,错误的是( )A、2s<2p B、3px<3py C、3s<3d D、4s<4p3. 工业合成氨是人类科学技术的一项重大突破,其反应为N2(g)+3H2 (g)⇌2NH3(g) , 下列说法错误的是( )A、常温下,难溶于水 B、在氧气中燃烧的能量变化形式与该反应的能量变化形式相符 C、该反应中反应物的键能总和大于生成物的键能总和 D、第VA族元素的简单氢化物中,的沸点不是最高的4. 下列化学用语表示正确的是( )A、中子数为10的氧原子:O B、碳的基态原子轨道表示式:
 C、SO2的价层电子对互斥模型:
C、SO2的价层电子对互斥模型: D、HCl的形成过程:
D、HCl的形成过程:  5. 某元素基态原子价层电子排布式为3d24s2 , 下列说法正确的是( )A、该元素原子处于能量最低状态时,原子中共有4个未成对电子 B、该元素基态原子核外有4个能层被电子占据 C、该元素原子的M层共有8个电子 D、该元素原子的最外层共有4个电子6. 下列粒子的VSEPR模型为四面体且其空间结构为三角锥形的是( )A、 B、 C、 D、7. 泽维尔研究发现,当用激光脉冲照射NaI使Na+和I-的核间距为1.0~1.5nm时,呈共价键。根据泽维尔的研究成果能得出的结论是( )A、NaI晶体是离子晶体和分子晶体的混合物 B、离子晶体可能含有共价键 C、NaI晶体中既有离子键,又有共价键 D、共价键和离子键没有绝对的界限8. 下列说法正确的是( )A、2px、2py、2pz轨道相互垂直,能量相等 B、稀有气体元素的基态原子的价电子排布式都为ns2np6 C、第一电离能越大,元素的电负性也越大 D、元素周期表各周期总是从ns能级开始,以np能级结束9. 下列各组元素各项性质的比较正确的是( )A、第一电离能:B>Al>Ga B、电负性:As>Se>Br C、最高正价:F>S>Si D、原子半径:P>N>C10. 的结构如图所示。下列说法正确的是( )
5. 某元素基态原子价层电子排布式为3d24s2 , 下列说法正确的是( )A、该元素原子处于能量最低状态时,原子中共有4个未成对电子 B、该元素基态原子核外有4个能层被电子占据 C、该元素原子的M层共有8个电子 D、该元素原子的最外层共有4个电子6. 下列粒子的VSEPR模型为四面体且其空间结构为三角锥形的是( )A、 B、 C、 D、7. 泽维尔研究发现,当用激光脉冲照射NaI使Na+和I-的核间距为1.0~1.5nm时,呈共价键。根据泽维尔的研究成果能得出的结论是( )A、NaI晶体是离子晶体和分子晶体的混合物 B、离子晶体可能含有共价键 C、NaI晶体中既有离子键,又有共价键 D、共价键和离子键没有绝对的界限8. 下列说法正确的是( )A、2px、2py、2pz轨道相互垂直,能量相等 B、稀有气体元素的基态原子的价电子排布式都为ns2np6 C、第一电离能越大,元素的电负性也越大 D、元素周期表各周期总是从ns能级开始,以np能级结束9. 下列各组元素各项性质的比较正确的是( )A、第一电离能:B>Al>Ga B、电负性:As>Se>Br C、最高正价:F>S>Si D、原子半径:P>N>C10. 的结构如图所示。下列说法正确的是( )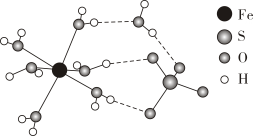 A、O的第一电离能低于S B、相同条件下,的稳定性比强 C、基态的价层电子排布式为 D、该物质中存在的化学键类型有:离子键、共价键、氢键11. 下表给出了几种氯化物的熔点和沸点。
A、O的第一电离能低于S B、相同条件下,的稳定性比强 C、基态的价层电子排布式为 D、该物质中存在的化学键类型有:离子键、共价键、氢键11. 下表给出了几种氯化物的熔点和沸点。物质
NaCl
MgCl2
AlCl3
CCl4
熔点/℃
801
712
190
-22.6
沸点/℃
1 413
1 412
182.7
76.8
关于表中4种氯化物有下列说法:
①AlCl3在加热时可升华
②CCl4属于分子晶体
③1 500 ℃时NaCl的分子组成可用NaCl表示
④AlCl3是典型的离子晶体
其中说法正确的是( )
A、只有(1)和(3) B、只有(3) C、只有(1)(2)(3) D、全部正确12. 下列说法中,正确的是( )A、s区元素全部是金属元素 B、p能级电子能量一定高于s能级电子能量 C、属于p区主族元素 D、第VIIA族元素从上到下,非金属性依次增强13. 设为阿伏加德罗常数的值。下列说法错误的是( )A、过氧化氢所含的共价键数目为 B、白磷含个键,二氧化硅中含个 C、等物质的量的和中含有键的数目均为 D、金刚石晶体中碳原子含有个键14. 下列说法中正确的有( )①金属晶体的导电性、导热性均与自由电子有关
②水结成冰密度减小与水分子之间能形成氢键有关
③的热稳定性和还原性依次减弱
④共价键的强弱决定分子晶体熔、沸点的高低
⑤的热稳定性依次减弱,熔沸点依次升高
⑥硬度由大到小:金刚石>碳化硅晶体硅
A、②③④⑥ B、①②③⑥ C、①②④⑤ D、①②⑤⑥15. 某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( ) A、的配位数为6 B、与距离最近的是 C、该物质的化学式为 D、若换为 , 则晶胞棱长将改变16. 由键能数据大小,不能解释下列事实的是( )
A、的配位数为6 B、与距离最近的是 C、该物质的化学式为 D、若换为 , 则晶胞棱长将改变16. 由键能数据大小,不能解释下列事实的是( )化学键
键能/
411
318
799
358
452
346
222
A、稳定性: B、键长: C、熔点: D、硬度:金刚石>晶体硅二、非选择题:本题共4道题,共52分。
-
17. 按要求回答下列问题:(1)、①基态原子的N能层有1个未成对电子,M能层未成对电子数最多的元素是(填元素符号,下同),其价层电子排布式为。
②最外层电子数是次外层电子数3倍的元素是 , 其轨道表示式为。
③Cu原子的结构示意图为。
(2)、H、C、N、O、Na的原子半径从小到大的顺序为。(3)、是直线形分子,是分子(填“极性”“非极性”)。的电子式为。18. 元素周期表是化学中最重要的基本工具之一、它可以帮助化学家更好地研究元素,在科学研究和工业应用中有广泛应用。近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe—Sm—As—F—O组成的化合物。(1)、比较离子半径:F-O2-(填“大于”“等于”或“小于”)。(2)、Sm的价层电子排布式为4f66s2 , Sm3+的价层电子排布式为。(3)、元素As与P同族,请举一事实说明非金属性P元素比As元素强。(4)、已知H3PO4为三元酸,其结构式为: 。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是。若将足量的KOH与次磷酸(H3PO2)充分反应,则化学方程式为。 19. 已知硼、氮、钴、铜是几种重要的元素,请回答下列问题:(1)、Co的基态原子中未成对电子数为个;Cu2+的电子排布式为。(2)、Cu的配合物A的结构如右图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为。其中氮原子的杂化方式是。(3)、配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2 , N2中键和π键数目之比是;N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为。
。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是。若将足量的KOH与次磷酸(H3PO2)充分反应,则化学方程式为。 19. 已知硼、氮、钴、铜是几种重要的元素,请回答下列问题:(1)、Co的基态原子中未成对电子数为个;Cu2+的电子排布式为。(2)、Cu的配合物A的结构如右图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为。其中氮原子的杂化方式是。(3)、配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2 , N2中键和π键数目之比是;N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为。 (4)、立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。
(4)、立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。
①晶胞中每个氮原子周围与其最近且等距离的硼原子有个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化硼的晶胞中,B原子的坐标参数分别有:B (0,0,0);B( , 0,);B ( , , 0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为;
20. 为解决汽车尾气达标排放,催化剂及其载体的选择和改良是关键。目前我国研制的稀土催化剂具有很好的催化转化效果,催化过程图如下。 (1)、Zr原子序数为40,价电子排布为:4d25s2 , 它在周期表中的位置为。(2)、CO、NO均能够与血红蛋白(Hb)中Fe2+形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。
(1)、Zr原子序数为40,价电子排布为:4d25s2 , 它在周期表中的位置为。(2)、CO、NO均能够与血红蛋白(Hb)中Fe2+形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡:CO+Hb·O2⇌O2+Hb·CO
①C、N、O三种元素,简单氢化物的沸点由大到小的顺序为(用氢化物化学式表示)。
②在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是:。
③高压氧舱可用于治疗CO中毒,结合平衡移动原理解释其原因:
(3)、为节省贵金属并降低成本,常用某些复合型物质作催化剂。一种复合型物质的晶胞结构如图所示。
①该复合型物质的化学式为。
②已知阿伏加德罗常数的值为NA , 该晶体的密度为ρg/cm3。其晶胞为立方体结构,则晶胞的边长为cm。(设NA为阿伏加德罗常数值,只要求列算式)。