浙江省台金七校2023-2024学年高一下学期4月期中联考化学试题
试卷更新日期:2024-04-30 类型:期中考试
一、选择题(本大题共20小题,1~10每小题2分,11~20每小题3分,共50分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
-
1. 下列设备或物品工作时,将化学能转化为电能的是( )
 A、硅太阳能电池 B、干电池 C、燃气灶 D、太阳能集热器2. 下列属于酸性氧化物的是( )A、 B、 C、 D、3. 在粗盐提纯实验中不需要用到的仪器是( )A、烧杯 B、玻璃棒 C、酒精灯 D、坩埚4. 下列表示物质结构的化学用语或模型不正确的是( )A、氮气的结构式: B、分子的球棍模型:
A、硅太阳能电池 B、干电池 C、燃气灶 D、太阳能集热器2. 下列属于酸性氧化物的是( )A、 B、 C、 D、3. 在粗盐提纯实验中不需要用到的仪器是( )A、烧杯 B、玻璃棒 C、酒精灯 D、坩埚4. 下列表示物质结构的化学用语或模型不正确的是( )A、氮气的结构式: B、分子的球棍模型: C、的结构示意图:
C、的结构示意图: D、异丁烷的结构简式:
5. 下列物质与俗名对应不正确的是( )A、氯仿: B、水玻璃:水溶液 C、重晶石: D、胆矾:6. 下列反应属于氧化还原反应,且能量变化如图所示的是( )
D、异丁烷的结构简式:
5. 下列物质与俗名对应不正确的是( )A、氯仿: B、水玻璃:水溶液 C、重晶石: D、胆矾:6. 下列反应属于氧化还原反应,且能量变化如图所示的是( ) A、镁与盐酸的反应 B、双氧水的分解反应 C、灼热的炭与的反应 D、晶体与晶体的反应7. 下列说法正确的是( )A、与互为同位素 B、石墨烯和碳纳米管互为同素异形体 C、与互为同分异构体 D、和互为同系物8. 关于反应 , 下列说法不正确的是( )A、C发生了氧化反应 B、反应中N元素被还原 C、浓硝酸体现了酸性和氧化性 D、氧化产物与还原产物的物质的量之比为9. 下列说法不正确的是( )A、化学反应必然伴随着能量的变化 B、化学反应中能量变化的主要原因是化学键的断裂与形成 C、化学键断裂需要吸收能量 D、放热反应中任一反应物的能量都高于生成物的能量10. 下列说法中正确的是( )A、锂离子电池、铅蓄电池都是一次电池 B、锌锰干电池放电时被还原 C、化学电池实现了化学能全部转化为电能 D、燃料电池是一种清洁、安全、低效的新型电池11. 过量铁与稀硫酸反应,下列措施能加快反应速率但又不改变生成的总量的是( )A、加入适量溶液 B、加入少量水 C、加入少量固体 D、用的浓硫酸代替稀硫酸12. 下列方程式书写正确的是( )A、碳酸氢铵的电离: B、二氧化氮与水反应: C、工业制粗硅: D、过量通入溶液中:13. 某原电池装置如图所示,下列叙述正确的是( )
A、镁与盐酸的反应 B、双氧水的分解反应 C、灼热的炭与的反应 D、晶体与晶体的反应7. 下列说法正确的是( )A、与互为同位素 B、石墨烯和碳纳米管互为同素异形体 C、与互为同分异构体 D、和互为同系物8. 关于反应 , 下列说法不正确的是( )A、C发生了氧化反应 B、反应中N元素被还原 C、浓硝酸体现了酸性和氧化性 D、氧化产物与还原产物的物质的量之比为9. 下列说法不正确的是( )A、化学反应必然伴随着能量的变化 B、化学反应中能量变化的主要原因是化学键的断裂与形成 C、化学键断裂需要吸收能量 D、放热反应中任一反应物的能量都高于生成物的能量10. 下列说法中正确的是( )A、锂离子电池、铅蓄电池都是一次电池 B、锌锰干电池放电时被还原 C、化学电池实现了化学能全部转化为电能 D、燃料电池是一种清洁、安全、低效的新型电池11. 过量铁与稀硫酸反应,下列措施能加快反应速率但又不改变生成的总量的是( )A、加入适量溶液 B、加入少量水 C、加入少量固体 D、用的浓硫酸代替稀硫酸12. 下列方程式书写正确的是( )A、碳酸氢铵的电离: B、二氧化氮与水反应: C、工业制粗硅: D、过量通入溶液中:13. 某原电池装置如图所示,下列叙述正确的是( ) A、电子经过溶液流向电极 B、作负极,发生氧化反应 C、铜电极的电极反应式: D、电池工作时,溶液中移向正极14. 下列关于甲烷与氯气的反应表述正确的是( )A、该反应为置换反应 B、若过量,则有机产物仅为 C、若生成等物质的量的四种有机产物则需消耗 D、反应条件是水浴加热15. 设表示阿伏加德罗常数的值.下列说法正确的是( )A、个分子的体积约为 B、常温常压下,乙烷中含有的共价键数日为 C、标准状况下,壬烷中含有的分子数目为 D、氨水中,含有的的数目共为16. 下列实验装置不能达到实验目的的是( )。
A、电子经过溶液流向电极 B、作负极,发生氧化反应 C、铜电极的电极反应式: D、电池工作时,溶液中移向正极14. 下列关于甲烷与氯气的反应表述正确的是( )A、该反应为置换反应 B、若过量,则有机产物仅为 C、若生成等物质的量的四种有机产物则需消耗 D、反应条件是水浴加热15. 设表示阿伏加德罗常数的值.下列说法正确的是( )A、个分子的体积约为 B、常温常压下,乙烷中含有的共价键数日为 C、标准状况下,壬烷中含有的分子数目为 D、氨水中,含有的的数目共为16. 下列实验装置不能达到实验目的的是( )。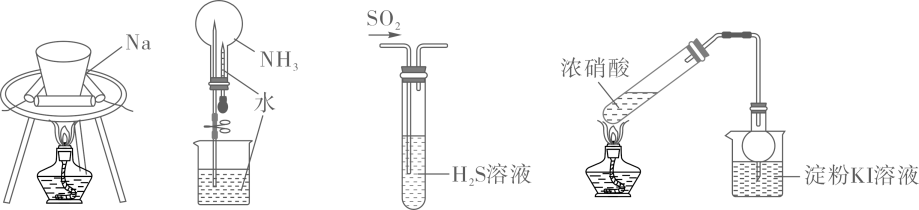
图① 图② 图③ 图④
A、图①用于观察金属钠在空气中加热所发生的变化 B、图②用于验证氨气在水中的溶解性 C、图③用于验证二氧化硫的氧化性 D、图④用于检验浓硝酸受热分解产生的气体17. 一定温度下,往的密闭容器中通入气体X发生放热反应: , X的物质的量随时间的变化曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是( ) A、实线表示的是使用催化剂的情形 B、反应进行到a点时的平均反应速率可表示为 C、b点已达到了化学平衡状态,若升高温度正、逆反应速率都加快,原平衡被破坏 D、反应进行到a点时放出的热量大于反应进行到b点时放出的热量18. 下列说法不正确的是( )A、二氧化硅生产的光导纤维能有效提高通信效率 B、中国华为集团自主研发的“麒麟”芯片在生产时需要用到高纯度的硅 C、普通玻璃的生产以纯碱、石灰石、石英砂为主要原料 D、工业上制硫酸和硝酸的最后一步都是用水来吸收19. 根据乙烯的性质推测丁烯的性质,下列说法不正确的是( )A、丁烯能使酸性高锰酸钾溶液褪色 B、丁烯能在空气中燃烧 C、丁烯与溴发生加成反应的产物是 D、聚丁烯的结构可以表示20. 现有一份澄清透明溶液,可能含有中的若干种,且各离子的物质的量浓度均为(不考虑水的电离)。往该溶液中加入过量的盐酸酸化的溶液,无沉淀生成。另取少量原溶液,设计并完成如下实。下列关于原溶液的判断不正确的是( )
A、实线表示的是使用催化剂的情形 B、反应进行到a点时的平均反应速率可表示为 C、b点已达到了化学平衡状态,若升高温度正、逆反应速率都加快,原平衡被破坏 D、反应进行到a点时放出的热量大于反应进行到b点时放出的热量18. 下列说法不正确的是( )A、二氧化硅生产的光导纤维能有效提高通信效率 B、中国华为集团自主研发的“麒麟”芯片在生产时需要用到高纯度的硅 C、普通玻璃的生产以纯碱、石灰石、石英砂为主要原料 D、工业上制硫酸和硝酸的最后一步都是用水来吸收19. 根据乙烯的性质推测丁烯的性质,下列说法不正确的是( )A、丁烯能使酸性高锰酸钾溶液褪色 B、丁烯能在空气中燃烧 C、丁烯与溴发生加成反应的产物是 D、聚丁烯的结构可以表示20. 现有一份澄清透明溶液,可能含有中的若干种,且各离子的物质的量浓度均为(不考虑水的电离)。往该溶液中加入过量的盐酸酸化的溶液,无沉淀生成。另取少量原溶液,设计并完成如下实。下列关于原溶液的判断不正确的是( ) A、是否存在需要通过焰色试验来确定 B、通过层的颜色变化,也能判断出原溶液中是否存在 C、虽然实验过程引入了氯元素,但不影响原溶液是否存在的判断 D、肯定不存在的离子是
A、是否存在需要通过焰色试验来确定 B、通过层的颜色变化,也能判断出原溶液中是否存在 C、虽然实验过程引入了氯元素,但不影响原溶液是否存在的判断 D、肯定不存在的离子是二、填空题(本大题共5小题,共50分)
-
21. 有A、B、C、D四种常温气态烃的相关信息如下表:
烃
A
B
C
D
信息
煤层气的主要成分
一种植物生长调节剂
球棍模型为

制造聚丙烯塑料(PP)的原料
(1)、A的电子式为 , 上述物质中属于A的同系物的有(填字母)。(2)、写出B使溴水褪色的化学方程式 , 反应类型为。(3)、下列关于C的描述正确的是____。A、该分子为难溶于水的无色气体 B、该分子中所有原子都在同一平面 C、该分子存在同分异构体 D、该分子可发生取代反应、氧化反应和分解反应(4)、写出D的结构简式 , D可以使溶液褪色而PP不能,请从结构角度予以解释。22. 实验室制取氨气通常有两种方法:方法I:固体氢氧化钙与氯化铵共热;
方法Ⅱ:固体氢氧化钠中滴入浓氨水。
(1)、下图装置用于方法的氨气制备,下列叙述正确的是____。 A、大试管倾斜向下的原因是方便氨气逸出 B、碱石灰的作用是干燥氨气 C、棉花的作用是减少氨气与空气的对流 D、将湿润的蓝色石蕊试纸置于试管口,变红说明氨气已收集满(2)、下图中部分装置可用于方法Ⅱ制备氨气,请回答下列问题:
A、大试管倾斜向下的原因是方便氨气逸出 B、碱石灰的作用是干燥氨气 C、棉花的作用是减少氨气与空气的对流 D、将湿润的蓝色石蕊试纸置于试管口,变红说明氨气已收集满(2)、下图中部分装置可用于方法Ⅱ制备氨气,请回答下列问题:
①若要通过方法Ⅱ制备氨气并完成尾气处理,上图中需要用到的装置有(填字母):
②发生装置中生成氨气的化学方程式为 , 写出的两个作用 , 下列固体可以代替的有。
A.石灰石 B.食盐晶体 C.生石灰
23. 应用原电池原理制作的电池种类繁多,请根据题中的信息回答下列问题:(1)、下列反应能设计成原电池的是____;A、氢氧化钠与盐酸中和 B、在中燃烧 C、与反应 D、铁片投入硫酸铜溶液(2)、有甲、乙两位同学想利用原电池反应检测金属的活动性顺序,两人均采用片与片作为电极,甲同学使用的电解质溶液为的稀硫酸,乙同学采用的是同浓度的溶液,装置如下图所示。请回答:
甲 乙
①甲装置中正极的电极方程式为 , 乙装置中的在溶液中移向极(填“”或“”);
②乙装置中的负极为 , 乙同学的实验能否说明铝的金属性比镁强(填“能”或“不能”)
③根据以上实验结果 , 在原电池中相对活泼的金属作正极还是作负极,除了与金属本身的还原性有关外,还受到哪些因素的影响?
(3)、甲烷-氧气燃料电池使用稀硫酸作为电解质溶液,总反应方程式为 , 通甲烷一极发生的电极反应式为 , 反应类型是反应(填“氧化”或“还原”)。24. 工业生产通常需要考虑能耗、速率、限度、环境保护、经济效益等多方面因素。请回答:(1)、已知断裂化学键需要的能量如下表所示:化学键
能量/
436
391
946
工业合成氨反应中若完全反应,放出热量。
(2)、消除污染物 , 可在一定条件下用和发生反应 , 在恒容密闭容器中充入和发生反应,回答下列问题:①为了提高正反应的速率,下列措施可行的是
A.充入氦气 B.升高温度 C.使用催化剂 D.移除
②若恒容容器的体积为 , 后 , 则此段时间内;
③下列事实能够说明该反应达到化学平衡状态的是(填字母)
A.和的物质的量之比为
B.混合气体的平均相对分子质量不再变化
C.
D.断开1个键同时形成2个分子
(3)、已知增大催化剂的比表面积可提高反应的速率。为了验证某些因素对上述化学反应速率的影响规律,某同学设计了三组实验,如表所示:实验编号
初始浓度/()
初始浓度/()
催化剂的比表面积()
1
280
82
2
280
124
3
350
a
82
请回答:①表中;
②此实验验证的影响因素除了催化剂的比表面积还有 ,
能证明该因素对反应速率的影响规律的实验编号为;
③已知催化剂不会改变反应的限度,请在右图中画出实验2从起始到时刻的变化曲线。
 25. 将铜与一定浓度的硝酸溶液恰好完全反应,仅产生和两种气体,标准状况下气体总体积为。请回答:(1)、标准状况下的体积为;(2)、硝酸溶液的浓度为;(3)、若在反应后的溶液中再加入的稀硫酸,则该混合溶液最多还可以溶解的铁单质质量为。
25. 将铜与一定浓度的硝酸溶液恰好完全反应,仅产生和两种气体,标准状况下气体总体积为。请回答:(1)、标准状况下的体积为;(2)、硝酸溶液的浓度为;(3)、若在反应后的溶液中再加入的稀硫酸,则该混合溶液最多还可以溶解的铁单质质量为。