四川省凉山州宁南中学2023-2024学年高一下学期期中模拟考试化学试题
试卷更新日期:2024-04-30 类型:期中考试
一、单选题(每题3分,共42分)
-
1. 化学与生活息息相关,下列说法正确的是( )A、二氧化硫具有漂白作用,工业上常用来漂白纸浆、毛、丝、食品等 B、氨气易液化,液氨汽化时要吸收大量的热,因此液氨可用作制冷剂 C、混泥土的使用十分广泛,其中生产普通的硅酸盐水泥的主要原料是石英砂 D、华为公司自主研发麒麟990芯片采用7nm工艺,芯片的主要成分是二氧化硅2. 下列说法不正确的是( )A、玻璃、水泥、陶瓷是三大传统的无机非金属材料 B、SO2既可用于漂白纸浆,又可用于杀菌、消毒 C、中国天眼传输信息用的光纤材料的主要成分是Si D、因为铁在浓硫酸中会钝化,所以可以用铁罐盛放热的浓硫酸3. 下列说法中正确的是( )A、物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化也一定是化学变化 B、需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 C、吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多 D、因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼4. 表示阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,将2molNO和1molO2混合后,体系中的分子总数为2NA B、常温下,1molFe与足量的浓硫酸充分反应,转移电子数为2NA C、1molSiO2可溶于水生成1molH2SiO3 D、向50mL18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸物质的量小于0.45mol5. 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如图所示,下列说法错误的是( )
 A、上图所示氮循环中,N2转化为氨态氮属于氮的固定 B、氨气是生产氮肥的主要原料,工业上用氮气和氢气合成氨 C、反硝化过程中,含氮物质发生氧化反应 D、硝化过程中,含氮物质发生氧化反应6. 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程如图:
A、上图所示氮循环中,N2转化为氨态氮属于氮的固定 B、氨气是生产氮肥的主要原料,工业上用氮气和氢气合成氨 C、反硝化过程中,含氮物质发生氧化反应 D、硝化过程中,含氮物质发生氧化反应6. 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程如图:
下列说法正确的是( )
A、硅在自然界中主要以游离态形式存在 B、电弧炉中的反应为SiO2+CSi+CO2↑ C、还原炉中,理论上得到的氧化产物与还原产物的物质的量之比为1:3 D、(沸点31.5℃)中含有少量的(沸点57.6℃),通过蒸馏可提纯7. 下列有关离子方程式正确的是( )A、NO2通入水中: B、向Na2SO4溶液中滴加BaCl2溶液: C、SiO2与NaOH制Na2SiO3: D、室温下用稀HNO3溶解Cu:8. 化学反应与能量变化对人类生产、生活有重要的意义,下列说法正确的是( ) A、图1装置可以用于探究一个反应是吸热反应还是放热反应 B、能量变化如图2的反应必须加热才能发生反应 C、常温常压下,断开1molH2中的化学键吸收436kJ的能量,断开1molCl2中的化学键吸收243kJ的能量,形成2molHCl中的化学键释放862kJ的能量,故H2和Cl2反应释放能量 D、一定条件下,石墨转化为金刚石要吸收能量,故金刚石比石墨稳定9. 在1200℃时,天然气脱硫工艺中会发生下列反应
A、图1装置可以用于探究一个反应是吸热反应还是放热反应 B、能量变化如图2的反应必须加热才能发生反应 C、常温常压下,断开1molH2中的化学键吸收436kJ的能量,断开1molCl2中的化学键吸收243kJ的能量,形成2molHCl中的化学键释放862kJ的能量,故H2和Cl2反应释放能量 D、一定条件下,石墨转化为金刚石要吸收能量,故金刚石比石墨稳定9. 在1200℃时,天然气脱硫工艺中会发生下列反应①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A、△H4=2/3(△H1+△H2-3△H3) B、△H4=2/3(3△H3-△H1-△H2) C、△H4=3/2(△H1+△H2-3△H3) D、△H4=3/2(△H1-△H2-3△H3)10. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )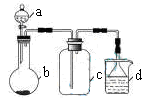
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸(70%)
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A、A B、B C、C D、D11. 某兴趣小组设计的原电池如图所示,下列说法正确的是( ) A、Cu电极为负极,发生氧化反应 B、电池工作时,电子从Zn电极经电解质溶液流向Cu电极 C、当Zn电极质量减少65g时,Cu电极生成22.4LH2 D、放电过程中,从左向右移动12. 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( )
A、Cu电极为负极,发生氧化反应 B、电池工作时,电子从Zn电极经电解质溶液流向Cu电极 C、当Zn电极质量减少65g时,Cu电极生成22.4LH2 D、放电过程中,从左向右移动12. 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( ) A、电极a为电池的负极 B、电极b上发生的电极反应为:O2+4H++4e−=2H2O C、电路中每流过2 mol电子,在正极消耗22.4LH2S D、每34 g H2S参与反应,有2molH+经质子膜进入正极区13. 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是( )
A、电极a为电池的负极 B、电极b上发生的电极反应为:O2+4H++4e−=2H2O C、电路中每流过2 mol电子,在正极消耗22.4LH2S D、每34 g H2S参与反应,有2molH+经质子膜进入正极区13. 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是( )物质
A、 B、 C、2H2O(l)=2H2(g)+O2(g) D、14. 已知某化学反应A2(g)+2B2(g)=2AB2(g),能量变化如图所示,下列叙述中正确的是( ) A、该反应的进行一定需要加热或点燃 B、该反应若生成2molAB2(g)时,放出的热量为(E1-E2)kJ C、物质AB2比A2更稳定 D、该反应断开化学键吸收的总能量大于形成化学键释放的总能量
A、该反应的进行一定需要加热或点燃 B、该反应若生成2molAB2(g)时,放出的热量为(E1-E2)kJ C、物质AB2比A2更稳定 D、该反应断开化学键吸收的总能量大于形成化学键释放的总能量二、非选择题(共4个小题,共58分)
-
15. 某研究小组用如图装置制取SO2并对其性质进行相关实验(部分夹持装置已略去)。
 (1)、装置A用于制取SO2 , 发生反应的化学方程式为。(2)、将B中FeCl3溶液换成KMnO4酸性溶液也能达到检验SO2性质的目的,根据氧化还原反应配平其方程式:(3)、C中观察到的现象是;B、C、D三支试管中的现象分别体现了SO2的性、性和漂白性。(4)、装置D中的实验目的是探究SO2与品红作用的可逆性,请写出实验操作及现象。(5)、尾气处理时将气体通入溶液。终止反应,冷却溶液后将装置A中Y型试管倾斜,使(填“左”或“右”,下同)侧的物质全部转移到侧,这时看到溶液的颜色为色。16. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol/L的H2SO4溶液中,乙同学将电极放入6mol/L的NaOH溶液中,如图所示。
(1)、装置A用于制取SO2 , 发生反应的化学方程式为。(2)、将B中FeCl3溶液换成KMnO4酸性溶液也能达到检验SO2性质的目的,根据氧化还原反应配平其方程式:(3)、C中观察到的现象是;B、C、D三支试管中的现象分别体现了SO2的性、性和漂白性。(4)、装置D中的实验目的是探究SO2与品红作用的可逆性,请写出实验操作及现象。(5)、尾气处理时将气体通入溶液。终止反应,冷却溶液后将装置A中Y型试管倾斜,使(填“左”或“右”,下同)侧的物质全部转移到侧,这时看到溶液的颜色为色。16. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol/L的H2SO4溶液中,乙同学将电极放入6mol/L的NaOH溶液中,如图所示。 (1)、甲中SO移向(填“铝片”或“镁片”),写出甲中正极的电极反应式。(2)、乙中负极为(填“铝片”或“镁片”),写出正极的电极反应式式:。(3)、铅蓄电池中,正极材料为PbO2 , 负极材料为Pb,电解液为硫酸,放电时其正极反应式为。(4)、如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
(1)、甲中SO移向(填“铝片”或“镁片”),写出甲中正极的电极反应式。(2)、乙中负极为(填“铝片”或“镁片”),写出正极的电极反应式式:。(3)、铅蓄电池中,正极材料为PbO2 , 负极材料为Pb,电解液为硫酸,放电时其正极反应式为。(4)、如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从口通入(填“A”或“B”)。电流由流向(填“a”或“b”)。其总反应方程式为 , 在碱性条件下,负极反应式为。
(5)、直接乙醇燃料电池()具有很多优点。现有以下三种乙醇燃料电池。
①碱性乙醇燃料电池中,电极a上发生的电极反应式为。
②酸性乙醇燃料电池中,电极a上发生的电极反应式为。
③熔融碳酸盐乙醇燃料电池中,电极b上发生的电极反应式为。
(6)、某同学设计如图的原电池,负极实验现象为 , 则正极的电极反应式为: , 当导线中有3.01×1023个电子流过,溶液质量变化为g。 17. 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
17. 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O22Cl2+2H2O
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.
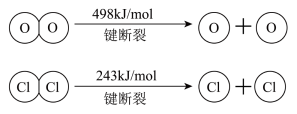 (1)、H2O的电子式是。(2)、反应A的热化学方程式是(注意:不写条件)。(3)、断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)。(4)、请回答:
(1)、H2O的电子式是。(2)、反应A的热化学方程式是(注意:不写条件)。(3)、断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)。(4)、请回答:参加反应的物质及状态
1mol分子中的化学键断裂时需要吸收的能量
436
a
369
H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1 , 蒸发1mol Br2(1)需要吸收的能量为30kJ,则上表中a的数值为:。
(5)、已知甲烷的燃烧热为890.3kJ·mol-1 , H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1 , N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 , 则甲烷脱硝反应:CH4(g)+2NO(g)+O2(g)=CO2(g)+N2(g)+2H2O(g) ΔH=。(6)、二氧化碳经催化氢化可转化成绿色能源乙醇(CH3CH2OH)。已知:①2H2(g)+O2(g)=2H2O(g) = -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.8kJ·mol-1
③H2O(l)=H2O(g) =+44.0kJ·mol-1
则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:。
18. 以焙烧黄铁矿(FeS2 , 杂质为石英等)产生的红渣为原料制备铵铁蓝颜料,工艺流程如图。
回答下列问题:
(1)、写出两种能够提高酸浸率的措施。(2)、红渣的主要成分是(填化学式),焙烧黄铁矿过程中若产生8.96 L(标准状况)SO2 , 则反应中转移电子的数目为。(3)、若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为。(4)、“一系列操作”包括、、过滤。(5)、简述洗涤铵铁蓝沉淀的操作:。