湖北省“荆、荆、襄、宜四地七校”考试联盟2023-2024学年高一下学期期中联考化学试卷
试卷更新日期:2024-04-30 类型:期中考试
一、选择题:本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 下列各组反应(表中物质均为反应物)在反应刚开始时,放出H2的速率最大的是( )
选项
金属(粉末状)及其物质的量/mol
酸的浓度及体积
反应温度/℃
A.
Mg 0.1
8 mol∙L-1硝酸 10mL
30
B.
Mg 0.1
3 mol∙L-1盐酸 10mL
30
C.
Fe 0.1
6 mol∙L-1盐酸 10mL
30
D.
Mg 0.1
3 mol∙L-1硫酸 10mL
30
A、A B、B C、C D、D2. 少量锌粉与100mL的稀盐酸反应,为了加快此反应速率且不改变生成的总量,以下方法可行的是( )①适当升高温度;②再加入100mL的稀盐酸;③加少量固体;④加入少量醋酸钠固体;⑤加几滴浓硫酸;⑥滴入几滴硫酸铜溶液。
A、①⑤ B、②③ C、①⑥ D、②④3. 下列有关反应的离子方程式书写正确的是( )A、氯气溶于水: B、过量与“84”消毒液(有效成分NaClO)反应: C、向溶液中加入过量浓氨水: D、通入酸性高锰酸钾溶液:4. 下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
选项
试剂X
收集气体
试剂Y
A.
碱石灰
氯化氢
水
B.
碱石灰
氨气
水
C.
五氧化二磷
二氧化硫
氢氧化钠溶液
D.
氯化钙
一氧化氮
氢氧化钠溶液
A、A B、B C、C D、D5. NA代表阿伏加德罗常数的值,以下说法正确的是( )A、将足量Zn与100mL18mol/L浓硫酸反应,生成224mL气体,转移电子为0.02NA B、在标准状况下,22.4LHF所含的原子总数为2NA C、1mol固体中含离子总数与1mol固体中含离子总数之比为 D、1mol(其中D代表重氢原子符号)中含有的中子数为10NA6. 下列各组离子或分子在给定条件的溶液中可能大量共存的是( )A、加入铝片有大量氢气产生的溶液中:、、、 B、在0.1mol/L的盐酸中:、、、 C、在强碱性溶液中:、、、 D、碱性无色溶液中:、、、7. 能与水反应生成次氯酸,可杀死新型冠状病毒等多种病毒。一种制备的原理为 , 装置如图所示。
已知:①的熔点为-116℃、沸点为3.8℃,具有强烈刺激性气味、易溶于水;②与有机物、还原剂接触或加热时会发生燃烧并爆炸。
下列说法中正确的是( )
A、装置②中盛装的试剂是浓硫酸,用来干燥 B、装置④与⑤之间可用橡胶管连接 C、易液化,装置⑤中的液氨只能冷凝 , 因此从装置⑤中逸出气体的主要成分是 D、通入干燥空气的目的是将生成的稀释,减小爆炸危险8. 在无机非金属材料中,硅扮演着重要的角色。下列有关硅及其化合物的说法中正确的是( )A、制备粗硅的化学方程式为: B、硅胶可作瓶装药品的干燥剂及催化剂载体,是因为是酸性氧化物 C、既可以与NaOH溶液反应,又可以与HF溶液反应 D、青花瓷胎体的原料为高岭土[],若以氧化物形式可表示为9. (NH4)2SO4在一定条件下发生如下反应: , 将反应后的气体通入一定量的BaCl2溶液中,发现溶液中有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )A、生成的沉淀中既有BaSO4、又有BaSO3 , 且约为 B、生成的沉淀中既有BaSO4、又有BaSO3 , 且约为 C、因为弱酸不能制强酸,所以该实验中反应后气体通入BaCl2溶液中只有BaSO4沉淀 D、从溶液中逸出的气体只有N2 , 最后留下溶液中溶质只有较多的NH4Cl10. 化学反应A+B→C(吸收能量)分两步进行:①A+B→X(放出能量),②X→C(吸收能量)。下列示意图中表示总反应过程中能量变化正确的图像是( )A、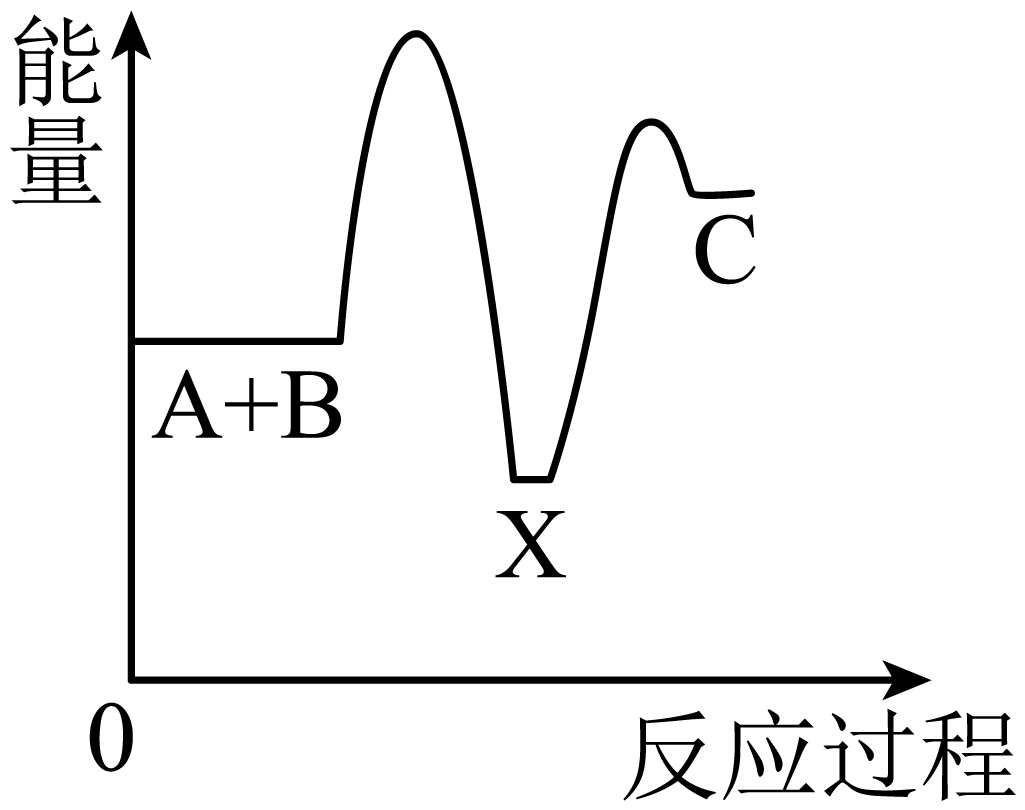 B、
B、 C、
C、 D、
D、 11. 下列关于浓硫酸的说法正确的是( )A、浓硫酸使蓝色胆矾变白体现了脱水性 B、浓硫酸不能干燥、HI、等强还原性化合物 C、蔗糖和浓硫酸的“黑面包”实验中,浓硫酸主要体现了脱水性和强氧化性 D、浓硫酸和碳单质在加热条件下反应,反应中浓硫酸既体现出酸性,又体现出氧化性12. 镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金,该电池在充放电过程中的总反应方程式是: , 下列说法正确的是( )A、放电过程中负极MH得电子发生氧化反应 B、NiMH电池放电过程中,正极的电极反应式为 C、NiMH电池电子由负极→正极→电解质溶液→负极,形成闭合回路 D、NiMH电池可以用盐酸作为电解质溶液13. 下列实验“操作和现象”与“结论”对应关系正确的是( )
11. 下列关于浓硫酸的说法正确的是( )A、浓硫酸使蓝色胆矾变白体现了脱水性 B、浓硫酸不能干燥、HI、等强还原性化合物 C、蔗糖和浓硫酸的“黑面包”实验中,浓硫酸主要体现了脱水性和强氧化性 D、浓硫酸和碳单质在加热条件下反应,反应中浓硫酸既体现出酸性,又体现出氧化性12. 镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金,该电池在充放电过程中的总反应方程式是: , 下列说法正确的是( )A、放电过程中负极MH得电子发生氧化反应 B、NiMH电池放电过程中,正极的电极反应式为 C、NiMH电池电子由负极→正极→电解质溶液→负极,形成闭合回路 D、NiMH电池可以用盐酸作为电解质溶液13. 下列实验“操作和现象”与“结论”对应关系正确的是( )操作
现象
结论
A.
向NaBr溶液中滴入少量氯水和苯,振荡、静置
溶液上层呈橙色
还原性:
B.
将氯气缓缓通入到紫色的石蕊溶液中
石蕊溶液先变红后褪色
氯气与水反应生成了酸性物质和漂白性物质
C.
将装满氯水的圆底烧瓶倒置在盛有水的水槽中,日光照射
烧瓶内有气泡生成
日光照射时,逸出的气体只可能是
D.
分别加热和固体
试管内壁都有水珠
两种物质均受热分解
A、A B、B C、C D、D14. 向绝热恒容密闭容器中通入SO2和NO2 , 在一定条件下发生反应 , 正反应速率随时间变化的示意图如下图,下列结论中正确的个数为( )
①反应在c点到达平衡
②SO2浓度:a点小于c点
③反应物的总能量低于生成物的总能量
④ , ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
A、3个 B、4个 C、5个 D、6个15. 硝酸是工业生产中不可或缺的化学品之一,通常用硝酸来制取硝酸铜溶液。为了分析制取硝酸铜溶液过程中的原料用量和产生污染气体的情况,某中学化学兴趣小组用足量的铜与一定量的浓硝酸充分反应,得到6.72L(标准状况)与NO的混合气体,这些气体与一定体积的混合后通入水中,恰好被完全吸收生成硝酸。该兴趣小组又向所得硝酸铜溶液中加溶液,恰好沉淀完全。下列说法正确的是( )A、参加反应的是0.75mol B、消耗氧气的体积为3.36L C、此反应过程中转移了0.3mol的电子 D、混合气体中含0.15molNO二、非选择题:本题共4小题,共55分。
-
16. 如图是用浓硝酸、铜片、水等试剂,探究浓、稀硝酸强氧化性并观察还原产物的实验装置。
 (1)、I.浓硝酸的强氧化性实验
(1)、I.浓硝酸的强氧化性实验将铜片置于具支试管的底部,在分液漏斗中加入约5mL浓硝酸,往具支试管中放入约2mL浓硝酸,集气瓶c中收集到一种无色气体。
仪器a的名称为。(2)、实验中观察到能证明浓硝酸具有强氧化性的现象是。(3)、Ⅱ.稀硝酸的强氧化性实验上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,可以将浓硝酸稀释后加入具支试管再与铜片反应,此时发生反应的离子方程式是;集气瓶c中仍收集到一种无色气体,此时向集气瓶c中通入一定量的氧气后集气瓶c中逐渐充满无色溶液,请写出通入一定量的氧气后集气瓶c中发生的总反应方程式。
(4)、能证明稀硝酸与铜反应产生NO的实验现象是____(填标号)。A、c中收集到无色气体 B、c中收集到的无色气体接触空气后变为红棕色 C、b中产生的无色气体接触空气后变为红棕色(5)、Ⅲ.问题讨论用等质量铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因,是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
你认为上述看法(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:。
17. 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。针对表中①~⑧号元素回答下列问题。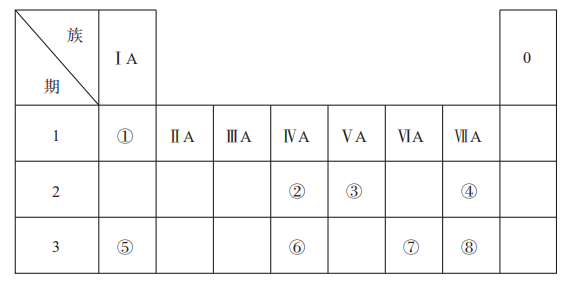 (1)、元素①和③的简单化合物含有10个电子,其电子式为 , 它的沸点比PH3高,原因是;(2)、测定文物年代需要利用元素②的一种中子数为8的核素,该核素符号可表示为;(3)、元素①和氧元素形成的18电子化合物的名称是: , 该化合物中含有的化学键有(填“离子键、极性键、非极性键”);(4)、元素④、⑤、⑧中,原子半径最大的是(填元素符号),离子半径最大的是(填化学式)。(5)、可以证明元素⑧比元素⑦非金属性强的一个化学反应方程式是:。18. 习近平总书记在浙江湖州市安吉县考察时提出了一个科学论断“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。请回答下列问题:(1)、硫酸工业排出的尾气(主要含)可用软锰矿浆()吸收,写出如图所示“反应”的化学方程式为。
(1)、元素①和③的简单化合物含有10个电子,其电子式为 , 它的沸点比PH3高,原因是;(2)、测定文物年代需要利用元素②的一种中子数为8的核素,该核素符号可表示为;(3)、元素①和氧元素形成的18电子化合物的名称是: , 该化合物中含有的化学键有(填“离子键、极性键、非极性键”);(4)、元素④、⑤、⑧中,原子半径最大的是(填元素符号),离子半径最大的是(填化学式)。(5)、可以证明元素⑧比元素⑦非金属性强的一个化学反应方程式是:。18. 习近平总书记在浙江湖州市安吉县考察时提出了一个科学论断“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。请回答下列问题:(1)、硫酸工业排出的尾气(主要含)可用软锰矿浆()吸收,写出如图所示“反应”的化学方程式为。 (2)、治理汽车尾气中和CO的方法之一是在汽车的排气管上装一个催化转化装置,使和CO在催化剂作用下转化为无毒物质,发生反应 . 一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和 , 的物质的量随时间的变化曲线如图所示。
(2)、治理汽车尾气中和CO的方法之一是在汽车的排气管上装一个催化转化装置,使和CO在催化剂作用下转化为无毒物质,发生反应 . 一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和 , 的物质的量随时间的变化曲线如图所示。
①0~10min内该反应的平均速率。
②从11min起其他条件不变,压缩容器的容积变为1L,则的变化曲线可能为图中的(填字母)。
③恒温恒容条件下,不能说明该反应已经达到平衡状态的是(填标号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
D.容器内混合气体平均相对分子质量保持不变
(3)、利用反应构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:
电极A是原电池的(填“正极”或“负极”),发生(填“氧化反应”或“还原反应”),电极B上发生的电极反应为。
19. 一节1号干电池可以让1平方米土地上的庄稼颗粒无收,回收电池既可以防止污染又可以变废为宝。废旧锌锰干电池内部的黑色物质A主要含有、、、、碳单质、少量有机物(有机物易燃烧生成和),用黑色物质A制备高纯的流程如图: (1)、第I步操作是为了除去可溶性的(填化学式)。(2)、第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为 , 另一个是。灼烧时,MnOOH与空气中的氧气反应的化学方程式为。(3)、第III步中为提高反应速率,可以采取的措施有(任写一条)。(4)、已知:难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;在pH大于7.7时,开始转化为沉淀。第IV步中的多步操作可按如图步骤进行:
(1)、第I步操作是为了除去可溶性的(填化学式)。(2)、第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为 , 另一个是。灼烧时,MnOOH与空气中的氧气反应的化学方程式为。(3)、第III步中为提高反应速率,可以采取的措施有(任写一条)。(4)、已知:难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;在pH大于7.7时,开始转化为沉淀。第IV步中的多步操作可按如图步骤进行:
①操作V加入溶液调节溶液pH的过程中有产生,则溶液与溶液反应的离子方程式为;
②操作VI中需要的玻璃仪器有;
③你认为操作VII中检测的方法及现象是时可继续进行操作VIII;
④操作VIII中用无水乙醇洗涤的目的是。