湖北省鄂北六校2023-2024学年高二下学期期中考试化学试题
试卷更新日期:2024-04-30 类型:期中考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 泱泱中华,历史何其悠久,文明何其博大。文物筑牢文明之基,国务院设立每年6月的第二个星期六为文化和自然遗产日,国家文物局将今年的活动主题定为“保护文物传承文明”。下列文物的材质属于天然有机高分子的是( )




A.铜奔马
B.汉竹简
C.莲花形玻璃托盏
D.垂鳞纹秦公铜鼎
A、A B、B C、C D、D2. 有机物在日常生活中有广泛的用途。下列有关有机物的说法错误的是( )A、氯乙烷可以用来镇痛和局部麻醉 B、聚乙炔可用于制备导电高分子材料 C、苯甲酸钠可用作食品防腐剂 D、聚氯乙烯可用作食品包装材料3. 下列化学用语表述正确的是( )A、丙烷的空间填充模型: B、SO2的VSEPR模型:
B、SO2的VSEPR模型: C、基态24Cr原子的价层电子轨道表示式:
C、基态24Cr原子的价层电子轨道表示式: D、Cl-Cl的p-pσ键模型:
D、Cl-Cl的p-pσ键模型: 4. 不能正确表示其反应的离子方程式是( )A、铜在氨水中被腐蚀:2Cu+O2+8NH3·H2O=2[Cu(NH3)4]2++4OH- +6H2O B、泡沫灭火器的原理:Al3+ +3=Al(OH)3↓+3CO2↑ C、CuSO4溶液遇到闪锌矿(ZnS)转变为铜蓝:Cu2+(aq)+ZnS(s)CuS(s)+Zn2+(aq) D、利用覆铜板制作印刷电路板:Fe3++Cu=Cu2++Fe5. 下列说法不正确的是( )A、熔点:石墨>金刚石>氯化钠>钠 B、基态原子未成对电子数:B<C<O<N C、等离子体含有自由运动的带电粒子,具有良好的导电性 D、臭氧在四氯化碳中的溶解度高于在水中的溶解度6. NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,12 g金刚石含有4NA个共价键 B、pH=1的乙酸和盐酸混合溶液含0.1NA个H+ C、标准状态下,20 g ND3含有的质子数为10NA D、0.5mol异丁烯分子中,π键的数目为5.5NA7. 下列有机物命名正确的是( )A、
4. 不能正确表示其反应的离子方程式是( )A、铜在氨水中被腐蚀:2Cu+O2+8NH3·H2O=2[Cu(NH3)4]2++4OH- +6H2O B、泡沫灭火器的原理:Al3+ +3=Al(OH)3↓+3CO2↑ C、CuSO4溶液遇到闪锌矿(ZnS)转变为铜蓝:Cu2+(aq)+ZnS(s)CuS(s)+Zn2+(aq) D、利用覆铜板制作印刷电路板:Fe3++Cu=Cu2++Fe5. 下列说法不正确的是( )A、熔点:石墨>金刚石>氯化钠>钠 B、基态原子未成对电子数:B<C<O<N C、等离子体含有自由运动的带电粒子,具有良好的导电性 D、臭氧在四氯化碳中的溶解度高于在水中的溶解度6. NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,12 g金刚石含有4NA个共价键 B、pH=1的乙酸和盐酸混合溶液含0.1NA个H+ C、标准状态下,20 g ND3含有的质子数为10NA D、0.5mol异丁烯分子中,π键的数目为5.5NA7. 下列有机物命名正确的是( )A、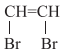 二溴乙烯
B、
二溴乙烯
B、 1,2,5-三甲苯
C、
1,2,5-三甲苯
C、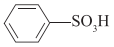 苯磺酸
D、
苯磺酸
D、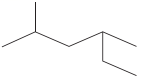 2-甲基-4 -乙基戊烷
8. 对伞花烃(a)常用作染料、医药、香料的中间体,a可转化为b(如图)。下列说法错误的是( )
2-甲基-4 -乙基戊烷
8. 对伞花烃(a)常用作染料、医药、香料的中间体,a可转化为b(如图)。下列说法错误的是( ) A、常温下对伞花烃呈液态且难溶于水 B、b物质的一氯代物有5种(不考虑立体异构) C、对伞花烃分子中最多有9个碳原子共平面 D、图中氢化反应既是加成反应也是还原反应9. H2O(l)、NH3(l)均可自耦电离:2H2O(l)OH-+ H3O+、2NH3(l)+。
A、常温下对伞花烃呈液态且难溶于水 B、b物质的一氯代物有5种(不考虑立体异构) C、对伞花烃分子中最多有9个碳原子共平面 D、图中氢化反应既是加成反应也是还原反应9. H2O(l)、NH3(l)均可自耦电离:2H2O(l)OH-+ H3O+、2NH3(l)+。下列反应与
 →CH3CH2OH+HBr原理不同的是( )A、CaC2+2H2O→Ca(OH)2+CH≡CH↑ B、SiCl4+8NH3(l)=Si(NH2)4 +4NH4Cl C、3Cl2 + 8NH3=6NH4Cl+N2 D、PCl3+3H2O=H3PO3+ 3HCl10. 2022年的诺贝尔化学奖成果“点击化学”,成功把药物分子的合成难度大大降低,为人类带来了伟大的效益。我国科学家在寻找“点击反应”的砌块过程中,发现了一种新的化合物,其结构简式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与Z是同一主族元素。下列说法正确的是.( )
→CH3CH2OH+HBr原理不同的是( )A、CaC2+2H2O→Ca(OH)2+CH≡CH↑ B、SiCl4+8NH3(l)=Si(NH2)4 +4NH4Cl C、3Cl2 + 8NH3=6NH4Cl+N2 D、PCl3+3H2O=H3PO3+ 3HCl10. 2022年的诺贝尔化学奖成果“点击化学”,成功把药物分子的合成难度大大降低,为人类带来了伟大的效益。我国科学家在寻找“点击反应”的砌块过程中,发现了一种新的化合物,其结构简式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与Z是同一主族元素。下列说法正确的是.( ) A、X、Y、Z第一电离能最大的为X B、X、Y、Z和W电负性最大的为W C、X、Z、W氧化物对应的水化物均为强酸 D、简单离子半径:W>Z>Y>X11. 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是( )A、石灰乳中存在沉淀溶解平衡 B、氯气与强碱反应时既是氧化剂又是还原剂 C、铜锌原电池工作时,正极和负极同时发生反应 D、Cl、Br、I的非金属性随其核外电子层数增多而减弱12. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
A、X、Y、Z第一电离能最大的为X B、X、Y、Z和W电负性最大的为W C、X、Z、W氧化物对应的水化物均为强酸 D、简单离子半径:W>Z>Y>X11. 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是( )A、石灰乳中存在沉淀溶解平衡 B、氯气与强碱反应时既是氧化剂又是还原剂 C、铜锌原电池工作时,正极和负极同时发生反应 D、Cl、Br、I的非金属性随其核外电子层数增多而减弱12. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )选项
性质差异
结构因素
A
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)
分子间作用力
B
熔点:AlF3(1 040℃)远高于AlCl3(178℃升华)
晶体类型
C
酸性: HCOOH(pKa=3.75)>CH3COOH(pKa=4.76)
甲基推电子效应
D
碱性:Mg(OH)2大于Al(OH)3
第一电离能
A、A B、B C、C D、D13. 完成下述实验,装置或试剂不正确的是( )



A.实验室收集乙烯
B.分离乙醇和乙酸
C.验证NH3易溶于水且溶液呈碱性
D.除去CO2中混有的少量HCl
A、A B、B C、C D、D14. 某晶体立方晶胞如图。已知图中微粒1的分数坐标是(0, , ),阿伏加德罗常数的值为NA。下列说法正确的是( )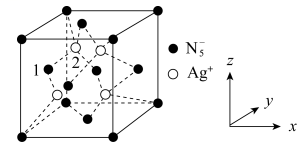 A、Ag+周围距离最近且相等的个数是6 B、微粒2的分数坐标是( , , ) C、已知银与铜位于同一族,银位于元素周期表的d区 D、若晶胞边长为apm,则相邻Ag+之间的最短距离为a pm15. 气态PH3的一种工业制法流程如图:
A、Ag+周围距离最近且相等的个数是6 B、微粒2的分数坐标是( , , ) C、已知银与铜位于同一族,银位于元素周期表的d区 D、若晶胞边长为apm,则相邻Ag+之间的最短距离为a pm15. 气态PH3的一种工业制法流程如图:
已知:①NA为阿伏加德罗常数的值;
②25℃时,次磷酸(H3PO2)的电离常数Ka=1.0×10-2。
下列说法错误的是( )
A、液态次磷酸分解反应为熵增过程 B、P4是非极性分子,键角为109°28' C、白磷与浓NaOH溶液反应生成11.2 L PH3(标准状况下)时,转移电子的数目为1.5 NA D、常温下,1 LpH=10的NaH2PO2溶液中由水电离出的c(OH-)=1.0×10-4 mol/L二、非选择题:本题共4大题,共55分。
-
16. FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等,实验室可用无水四氯化锡(SnCl4)制作FTO,制备SnCl4的装置如图所示。
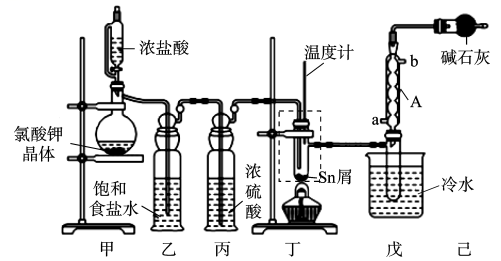
已知:①SnCl4熔点为-33 ℃,沸点为114.1 ℃,在潮湿空气中极易水解(水解生成SnO2·xH2O),且熔融Sn与Cl2反应生成SnCl4时放出大量的热。
②Sn熔点为232℃,沸点为2260℃;无水SnCl2熔点为246℃,沸点为652℃,Sn2+易被Fe2+、I2等氧化为Sn2+。
(1)、请写出甲中反应的离子方程式:。(2)、为了获得较纯的产品,当装置丁(虚线框内)(填仪器名称)中观察到现象后,再点燃酒精灯。(3)、Sn与Cl2的反应产物可能会有SnCl4和SnCl2 , 为加快反应速率并防止产品中带入SnCl2 , 除了通入过量Cl2外,应控制的最佳温度在____(填字母)范围内。A、652~2260℃ B、232 ~652℃ C、114~246℃ D、114~232℃(4)、若将制得的SnCl4少许溶于水中得到白色沉淀SnO2 , 其反应的化学方程式为。(5)、装置己的作用为。(6)、实际制备的产品中往往含有Sn2+ , 甲、乙两位同学分别设计了如下实验方案测定Sn2+的含量:①甲同学:准确称取a g产品于锥形瓶中,用蒸馏水溶解,用n mol/L 酸性高锰酸钾标准溶液滴定,滴定终点时消耗酸性高锰酸钾标准溶液xmL。由此可以计算产品中Sn2+的质量分数。乙同学认为甲同学的方案明显不合理,会导致测得的Sn2+的质量分数严重偏高,理由是。
②乙同学:用碘氧化法滴定分析产品中Sn2+的含量。准确称取a g产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b mol/L 碘标准溶液滴定,发生反应Sn2++I2=Sn4++2I-。滴定终点消耗碘标准溶液V mL,产品中Sn2+的质量分数为(用含a、b、V的代数式表示)。
17. 氨基乙酸铜被广泛应用于染料、涂料、塑料和电池等领域,其化学式为(H2N-CH2-COO)2Cu,结构如图所示。 (1)、该结构中C原子的杂化方式为。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态C原子,其价电子自旋磁量子数的代数和为。(3)、氨基乙酸铜可由碳酸铜、氨乙酸、乙二胺等制得,碳酸铜中的空间结构为 , 氨基(-NH2)的电子式为。(4)、C、N、O三种元素最简单氢化物的键角由大到小的顺序为(用分子式表示)。(5)、基态N原子电子占据最高能级的电子云在空间有个伸展方向。(6)、一价铜及其化合物能催化以“Huisgen叠氮化物—环加成反应”为代表的许多反应。如图所示为CuCl结构的一部分,其余结构中各微粒相对位置与该部分类似。以下描述中正确的是____(填字母)。
(1)、该结构中C原子的杂化方式为。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态C原子,其价电子自旋磁量子数的代数和为。(3)、氨基乙酸铜可由碳酸铜、氨乙酸、乙二胺等制得,碳酸铜中的空间结构为 , 氨基(-NH2)的电子式为。(4)、C、N、O三种元素最简单氢化物的键角由大到小的顺序为(用分子式表示)。(5)、基态N原子电子占据最高能级的电子云在空间有个伸展方向。(6)、一价铜及其化合物能催化以“Huisgen叠氮化物—环加成反应”为代表的许多反应。如图所示为CuCl结构的一部分,其余结构中各微粒相对位置与该部分类似。以下描述中正确的是____(填字母)。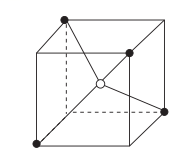 A、上图表示的是CuCl的晶胞 B、若图中正方体的边长为a pm,则CuCl的密度为g/cm3 C、在CuCl晶胞中,Cu+的配位数是418. 工业上利用废镍催化剂(主要成分为NiO,还含有一定量的ZnO、Fe2O3、SiO2、CaO等)制备一水合氢氧化氧镍(2NiOOH·H2O)的工艺流程如下:
A、上图表示的是CuCl的晶胞 B、若图中正方体的边长为a pm,则CuCl的密度为g/cm3 C、在CuCl晶胞中,Cu+的配位数是418. 工业上利用废镍催化剂(主要成分为NiO,还含有一定量的ZnO、Fe2O3、SiO2、CaO等)制备一水合氢氧化氧镍(2NiOOH·H2O)的工艺流程如下:
相关金属离子[c0(Mn+)=0.1 mol/L]开始形成氢氧化物沉淀的pH如下(当c(M+)≤10-5mol/L,可以认为Mn+沉淀完全):
金属离子
Ca2+
Zn2+
Ni2+
Fe3+
开始沉淀时的pH
10.6
7.6
7.1
1.5
回答下列问题:
(1)、写出一种能提高“酸浸”速率的措施: , 试剂X用于调节溶液的pH,为使Fe3+沉淀完全,需调控pH的范围是(保留一位小数)。(2)、废渣1的主要成分是 , “ 萃取”操作中用到的玻璃仪器有。(3)、基态Ni原子的价电子排布式为。(4)、“氧化”过程中加入的试剂Y是NaClO,写出加入NaClO反应生成一水合氢氧化氧镍(2NiOOH·H2O)的离子方程式:。(5)、已知工业上也可以用Ni(OH)2作为阳极、NaOH溶液为电解质溶液,通过电解氧化法制备NiOOH,其阳极的电极反应式为。19. 化合物M是一种具有茉莉花香味的无色油状液体,结构简式是 , 其合成路线如下(部分反应条件未注明):
, 其合成路线如下(部分反应条件未注明): (1)、G中所含官能团的名称为。(2)、B→C反应的试剂及条件为。(3)、有机物C的结构简式为。(4)、E→F反应的化学方程式为 , 反应类型为。(5)、若将A加入少量酸性高锰酸钾溶液中,振荡后可使其褪色,其原因是____(填字母)。A、A属于不饱和烃,可被酸性高锰酸钾溶液氧化 B、苯环受侧链影响,可被酸性高锰酸钾溶液氧化 C、侧链受苯环影响,可被酸性高锰酸钾溶液氧化 D、A催化高锰酸钾在酸性溶液中分解.(6)、在M的同分异构体中,同时满足下列条件的共有种(不考虑立体异构);
(1)、G中所含官能团的名称为。(2)、B→C反应的试剂及条件为。(3)、有机物C的结构简式为。(4)、E→F反应的化学方程式为 , 反应类型为。(5)、若将A加入少量酸性高锰酸钾溶液中,振荡后可使其褪色,其原因是____(填字母)。A、A属于不饱和烃,可被酸性高锰酸钾溶液氧化 B、苯环受侧链影响,可被酸性高锰酸钾溶液氧化 C、侧链受苯环影响,可被酸性高锰酸钾溶液氧化 D、A催化高锰酸钾在酸性溶液中分解.(6)、在M的同分异构体中,同时满足下列条件的共有种(不考虑立体异构);①含有苯环且苯环上只有两个取代基②能与NaHCO3溶液反应放出CO2
其中核磁共振氢谱显示为5组峰,且峰面积之比为3:2:2:2:1的同分异构体的结构简式为(任意写一种)。