湖南省邵阳市邵阳县第二高级中学2023-2024学年高二下学期期中考试化学试题
试卷更新日期:2024-04-30 类型:期中考试
一、选择题(本大题共14小题,每小题3分,共计42分。在每小题列出的四个选项中,只有一项是最符合题目要求的)
-
1. 纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A
B
C
D




银器用除锈剂见新
变形的金属香炉复原
古画水洗除尘
木器表面擦拭烫蜡
A、A B、B C、C D、D2. 下列反应中,属于取代反应的是( )A、CH2=CH2+HClCH3CH2Cl B、2CH3CH2OH+O22CH3CHO+2H2O C、CH3CHO+H2CH3CH2OH D、CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O3. 下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )A、在组装蒸馏装置时,温度计的水银球应伸入液面下 B、用96%的工业酒精制取无水乙醇,可采用直接蒸馏的方法 C、在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 D、在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤4. 下列化学用语表示正确的是( )A、乙醇的官能团电子式为: B、钠原子的基态核外电子排布可表示
C、乙烯的结构简式:CH2CH2
D、基态铜原子的价层电子排布图:
B、钠原子的基态核外电子排布可表示
C、乙烯的结构简式:CH2CH2
D、基态铜原子的价层电子排布图: 5. 为阿伏加德罗常数的值,下列说法正确的是( )A、的NaOH溶液中含有OH-的数目为 B、在溶液,阴离子的总数为 C、标准状况下,2.24L乙醇中碳氢键的数目为0.5NA D、标准状况下,28g乙烯与22.4L的甲烷所含氢原子数均为6. 下列有关Cu及其化合物的叙述正确的是( )
5. 为阿伏加德罗常数的值,下列说法正确的是( )A、的NaOH溶液中含有OH-的数目为 B、在溶液,阴离子的总数为 C、标准状况下,2.24L乙醇中碳氢键的数目为0.5NA D、标准状况下,28g乙烯与22.4L的甲烷所含氢原子数均为6. 下列有关Cu及其化合物的叙述正确的是( ) A、如图所示的Cu2O晶胞中Cu原子的配位数为2 B、FeCl3刻蚀Cu制印刷电路板,说明还原性Cu大于Fe C、Cu是第VIII族元素 D、除去Cu粉中混有CuO的方法是加入稀硝酸溶解,过滤、洗涤、干燥7. 下列反应过程中无配合物形成的是( )A、配制银氨溶液 B、向澄清石灰水中通入过量 C、向溶液中滴加过量氨水 D、向溶液中加入KSCN溶液8. 下列叙述正确的是( )A、Na、Mg、Al的第一电离能逐渐增大 B、N、O、F的电负性逐渐增大 C、根据物质的溶解性“相似相溶“原理,可以用酒精提取碘水中的碘 D、平面三角形分子一定是非极性分子9. 已知乙烯分子是平面结构,因此1,2-二氯乙烯可形成
A、如图所示的Cu2O晶胞中Cu原子的配位数为2 B、FeCl3刻蚀Cu制印刷电路板,说明还原性Cu大于Fe C、Cu是第VIII族元素 D、除去Cu粉中混有CuO的方法是加入稀硝酸溶解,过滤、洗涤、干燥7. 下列反应过程中无配合物形成的是( )A、配制银氨溶液 B、向澄清石灰水中通入过量 C、向溶液中滴加过量氨水 D、向溶液中加入KSCN溶液8. 下列叙述正确的是( )A、Na、Mg、Al的第一电离能逐渐增大 B、N、O、F的电负性逐渐增大 C、根据物质的溶解性“相似相溶“原理,可以用酒精提取碘水中的碘 D、平面三角形分子一定是非极性分子9. 已知乙烯分子是平面结构,因此1,2-二氯乙烯可形成 和
和 两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是( ) A、1-丁烯 B、2-甲基-1-丙烯 C、2-丁烯 D、1-丙烯10. 已知CH4的燃烧热为890.3 kJ·mol-1 , 下列化学反应表示正确的是( )A、铅蓄电池的正极反应:Pb-2e-+=PbSO4 B、电解饱和NaCl溶液:2Na++2Cl-2Na+Cl2↑ C、CH4燃烧:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H=-890.3 kJ·mol-1 D、一定条件下NO2与NH3的反应:6NO2+8NH37N2+12H2O11. 实验是化学的灵魂,是化学学科的重要特征之一。下列实验装置(部分夹持仪器未画出)不能达到实验目的的是
两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是( ) A、1-丁烯 B、2-甲基-1-丙烯 C、2-丁烯 D、1-丙烯10. 已知CH4的燃烧热为890.3 kJ·mol-1 , 下列化学反应表示正确的是( )A、铅蓄电池的正极反应:Pb-2e-+=PbSO4 B、电解饱和NaCl溶液:2Na++2Cl-2Na+Cl2↑ C、CH4燃烧:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H=-890.3 kJ·mol-1 D、一定条件下NO2与NH3的反应:6NO2+8NH37N2+12H2O11. 实验是化学的灵魂,是化学学科的重要特征之一。下列实验装置(部分夹持仪器未画出)不能达到实验目的的是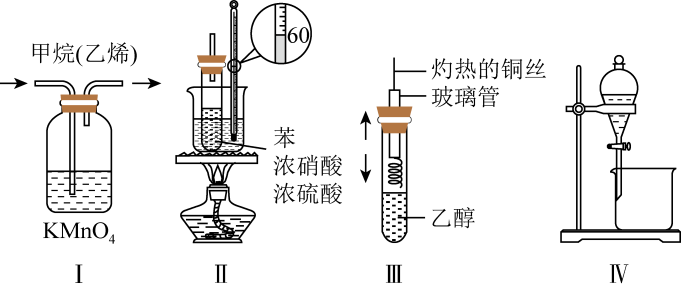 A、装置I:除去甲烷中的乙烯 B、装置II:制备硝基苯 C、装置III:乙醇氧化为乙醛 D、装置IV:分离苯和水12. 向某0.1mol/L的二元弱酸H2A溶液中逐渐加入NaOH溶液,溶液中各种含A微粒的百分含量(某含A微粒物质的量与所有含A微粒的物质的量的比值)与溶液的pH关系如图所示,下列叙述错误的是( )
A、装置I:除去甲烷中的乙烯 B、装置II:制备硝基苯 C、装置III:乙醇氧化为乙醛 D、装置IV:分离苯和水12. 向某0.1mol/L的二元弱酸H2A溶液中逐渐加入NaOH溶液,溶液中各种含A微粒的百分含量(某含A微粒物质的量与所有含A微粒的物质的量的比值)与溶液的pH关系如图所示,下列叙述错误的是( ) A、时, B、 C、时, D、时,13. 下列有机物的命名正确的是( )A、
A、时, B、 C、时, D、时,13. 下列有机物的命名正确的是( )A、 乙基丁烷
B、
乙基丁烷
B、 三甲苯
C、
三甲苯
C、 甲基丁烯
D、 聚乙烯
14. 某化合物立方晶胞如图所示,以原子1为原点的坐标系中Ca的分数坐标为。下列说法正确的是( )
甲基丁烯
D、 聚乙烯
14. 某化合物立方晶胞如图所示,以原子1为原点的坐标系中Ca的分数坐标为。下列说法正确的是( ) A、的配位数为6 B、原子2的坐标参数为 C、若以为顶点建立晶胞,则F位于棱心位置 D、若晶胞参数为a pm,晶胞密度为
A、的配位数为6 B、原子2的坐标参数为 C、若以为顶点建立晶胞,则F位于棱心位置 D、若晶胞参数为a pm,晶胞密度为二、解答题
-
15. 元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。
 (1)、 R原子的价层电子排布式;原子核外有种能量不同的电子。(2)、元素Fe在元素周期表中的位置是。Fe3+与Fe2+的离子半径大小关系为Fe3+Fe2+(填“大于”或“小于”)。(3)、M、D两种元素形成的化合物,其分子是(填“极性分子”或“非极性分子”),含有的化学键类型是(填“极性键”或“非极性键”)。D、Q的最高价氧化物形成的晶体相比,熔点较低的是(用化学式表示)。(4)、下列各组多电子原子的能级能量比较不正确的是____。
(1)、 R原子的价层电子排布式;原子核外有种能量不同的电子。(2)、元素Fe在元素周期表中的位置是。Fe3+与Fe2+的离子半径大小关系为Fe3+Fe2+(填“大于”或“小于”)。(3)、M、D两种元素形成的化合物,其分子是(填“极性分子”或“非极性分子”),含有的化学键类型是(填“极性键”或“非极性键”)。D、Q的最高价氧化物形成的晶体相比,熔点较低的是(用化学式表示)。(4)、下列各组多电子原子的能级能量比较不正确的是____。①2p=3p ②4s>2s ③4p>4f ④4d>3d
A、①④ B、①③ C、③④ D、②③16. 汽车等交通工具为出行、物流带来了舒适和方便。然而,燃油车排放的尾气中含有大量的氮氧化物。NOx的处理是环境科学研究的热点课题,利用活性炭对NO进行吸附。请回答下列问题:(1)、已知:①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=。
(2)、向容积为2 L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g) ΔH= -34.0 kJ·mol-1 , NO和N2的物质的量变化如表所示:物质的量/mol
T1/℃
T2/℃
0
5 min
10 min
15 min
20 min
25 min
30 min
NO
2.0
1.16
0.80
0.80
0.50
0.40
0.40
N2
0
0.42
0.60
0.60
0.75
0.80
0.80
① 0-5 min内,以N2表示该反应速率v(N2)= mol·L-1·min-1 , 第15 min后,将温度调整为T2 , 数据变化如上表所示,则T1 T2(填“>、< 或 =”)。
② 若为绝热恒容容器,下列表示该反应已达到平衡状态的是(填字母)。
A.混合气体的密度不再变化 B.温度不再变化
C.NO和的消耗速率之比为1:2 D.混合气体中c(NO) = c(N2)
(3)、恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间时NO的转化率随温度的变化如图所示:
图中a、b、c三点,达到平衡的点是。
(4)、现代技术处理尾气的反应原理是 NO(g) + NO2(g) + 2NH3(g)3H2O(g) + 2N2(g) ΔH < 0。450 ℃时,在2 L恒容密闭容器中充入1 mol NO、1 mol NO2和2 mol NH3 , 12 min时反应达到平衡,此时的转化率为50%,体系压强为P0MPa。450℃时该反应的平衡常数Kp = (用含P0的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。17. 溴苯在化工上主要用于溶剂、分析试剂和有机合成等方面。实验室可用如图装置制取溴苯。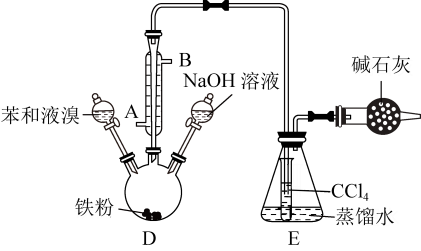 (1)、冷凝管的作用是导气、冷凝、回流,冷凝水从(填A或B)口进入冷凝管。(2)、实验时,先向三颈烧瓶中加入苯和液溴的混合物,写出苯和液溴发生反应的化学方程式。(3)、反应完毕后,再向三颈烧瓶中加入氢氧化钠溶液,待反应完全,从装置D中分离出溴苯和苯的混合物时需要用到的主要玻璃仪器是;将溴苯(沸点156℃)和苯(沸点80.1℃)分离的操作是。(4)、装置E中的小试管内盛放CCl4的作用是除去HBr气体中的以及挥发出的苯蒸气;向装置E的蒸馏水中滴加AgNO3溶液有淡黄色沉淀生成,此现象说明这种获得溴苯的反应属于(填有机反应类型)。(5)、装置中碱石灰的作用是。18. 某研究性学习小组为了解有机物A的性质,对A的结构进行了如下实验。(1)、实验一:通过质谱分析仪分析得知有机物A的质谱图如下:有机物A的相对分子质量为。
(1)、冷凝管的作用是导气、冷凝、回流,冷凝水从(填A或B)口进入冷凝管。(2)、实验时,先向三颈烧瓶中加入苯和液溴的混合物,写出苯和液溴发生反应的化学方程式。(3)、反应完毕后,再向三颈烧瓶中加入氢氧化钠溶液,待反应完全,从装置D中分离出溴苯和苯的混合物时需要用到的主要玻璃仪器是;将溴苯(沸点156℃)和苯(沸点80.1℃)分离的操作是。(4)、装置E中的小试管内盛放CCl4的作用是除去HBr气体中的以及挥发出的苯蒸气;向装置E的蒸馏水中滴加AgNO3溶液有淡黄色沉淀生成,此现象说明这种获得溴苯的反应属于(填有机反应类型)。(5)、装置中碱石灰的作用是。18. 某研究性学习小组为了解有机物A的性质,对A的结构进行了如下实验。(1)、实验一:通过质谱分析仪分析得知有机物A的质谱图如下:有机物A的相对分子质量为。 (2)、实验二:
(2)、实验二:
红外光谱分析:图1中不同吸收峰峰谷代表不同基团,图中有机物A中含氧官能团名称为和。
(3)、实验三:经核磁共振检测测得有机物A的谱图如图2所示,则有机物A的等效氢种类为。
 (4)、实验四:
(4)、实验四:取0.9g有机物A完全燃烧后,测得生成物为1.32g和0.54g , 有机物A的分子式为。
(5)、根据以上实验回答下列问题:有机物A的结构简式为。
(6)、有机物A在一定条件下可以发生的反应有(填字母)。a.消去反应b.取代反应c.氧化反应d.加聚反应
(7)、有机物A在浓硫酸作用下可生成多种产物。其中一种产物B的分子式为 , B能和溴的四氯化碳溶液发生加成反应,则B的结构简式为。