江西省赣州市十八县(市)24校2023-2024学年高二下学期期中考试化学试题
试卷更新日期:2024-04-30 类型:期中考试
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
-
1. 化学与生产、生活、科技具有紧密的联系。下列说法错误的是( )A、耐高温陶瓷材料氮化硅是一种无机非金属材料 B、石墨可用作核反应堆中的慢化剂,石墨属于混合型晶体 C、单晶硅可用于能源行业,单晶硅属于共价晶体 D、中国空间站“天宫”使用的碳纤维,是一种有机材料2. 化学用语是化学学科独特的语言,下列化学用语表示正确的是( )A、的模型:
 B、的电子式:
B、的电子式: C、基态氧原子的的电子云轮廓图:
C、基态氧原子的的电子云轮廓图: D、基态原子的价层电子轨道表示式:
D、基态原子的价层电子轨道表示式: 3. 下列中性原子的电子排布式中,表示激发态原子的是( )A、 B、 C、 D、4. 与足量溶液反应的化学方程式为(已知的结构式为
3. 下列中性原子的电子排布式中,表示激发态原子的是( )A、 B、 C、 D、4. 与足量溶液反应的化学方程式为(已知的结构式为 )。下列说法错误的是( ) A、是正盐 B、与甲烷的空间结构均为正四面体形,键角均为 C、当反应中转移电子时,生成 D、键角:5. 下列生活中的现象或事实与电化学保护法无关的是( )A、铜锣(铜锌合金)不易产生铜绿 B、铺设在隧道中的钢轨每隔一根轨枕系一块锌片 C、家用电热水器不锈钢内胆镶嵌镁棒 D、焊接钢材时,常用饱和溶液处理焊接点6. “证据推理与模型认知”是化学学科培养的核心素养之一、下列推论合理的是( )
)。下列说法错误的是( ) A、是正盐 B、与甲烷的空间结构均为正四面体形,键角均为 C、当反应中转移电子时,生成 D、键角:5. 下列生活中的现象或事实与电化学保护法无关的是( )A、铜锣(铜锌合金)不易产生铜绿 B、铺设在隧道中的钢轨每隔一根轨枕系一块锌片 C、家用电热水器不锈钢内胆镶嵌镁棒 D、焊接钢材时,常用饱和溶液处理焊接点6. “证据推理与模型认知”是化学学科培养的核心素养之一、下列推论合理的是( )选项
已知信息
推论
A
分子空间结构为V形
分子中两碳原子和氧原子不在同一直线上
B
电负性:
第一电离能:
C
沸点:
非金属性:
D
原子半径:
离子半径:
A、A B、B C、C D、D7. 下列说法中错误的是( )A、破损的晶体放入饱和溶液中会自动变成规则的多面体 B、电子云通常是用小黑点来表示电子出现的概率 C、某固体是否是晶体,可利用X射线衍射判断 D、处于最低能量状态的原子叫基态原子,过程中形成的是发射光谱8. 下列关于晶体冰、干冰、金刚石的说法正确的是( )A、熔点:金刚石>干冰>冰 B、上述三种晶体的晶体类型相同 C、金刚石熔化时,化学键一定会断裂 D、冰的沸点高于干冰,是因为水分子的键能大于干冰分子的键能9. 下列有关分子结构与性质的描述错误的是( )A、三氟乙酸的酸性大于三氯乙酸,三氯乙酸的酸性大于二氯乙酸 B、三种微粒的空间结构和模型都相同 C、都是由极性键构成的非极性分子 D、相同元素原子之间通过共用电子对形成化学键,一般键能越大,键长越短10. ①、②、③是铂的三种配合物,下列说法正确的是( )A、三种配合物中的化合价均为价 B、①中的配位数为6 C、②中为配体,提供空轨道 D、向含③的溶液中加入足量溶液,可得到沉淀11. 锂离子电池、锂离子电容器中一种非水电解液添加剂的结构如图所示。已知X、Y、Z、W为原子序数依次增大的短周期主族非金属元素,其中X、Y、Z处于同一周期且Y、Z为相邻元素,W与X位于不同周期且W的最外层电子数是其内层电子总数的一半。下列说法正确的是( )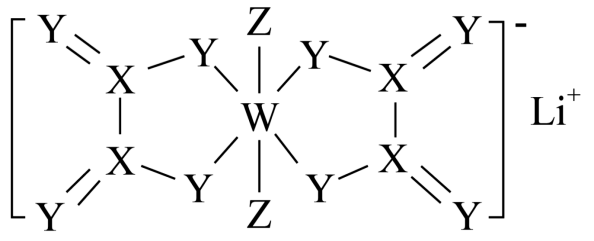 A、的中心原子杂化方式为 B、Z的最高价为价 C、X、W与Y形成的化合物均不止一种 D、第一电离能:12. 用X射线衍射测定,得到Fe的两种晶胞,其中一种晶胞的结构如图所示,设为阿伏加德罗常数的值。下列说法错误的是( )
A、的中心原子杂化方式为 B、Z的最高价为价 C、X、W与Y形成的化合物均不止一种 D、第一电离能:12. 用X射线衍射测定,得到Fe的两种晶胞,其中一种晶胞的结构如图所示,设为阿伏加德罗常数的值。下列说法错误的是( )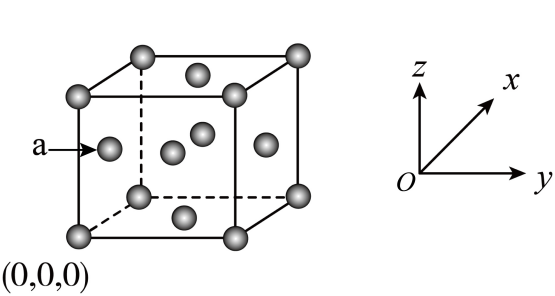 A、离子半径: B、a原子的参数坐标为 C、若晶体的密度为bg⋅cm , 则1个晶胞的体积为cm D、该晶胞的俯视投影图为
A、离子半径: B、a原子的参数坐标为 C、若晶体的密度为bg⋅cm , 则1个晶胞的体积为cm D、该晶胞的俯视投影图为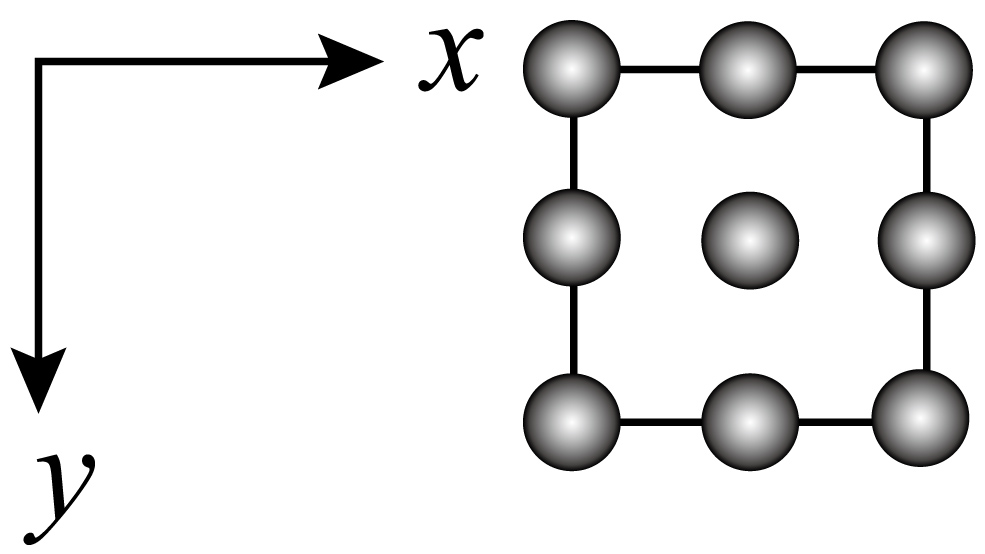 13. 常温下,向溶液中逐滴加入溶液,所得溶液的变化曲线如图所示。下列说法错误的是( )
13. 常温下,向溶液中逐滴加入溶液,所得溶液的变化曲线如图所示。下列说法错误的是( )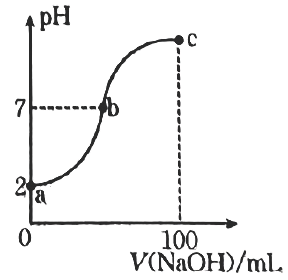 A、a点溶液中, B、b点溶液中, C、常温下, D、a、b、c三点溶液中,c点溶液中水的电离程度最小14. 某可充电锂电池总反应为 , 放电时工作原理刻图所示。下列说法错误的是( )
A、a点溶液中, B、b点溶液中, C、常温下, D、a、b、c三点溶液中,c点溶液中水的电离程度最小14. 某可充电锂电池总反应为 , 放电时工作原理刻图所示。下列说法错误的是( )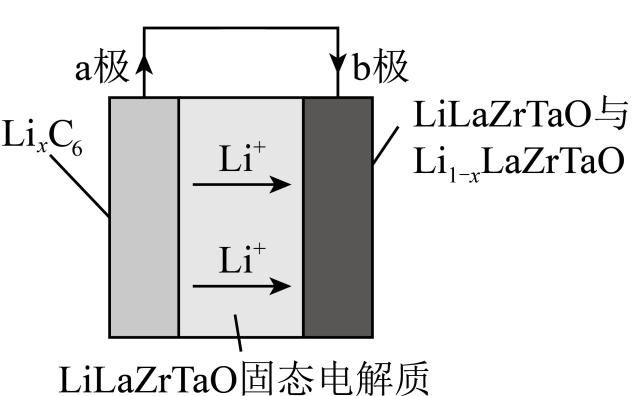 A、放电时,a极为负极,发生氧化反应 B、放电时,b极上的电极反应为 C、充电时,固态电解质中移向a极 D、充电时,若转移电子,b极质量减小
A、放电时,a极为负极,发生氧化反应 B、放电时,b极上的电极反应为 C、充电时,固态电解质中移向a极 D、充电时,若转移电子,b极质量减小二、非选择题:本题共4小题,共58分。
-
15. X、Y、Z、Q、W是元素周期表前四周期中常见的五种元素,其原子序数依次增大。基态X原子核外3个能级上有电子,且每个能级上的电子数相等;基态Y原子的s电子与P电子数目相同;Z是电负性最大的元素;基态Q原子的未成对电子数是同周期中最多的;W与Q同周期,W的一种核素的质量数为63,中子数为34。(1)、W的元素符号为 , X原子含有个运动状态不同的电子。(2)、的空间结构为 , 其中Y原子的杂化轨道类型是。(3)、Q的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。由Q(III)、、甲基丙烯酸根形成的配合物的结构为[Q2(CH2=C(CH3)-COO)2Cl4∙6H2O]∙2H2O
①甲基丙烯酸中杂化的碳原子与杂化的碳原子的个数之比为 , 甲基丙烯酸钠中含有的化学键类型有。
②过渡元素离子与水形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为或排布时,无颜色;为时,有颜色,如显粉红色。据此判断,(填“有”或“无”)颜色。
16. 广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 , 杂质为等元素的化合物,提取氧化锌的工艺流程如图。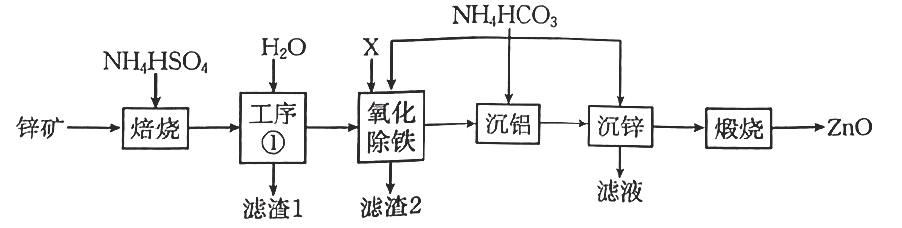
已知:①“焙烧”时金属元素生成硫酸盐。
②下,的的 , 的。
③当离子浓度时,可视为沉淀完全。
回答下列问题:
(1)、为了提高“焙烧”效率,可采取的措施为 , “滤渣1”的主要成分是、(填化学式)。(2)、若考虑环保因素,“氧化除铁”工序加入的X应选择____(填标号)最合适。A、 B、 C、 D、(3)、等浓度的①溶液 ②溶液 ③溶液的从小到大的顺序为(用标号表示)。(4)、室温时,“沉铝”过程发生反应的离子方程式为。用调节溶液的(保留一位小数),“沉铝”完全。(5)、“沉锌”工序中生成沉淀,写出发生反应的离子方程式:;“滤液”的主要成分为 , 经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:。17. 应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。(1)、已知反应:① ;②。
则③中的(用含的式子表示),(用含的式子表示),该反应中每消耗 , 此时转移的电子数为。
(2)、一定条件下用和合成。在恒容密闭容器中充入和 , 在催化剂作用下充分反应,平衡时混合物中的体积分数随温度变化的曲线如图所示: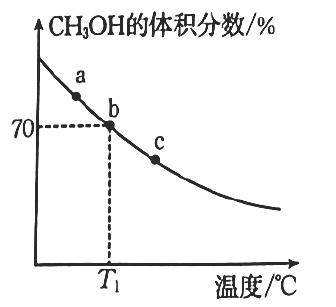
①下列有关反应的说法正确的是(填标号)。
A.该反应的反应物的键能总和小于生成物的键能总和
B.当混合气体的密度不再随时间改变时,该反应达到平衡
C.升高温度,有利于增大的平衡转化率
D.无论反应进行到何种程度,为某一定值
②平衡常数由大到小的顺序为。
③反应速率:(填“>”“<”或“=”)。
④ , b点的平衡常数。
18. 研究发现,氧化物负载的M氧化物纳米粒子和等元素纳米粒子催化剂在合成淀粉过程中有较高的催化活性。以和为主要原料人工合成淀粉涉及的部分反应如下:反应i:
反应ii:
(1)、在元素周期表中的位置为 , 基态原子核外电子占据的最高能级的原子轨道形状为。(2)、第一电离能: , 其原因是。(3)、反应ii中,中π键的形成方式为(填“肩并肩”或“头碰头”),的同素异形体为(填“极性”或“非极性”)分子。(4)、三者的沸点从高到低的顺序为 , 原因是。(5)、具有型结构(如图),的配位数为;已知的晶胞参数 , 则的半径为。