湖南省衡阳市四校联考2024年中考化学模拟试卷(3月份)
试卷更新日期:2024-04-25 类型:中考模拟
一、选择题(本题共45分,每小题3分。每小题只有一个正确答案)
-
1. 下列有关金属的说法正确的是( )A、金属都是银白色的 B、导电性最好的金属是铜 C、合金的硬度比相应的纯金属大 D、钢的含碳量比生铁的含碳量高2. 下列金属活动性由强至弱的顺序及元素名称、符号均正确的一组是( )A、钾K>钙Ca>镁Mg B、锌Zn>铁Fe>锡Xi C、铅Pb>铜Cu>贡Hg D、金Au>银Ag>铂pt3. 某同学探究金属单质的活泼性时发现:X、Y都能与稀硫酸反应放出氢气而Z不能;Y能在X的金属化合物溶液中置换出X.则它们的金属活动顺序为( )A、X>Y>(H)>Z B、Y>X>(H)>Z C、X>Z>(H)>Y D、Y>(H)>X>Z4. 已知金属R与硝酸铜溶液反应的化学方程式是R+Cu(NO3)2═Cu+R(NO3)2。则下列说法错误的是( )A、该反应属于置换反应 B、金属R的活泼性比Cu要强 C、该金属可能是铝 D、该金属可能是铁5. 实验室模拟炼铁的实验装置如图所示。下列有关说法错误的是( )
 A、实验中看到A中的实验现象为红棕色粉末变黑色 B、实验中看到B中的实验现象为澄清石灰水变浑浊 C、该实验设计装置C的目的是处理尾气 D、炼铁的反应原理是利用CO的氧化性6. 某不纯的铁中只含一种杂质,现取该样品5.6g与足量的稀盐酸反应,生成氢气0.19g,则铁中所含的杂质不可能是( )A、Zn B、Cu C、Ag D、Mg7. 往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是( )A、滤渣中一定有Ag和Cu B、滤渣中一定有Ag可能有Cu C、滤液中一定没有AgNO3 D、滤液中一定有Fe(NO3)2和Cu(NO3)28. 将少量下列物质分别放入水中,充分搅拌,不能形成溶液的是( )A、蔗糖 B、高锰酸钾 C、酒精 D、汽油9. 下列说法中错误的是( )A、溶液一定是无色的 B、用洗涤剂洗去衣服上的油渍是乳化作用的结果 C、气体的溶解度随温度升高而减小 D、氢氧化钠溶于水时放出热量,溶液温度升高10. 把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量( )A、800g B、880g C、980g D、98g11. 物质的分类非常重要,下列按酸、碱、盐的顺序排列的一组是( )A、H2SO4、Na2CO3、NaCl B、Ca(OH)2、HCl、Na2SO4 C、NaOH、H2CO3、NaCl D、H2SO4、NaOH、Na2CO312. 浓盐酸和浓硫酸都敞口放置在空气中,下列说法正确的是( )A、都产生白雾 B、都有刺激性气味 C、溶质的质量分数都减小 D、质量都减小13. 在进行“探究稀硫酸与氧化铜的反应”实验中,下列操作错误的是( )A、
A、实验中看到A中的实验现象为红棕色粉末变黑色 B、实验中看到B中的实验现象为澄清石灰水变浑浊 C、该实验设计装置C的目的是处理尾气 D、炼铁的反应原理是利用CO的氧化性6. 某不纯的铁中只含一种杂质,现取该样品5.6g与足量的稀盐酸反应,生成氢气0.19g,则铁中所含的杂质不可能是( )A、Zn B、Cu C、Ag D、Mg7. 往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是( )A、滤渣中一定有Ag和Cu B、滤渣中一定有Ag可能有Cu C、滤液中一定没有AgNO3 D、滤液中一定有Fe(NO3)2和Cu(NO3)28. 将少量下列物质分别放入水中,充分搅拌,不能形成溶液的是( )A、蔗糖 B、高锰酸钾 C、酒精 D、汽油9. 下列说法中错误的是( )A、溶液一定是无色的 B、用洗涤剂洗去衣服上的油渍是乳化作用的结果 C、气体的溶解度随温度升高而减小 D、氢氧化钠溶于水时放出热量,溶液温度升高10. 把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量( )A、800g B、880g C、980g D、98g11. 物质的分类非常重要,下列按酸、碱、盐的顺序排列的一组是( )A、H2SO4、Na2CO3、NaCl B、Ca(OH)2、HCl、Na2SO4 C、NaOH、H2CO3、NaCl D、H2SO4、NaOH、Na2CO312. 浓盐酸和浓硫酸都敞口放置在空气中,下列说法正确的是( )A、都产生白雾 B、都有刺激性气味 C、溶质的质量分数都减小 D、质量都减小13. 在进行“探究稀硫酸与氧化铜的反应”实验中,下列操作错误的是( )A、 稀释浓硫酸
B、
稀释浓硫酸
B、 取少量氧化铜
C、
取少量氧化铜
C、 倒少量稀硫酸
D、
倒少量稀硫酸
D、 加热
14. 下列说法正确的是( )A、中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 B、酸中都含氢元素,所以含氢元素的化合物都是酸 C、二氧化碳能与水反应生成碳酸,所以二氧化碳会造成酸雨 D、碱溶液能使酚酞试液变红色,使酚酞试液变红色的溶液一定显碱性15. 将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示,下列分析中正确的是( )
加热
14. 下列说法正确的是( )A、中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 B、酸中都含氢元素,所以含氢元素的化合物都是酸 C、二氧化碳能与水反应生成碳酸,所以二氧化碳会造成酸雨 D、碱溶液能使酚酞试液变红色,使酚酞试液变红色的溶液一定显碱性15. 将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示,下列分析中正确的是( ) A、CD段压强变化的主要原因是反应速率减小 B、A点盐酸浓度最低,C点盐酸浓度最大 C、D点反应结束 D、D、E两点处的气体压强比B大是因为容器内产生了氢气
A、CD段压强变化的主要原因是反应速率减小 B、A点盐酸浓度最低,C点盐酸浓度最大 C、D点反应结束 D、D、E两点处的气体压强比B大是因为容器内产生了氢气二、填空题(30分,16、17每空1分,18~21每空2分)
-
16. 现有三种物质A:铜 B:浓硫酸 C:熟石灰。请选择合适的物质的序号填空。(1)、可用作干燥剂的是 ;(2)、可用于制电线的是 ;(3)、可用于改良酸性土壤的是 。17. 用化学符号填空。(1)、人体中含量最高的金属元素 ;(2)、生石灰 ;(3)、酸有相似化学性质的原因是酸溶液中都含有 。18. 如图是A、B、C三种物质的溶解度曲线,据图回答:
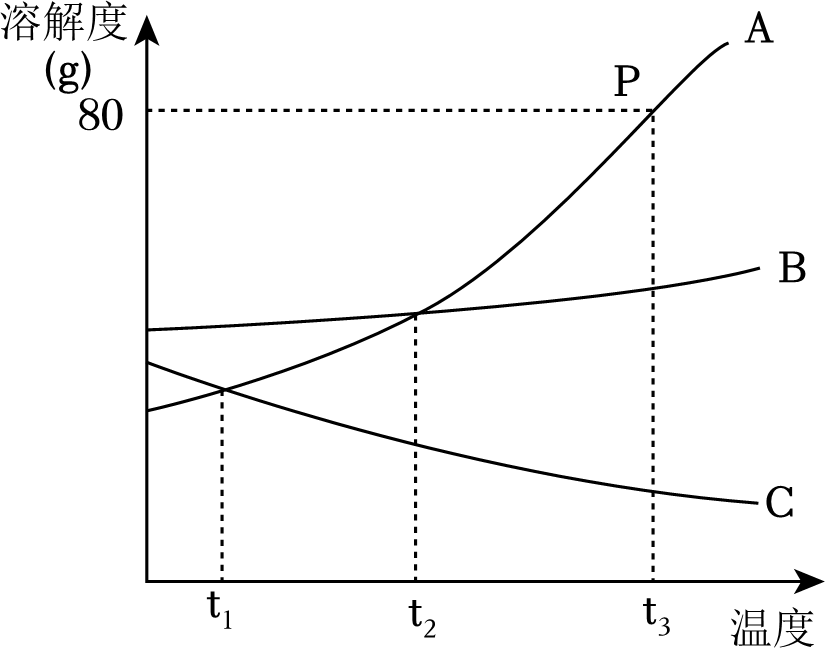 (1)、t3℃时,三种物质溶解度由大到小的顺序为 。(2)、t3℃时,50gA物质加入到50g水中,所得溶液的质量为 g。(3)、将t1℃时,A、B、C的饱和溶液升温到t3℃,三种溶液中溶质的质量分数由大到小的顺序为 。19. 为了证明NaOH能与CO2发生了反应,将两支充满CO2的相同试管分别倒扣在等体积的水和NaOH溶液中。
(1)、t3℃时,三种物质溶解度由大到小的顺序为 。(2)、t3℃时,50gA物质加入到50g水中,所得溶液的质量为 g。(3)、将t1℃时,A、B、C的饱和溶液升温到t3℃,三种溶液中溶质的质量分数由大到小的顺序为 。19. 为了证明NaOH能与CO2发生了反应,将两支充满CO2的相同试管分别倒扣在等体积的水和NaOH溶液中。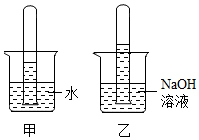 (1)、图甲中液面上升的原因是。(2)、乙中液面高于甲,说明NaOH与CO2发生了反应,该反应的化学方程式为 , 本实验中甲的作用是。20. 写出下列反应的化学方程式:(1)、工业上用赤铁矿炼铁 。(2)、用含Al(OH)3的药物治疗胃酸过多症 。(3)、用盐酸除铁锈 。21. 请回答下列问题。(1)、请写出一种防止铁生锈的措施 。(2)、铝具有很好的抗腐蚀性能,原因是 。(3)、请写出一种保护金属资源的途径 。
(1)、图甲中液面上升的原因是。(2)、乙中液面高于甲,说明NaOH与CO2发生了反应,该反应的化学方程式为 , 本实验中甲的作用是。20. 写出下列反应的化学方程式:(1)、工业上用赤铁矿炼铁 。(2)、用含Al(OH)3的药物治疗胃酸过多症 。(3)、用盐酸除铁锈 。21. 请回答下列问题。(1)、请写出一种防止铁生锈的措施 。(2)、铝具有很好的抗腐蚀性能,原因是 。(3)、请写出一种保护金属资源的途径 。三、实验探究题。(20分,每空2分)
-
22. 小明同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如图所示。

试回答下列问题:
(1)、写出图中有标号仪器的名称:b 。(2)、图示实验中有一处明显的错误是 。(3)、小刚同学要配制50g质量分数为16%的氯化钠溶液,应称取氯化钠的质量为 g。(4)、称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的氯化钠质量 (填“大于”或“小于”)配制溶液所需的质量。(5)、在量取水的体积时,小刚同学仰视读数,则所配制溶液中氯化钠的质量分数 。(填“偏大”、“偏小”或“不变”)23. 乙炔(C2H2)气体和氧气反应能产生高温火焰,常用于切割和焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时还生成一种白色固体。【提出问题】白色固体是什么物质?
(1)、【做出猜想】小明经过思考认为有以下几种可能:猜想一:CaO;猜想二:CaCO3;猜想三:。
(2)、【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是:。(3)、【进行实验】取少量白色固体于试管中,滴加稀盐酸,没有观察到 , 证明猜想二不成立。
(4)、取少量白色固体加入到水中,取上层清液,滴加 , 溶液变红色,证明猜想三成立。(5)、【实验结论】碳化钙与水反应的化学方程式:。
四、计算题(5分)
-
24. 某化学课外活动小组测定某工业废水中硫酸的含量。取该工业废水200g,向其中逐滴加入8%的氢氧化钠溶液,随着NaOH溶液的加入,溶液的pH的变化如图所示。(已知硫酸钠溶液为中性)。
 (1)、a点时加入NaOH溶液的质量为 g,其中NaOH的质量为 g。(2)、该工业废水中硫酸的质量分数。
(1)、a点时加入NaOH溶液的质量为 g,其中NaOH的质量为 g。(2)、该工业废水中硫酸的质量分数。