广东省阳江市江城区2024年中考一模化学试题
试卷更新日期:2024-04-25 类型:中考模拟
一、选择题;本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 每年的5月20日是全国学生营养日。下列营养素不能提供人体所需能量的是( )A、维生素 B、蛋白质 C、油脂 D、糖类2. 下列家具中所用原料属于有机合成材料的是( )A、实木桌椅 B、陶瓷地砖 C、金属门窗 D、塑料开关3. 化 学使世界变得绚丽多彩,科学家为此作出了巨大贡献。二百多年前,用定量的方法研 究了空气的成分的科学家是( )A、门捷列夫 B、道尔顿 C、拉瓦锡 D、张青莲4. 下列化学符号表示两个氢分子的是( )A、2H B、2H2 C、H2 D、2H2O5. 亚硝酸钠(化学式为NaNO2)外观形似食盐,误食会引起中毒。腌制食品在制作过程中会产生亚硝酸钠,所以我们应尽量少食用腌制食品。亚硝酸钠在物质的分类上属于( )A、氧化物 B、酸 C、盐 D、单质6. 某项目学习小组在实验室中练习配制一定溶质质量分数的氢氧化钠溶液。回答下面小题。(1)、氢氧化钠存放处应该张贴的标志是( )A、
 B、
B、 C、
C、 D、
D、 (2)、配制一定溶质质量分数的氢氧化钠溶液时,下列操作正确的是( )A、取NaOH 固体
(2)、配制一定溶质质量分数的氢氧化钠溶液时,下列操作正确的是( )A、取NaOH 固体 B、称量
B、称量 C、量取
C、量取 D、溶解
D、溶解 (3)、在化学实验中,从试剂瓶中取出的药品使用后有剩余,正确的处置方法是( )A、带出实验室 B、放回原试剂瓶 C、在实验室集中处理 D、投入通向下水道的水槽内7. 2023年5月17日,西昌卫星发射中心使用长征三号乙运载火箭成功发射第56颗北斗导航卫星,卫星上采用了铷(Rb)原子钟提供精准时间。如图所示是有关铷在元素周期表和核外电子排布的一些信息,下列有关说法不正确的是( )
(3)、在化学实验中,从试剂瓶中取出的药品使用后有剩余,正确的处置方法是( )A、带出实验室 B、放回原试剂瓶 C、在实验室集中处理 D、投入通向下水道的水槽内7. 2023年5月17日,西昌卫星发射中心使用长征三号乙运载火箭成功发射第56颗北斗导航卫星,卫星上采用了铷(Rb)原子钟提供精准时间。如图所示是有关铷在元素周期表和核外电子排布的一些信息,下列有关说法不正确的是( ) A、铷原子的核外电子分5层排布 B、氯化铷的符号为 C、x的值为18 D、铷的相对原子质量为85.478. 杭州亚运会开幕式首创零碳甲醇点燃亚运主火炬。一种将CO2高效转化为甲醇的微观示意图如图所示,下列说法正确的是( )
A、铷原子的核外电子分5层排布 B、氯化铷的符号为 C、x的值为18 D、铷的相对原子质量为85.478. 杭州亚运会开幕式首创零碳甲醇点燃亚运主火炬。一种将CO2高效转化为甲醇的微观示意图如图所示,下列说法正确的是( ) A、该化学反应前后,原子的种类、数目均不变 B、参与反应的CO2和H2的质量比为11:2 C、甲醇由原子构成,碳、氢、氧原子的个数比为1:3:1 D、在其他条件相同的情况下,使用催化剂可以提高甲醇的产量9. 下列生活应用或生产活动中,涉及的化学知识错误的是( )
A、该化学反应前后,原子的种类、数目均不变 B、参与反应的CO2和H2的质量比为11:2 C、甲醇由原子构成,碳、氢、氧原子的个数比为1:3:1 D、在其他条件相同的情况下,使用催化剂可以提高甲醇的产量9. 下列生活应用或生产活动中,涉及的化学知识错误的是( )选项
生活应用或生产活动
化学知识
A
金刚石可用于制作钻头
金刚石硬度大
B
制作糕点过程中使用小苏打
小苏打受热分解产生气体
C
煮水时,若水的硬度大,易结垢
硬水含有较多可溶性的钙、镁化合物
D
铝制品在生活中被广泛使用
铝的化学性质不活泼,难与空气中的氧气反应
A、A B、B C、C D、D10. 天然气是家庭常用燃料,其爆炸极限为5%~15%。下列说法错误的是( )A、天然气属于不可再生能源 B、泄漏时应关闭阀门且开窗通风 C、75%的天然气点燃会爆炸 D、天然气燃烧时放热11. 某化工废水中含有NaCl、Na2SO4、NaNO3 , 这三种盐的溶解度曲线如图所示。下列有关说法正确的是( ) A、a1℃时,NaNO3的饱和溶液中溶质的质量分数为80% B、a2℃时,NaCl和Na2SO4的饱和溶液中溶质的质量分数相等 C、与NaNO3相比,NaCl更适合通过饱和溶液降温结晶得到 D、40℃时,将Na2SO4的饱和溶液升温到60℃,其变为不饱和溶液12. 将铁粉和活性炭的混合物用食盐溶液润湿后,置于如图所示装置中,进行铁的锈蚀实验。 下列有关说法正确的是( )
A、a1℃时,NaNO3的饱和溶液中溶质的质量分数为80% B、a2℃时,NaCl和Na2SO4的饱和溶液中溶质的质量分数相等 C、与NaNO3相比,NaCl更适合通过饱和溶液降温结晶得到 D、40℃时,将Na2SO4的饱和溶液升温到60℃,其变为不饱和溶液12. 将铁粉和活性炭的混合物用食盐溶液润湿后,置于如图所示装置中,进行铁的锈蚀实验。 下列有关说法正确的是( )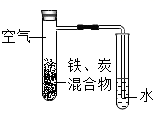 A、铁锈蚀后生成四氧化三铁 B、导管内的液面低于试管内的液面 C、活性炭的存在会加速铁的锈蚀 D、以水代替食盐溶液,铁不能发生锈蚀13. 下列实验设计不能达到实验目的的是( )
A、铁锈蚀后生成四氧化三铁 B、导管内的液面低于试管内的液面 C、活性炭的存在会加速铁的锈蚀 D、以水代替食盐溶液,铁不能发生锈蚀13. 下列实验设计不能达到实验目的的是( )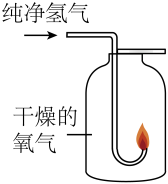
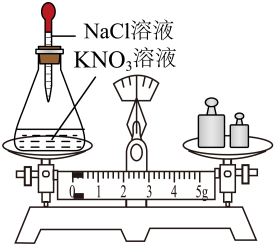
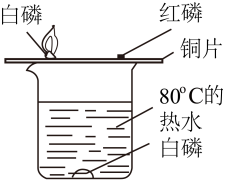

A.证明水是由氢、氧元素组成
B.验证质量守恒定律
C.探究可燃物燃烧的条件
D.鉴别氯化钾和氯化铵
A、A B、B C、C D、D二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
-
14. 2022年4月16日,在太空遨游半年的神舟十三号载人飞船在东风着陆场平安降落,太空“出差”的3名航天员安全顺利出舱,重回地球的怀抱。神舟凯旋之时拉开了中国空间站建造阶段的大幕。(1)、神舟十三号飞船的建造使用了大量高强钛合金,钛合金的硬度(填“大于”或“小于”)金属钛的硬度。(2)、空间站内有一套非常完善的“再生生保”系统,解决了生活用水和氧气问题。航天员的呼吸需要氧气,呼吸过程主要涉及的变化是(填“物理”或“化学”)变化。(3)、航天员在空间站吃饭时,同样可以闻到食物的香味,这是因为。(4)、在“天宫课堂”上,王亚平老师曾经用化学实验变出奥运五环,酸碱指示剂溴百里酚蓝的“蓝色”与甲基橙的“黄色”都利用了碳酸钠溶液呈(填“酸性”或“碱性”)的性质;利用碘化钾与碘酸钾反应,生成的碘单质遇淀粉变深蓝色作为“黑色”,碘酸钾(KIO3)中碘元素的化合价是。15. 【科普阅读】
随者工业生产的高速发展和人们生活水平的提高,排入大气中的CO2越来越多,导致温室效应增强。碳替代、碳减排、碳封存、碳循环是实现碳中和的4种主要途径。
科学家预测,到2050年,4种途径对全球碳中和的贡献率如图1所示。CO2的吸收是碳封存的首要环节,常选用NaOH溶液、氨水、一乙醇胺等作吸收剂。在研究膜吸收法吸收CO2时,研究人员通过实验比较了氨基乙酸钾、一乙醇胺、二乙醇胺3种吸收剂对烟气中CO2的脱除效果,其结果如图2所示。

依据上文,回答下列问题
(1)、排入大气中的CO2越来越多,导致效应增强。自然界吸收CO2的主要途径是作用。(2)、据预测,到2050年,对全球碳中和的贡献率最大的途径是。(3)、碳封存时常用NaOH溶液吸收二氧化碳,反应生成碳酸钠和水,该反应的化学方程式为。(4)、碳替代指用新能源代替化石能源,目前人类可开发和利用的新能源有,(写一种即可)。(5)、对比2图中三条曲线可知,当烟气流速相同时,对烟气中CO2的脱除效果最好的是。(6)、下列做法不符合低碳生活理念的是____(填字母)。A、乘坐公共交通工具出行,少开私家车 B、双面打印纸质资料 C、关注个人卫生,使用一次性筷子 D、节约用电,随手关灯16. 【基础实验与跨学科实践】在实验室和生活中选择合适的药品和装置可以制取氧气。
(1)、I.实验室用1图所示装置制取并收集氧气。
实验室用1图中装置A制取氧气的化学方程式为。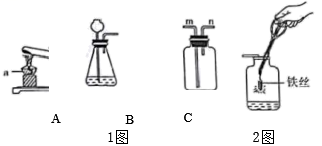 (2)、1图中仪器a的名称为。若在装置C中装满水,收集O2时,应从装置C的(填“m”或“n”)口处通入O2。(3)、用2图探究氧气的性质时,集气瓶中的现象是;集气瓶底部水的作用是。(4)、Ⅱ、兴趣小组的同学在跨学科实践课上对某款家用制氧机进行研究。该制氧机利用过碳酸钠(2Na2CO3•3H2O2)和二氧化锰同时加入水中制取氧气。过碳酸钠易溶于水,遇水分解为Na2CO3和H2O3 , 其工作原理如3图所示。
(2)、1图中仪器a的名称为。若在装置C中装满水,收集O2时,应从装置C的(填“m”或“n”)口处通入O2。(3)、用2图探究氧气的性质时,集气瓶中的现象是;集气瓶底部水的作用是。(4)、Ⅱ、兴趣小组的同学在跨学科实践课上对某款家用制氧机进行研究。该制氧机利用过碳酸钠(2Na2CO3•3H2O2)和二氧化锰同时加入水中制取氧气。过碳酸钠易溶于水,遇水分解为Na2CO3和H2O3 , 其工作原理如3图所示。
检验“过滤仓”中导出的气体是氧气的方法是。
(5)、兴趣小组的同学在实验室模拟用过碳酸钠、二氧化锰、水制取氧气,可选用1图中的(填字母)作为发生装置,为获得平稳气流,需对装置进行改进,改进的方法是。17. 某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
(1)、【学生板演】该反应的化学方程式。(2)、【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请你补上猜想四。
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是 , 理由是。
(3)、【实验探究】丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
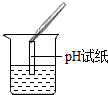
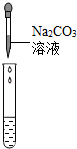
(4)、为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaCl2溶液,进行如下三个方案的探究。实验方案
测溶液的pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作

实验现象
试纸变色,对比比色卡,pH<7
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
(5)、【得出结论】通过探究,全班同学一致确定猜想二是正确的。【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定。同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了如下两处错误:
①实验操作中的错误是;
②实验方案中也有一个是错误的,错误的原因是。
18. 钢铁的应用非常广泛,炼铁技术的研究显得尤为重要。中国是最早发现和掌握炼铁技术的国家之一。 (1)、工业炼铁所用高炉的结构如图1所示,高炉中发生的过程如图2所示。
(1)、工业炼铁所用高炉的结构如图1所示,高炉中发生的过程如图2所示。①过程Ⅰ主要发生在高炉的(填“A”“B”或“C”)区域。
②过程Ⅱ发生反应的化学方程式为 , 该反应属于(填基本反应类型)反应。
③过程Ⅳ通入O2主要是为了降低生铁中元素的含量。
(2)、研究人员用氢气来炼铁。①以氢气代替CO还原Fc2O3 , 其主要目的是。
②560℃时,在氢气的作用下,可以发生如下转化: , 贝X的化学式为。
(3)、铁粉可用于一些金属的回收。向酸性含铜废水(主要含CuSO4 , 还有少量H2SO4)中加入过量铁粉,充分反应,过滤,将所得固体回收处理后得到产品。①该过程中参与反应的Cu元素的化合价(填“升高”“降低”或“不变”)。该过程还产生一种气体,其化学式为。
②将从过滤所得固体中回收金属Cu的实验方案补充完整:向过滤所得的Fe和Cu的混合物中加入 , 过滤,洗涤固体。干燥得到金属Cu。
19. 已知碳酸氢钙[Ca(HCO3)2]为白色固体,易溶于水,在加热时会分解成碳酸钙,反应原理为 , 碳酸钙在高温下会继续分解产生氧化钙。如图是32.4g碳酸氢钙固体加热过程中固体质量随温度的变化关系。 (1)、碳酸氢钙[Ca(HCO3)2]是一种离子化合物。其中的阴、阳离子的个数比为(2)、加热至℃时,碳酸氢钙完全分解成碳酸钙。(3)、利用图象数据计算生成氧化钙的质量。(写出计算过程)(4)、32.4g碳酸氢钙固体在整个加热过程中产生二氧化碳的总质量为g。
(1)、碳酸氢钙[Ca(HCO3)2]是一种离子化合物。其中的阴、阳离子的个数比为(2)、加热至℃时,碳酸氢钙完全分解成碳酸钙。(3)、利用图象数据计算生成氧化钙的质量。(写出计算过程)(4)、32.4g碳酸氢钙固体在整个加热过程中产生二氧化碳的总质量为g。