广东省揭阳市揭西县五校2024年中考第一次模拟考试化学试题
试卷更新日期:2024-04-25 类型:中考模拟
一、单选题:(本大题共15小题,每小题3分,共45分)
-
1. 下列关于化学史的认识错误的是( )A、化学的发展离不开人们的生产实践 B、原子论和分子学说的创立,奠定了近代化学的基础 C、绿色化学使化学生产向着环境友好的方向发展 D、火的发现和利用,奠定了近代化学的基础2. 下列物质的用途体现物质化学性质的是( )A、金刚石的硬度大——刻划玻璃 B、氢气密度小——填充探空气球 C、 具有还原性——冶炼金属 D、干冰有制冷作用——人工降雨3. 为验证人体呼出的气体中二氧化碳的含量比空气中多(下列四个选项的瓶内均装有澄清石灰水)。某同学规范操作先从左侧的玻璃管口吸气,看到澄清石灰水没有明显的变化,再从右侧的玻璃管口吹气,看到澄清石灰水变浑浊。下列装置符合题意的是( )A、
 B、
B、 C、
C、 D、
D、 4. 做实验一定要注意先后顺序,如果先后顺序错误,可能会导致实验失败,甚至产生严重后果。下列有关用高锰酸钾制取氧气的实验操作中,先后顺序正确的是( )A、检查装置的气密性时,先用手握紧试管的外壁,再把导管伸入水中 B、加热时,先对试管进行预热,再对准药品部位进行加热 C、先将高锰酸钾装入试管,再检查装置的气密性 D、实验完毕,先熄灭酒精灯,再把导管移出水面5. 下列物质中属于纯净物的是( )A、冰水共存物 B、高锰酸钾制氧气后的残留固体 C、清澈的泉水 D、净化后的空气6. 下面是四种粒子的结构示意图,下列分析错误的是( )
4. 做实验一定要注意先后顺序,如果先后顺序错误,可能会导致实验失败,甚至产生严重后果。下列有关用高锰酸钾制取氧气的实验操作中,先后顺序正确的是( )A、检查装置的气密性时,先用手握紧试管的外壁,再把导管伸入水中 B、加热时,先对试管进行预热,再对准药品部位进行加热 C、先将高锰酸钾装入试管,再检查装置的气密性 D、实验完毕,先熄灭酒精灯,再把导管移出水面5. 下列物质中属于纯净物的是( )A、冰水共存物 B、高锰酸钾制氧气后的残留固体 C、清澈的泉水 D、净化后的空气6. 下面是四种粒子的结构示意图,下列分析错误的是( )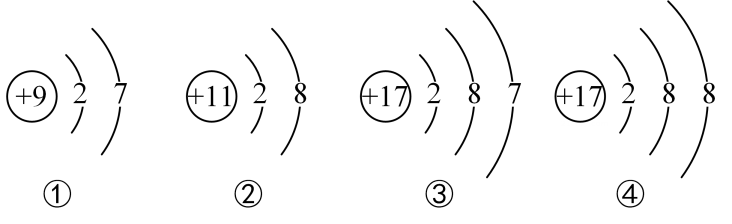 A、①③化学性质相似 B、②为阴离子 C、③④属于同一种元素 D、③为第三周期元素的原子7. 某同学用如图所示的装置进行电解水实验,并作了以下描述:
A、①③化学性质相似 B、②为阴离子 C、③④属于同一种元素 D、③为第三周期元素的原子7. 某同学用如图所示的装置进行电解水实验,并作了以下描述:
①向水中加入少量硫酸钠,可加快气体产生的速率;
②甲、乙两试管内收集到气体的体积比约为2:1;
③该实验证明水是由氢气和氧气组成的;
④乙试管内产生的气体能使带火星的木条复燃。 以上描述正确的是( )
A、①②③④ B、①②④ C、①②③ D、①③④8. 根据化合价由高到低的顺序,在HClO4、NaClO3、HClO、( )、NaCl的排列中,括号内应填入下列物质中的是( )A、Cl2 B、HClO3 C、Cl2O7 D、HCl9. 把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下。下列说法中正确的是()物质
a
b
c
d
反应前的质量(g)
6.4
3.2
4.0
2.8
反应后的质量(g)
5.2
x
7.2
2.8
A、x=2 B、d是催化剂 C、c不是化合物 D、反应前后原子的数目不变10. 漂白粉可用于自来水 杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。次氯酸钙可发生如下反应: , 则X的化学式为( ) A、Cl2 B、CO2 C、CaCl2 D、O211. 根据你所学的化学知识,你认为下列传闻缺乏科学依据的是( )A、对大棚蔬菜施加适量的二氧化碳,可以提高蔬菜的产量 B、有人声称,他发明了一种催化剂,只需要向水中添加少量该物质,就能把水变成油 C、冬天,某村有一户人家关门闭户在家烤火,结果导致全家中毒 D、某地有个神秘的“死亡谷”,野兔等低矮动物走进谷底常会窒息死亡12. 根据如图所示的实验现象分析,下列说法错误的是( )
杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。次氯酸钙可发生如下反应: , 则X的化学式为( ) A、Cl2 B、CO2 C、CaCl2 D、O211. 根据你所学的化学知识,你认为下列传闻缺乏科学依据的是( )A、对大棚蔬菜施加适量的二氧化碳,可以提高蔬菜的产量 B、有人声称,他发明了一种催化剂,只需要向水中添加少量该物质,就能把水变成油 C、冬天,某村有一户人家关门闭户在家烤火,结果导致全家中毒 D、某地有个神秘的“死亡谷”,野兔等低矮动物走进谷底常会窒息死亡12. 根据如图所示的实验现象分析,下列说法错误的是( )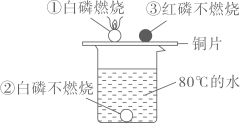 A、①②对比说明物质燃烧需要与空气接触 B、①中使温度达到白磷着火点是利用了铜的导热性 C、烧杯中的热水只起提高温度的作用 D、①③对比说明红磷着火点高于白磷13. 探究铁冶炼原理实验装置及炼铁高炉的图如下,请据图判断下列叙述中正确的是( )
A、①②对比说明物质燃烧需要与空气接触 B、①中使温度达到白磷着火点是利用了铜的导热性 C、烧杯中的热水只起提高温度的作用 D、①③对比说明红磷着火点高于白磷13. 探究铁冶炼原理实验装置及炼铁高炉的图如下,请据图判断下列叙述中正确的是( ) A、甲图中实验结束时为防止空气污染,应先停止通一氧化碳再熄灭酒精喷灯 B、乙图中高炉炼铁时中原料焦炭的作用是:只产生热量 C、乙图中生铁出口低于炉渣出口的原因是:生铁密度大于炉渣密度 D、用两图所示的方法得到的铁的成分完全相同14. 甲、乙两种物质的溶解度曲线如下图所示.下列说法正确的是( )
A、甲图中实验结束时为防止空气污染,应先停止通一氧化碳再熄灭酒精喷灯 B、乙图中高炉炼铁时中原料焦炭的作用是:只产生热量 C、乙图中生铁出口低于炉渣出口的原因是:生铁密度大于炉渣密度 D、用两图所示的方法得到的铁的成分完全相同14. 甲、乙两种物质的溶解度曲线如下图所示.下列说法正确的是( ) A、a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 B、甲和乙的溶解度相等 C、a1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液 D、a2℃时,在100g水中加入60g甲,形成不饱和溶液15. 某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关量的变化情况,得到图2和图3,下列说法不正确的是( )
A、a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 B、甲和乙的溶解度相等 C、a1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液 D、a2℃时,在100g水中加入60g甲,形成不饱和溶液15. 某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关量的变化情况,得到图2和图3,下列说法不正确的是( ) A、图2中b点所示溶液中的溶质是NaCl和NaOH B、将图2中d点所示溶液加热蒸干所得固体为纯净物 C、图2中c→d所示溶液中NaCl的质量不断增加 D、图3中e→f变化趋势可说明该反应是放热反应
A、图2中b点所示溶液中的溶质是NaCl和NaOH B、将图2中d点所示溶液加热蒸干所得固体为纯净物 C、图2中c→d所示溶液中NaCl的质量不断增加 D、图3中e→f变化趋势可说明该反应是放热反应二、非选择题:本大题共6小题,第16小题6分,第17小题9分,第18~21小题各10分,共55分。
-
16. 人类文明进步与材料发展关系十分密切。(1)、铁锅用于炒菜,主要利用铁具有的性质。(2)、铝合金被广泛用于航天工业、铝合金的硬度比纯铝的硬度。(3)、一种新型材料氮化铝(AlN)应用于新能源汽车。工业上用氧化铝、焦炭和氮气在高温条件下制得氮化铝,并生成一氧化碳,该反应的化学方程式是。(4)、世界最大跨径拱桥——广西天峨龙滩特大桥在建造过程中使用了大量钢材。在钢材表面刷漆可防锈,其原因是;建造过程中产生的废钢材可回收利用,其意义是(写一条即可)。17. 完成下列问题(1)、按要求从氢氧化钠、氢氧化铝、铜、氯化银、氧化镁、硫酸锌、氧气、氢气中选择合适的物质,将其化学式填写在下列横线中。
①一种供给呼吸的气体 ;
②一种易溶的碱 ;
③一种可溶的盐 。
(2)、我国力争年前实现碳达峰,年前实现碳中和,彰显大国的作为担当。①现阶段我国的能源结构仍以化石燃料为主,煤和石油中都含有硫元素,它们燃烧的废气中含有气体,在中硫元素与氧元素的质量比为 (最简整数比),属于 (填“氧化物”、“酸”、“有机化合物”之一)与水及氧气反应会导致硫酸型酸雨的形成,酸雨的 7(选填“<”、“=”、“>”之一)。当空气被严重污染时,可通过飞机喷洒碳酸钙的粉末,使空气中的含量明显降低。
②随着汽车用量的急剧增加。能源和环保问题日趋严峻,普及以太阳能、氢能等新型能源为动力的汽车迫在眉睫。氢气燃烧的热值比化石燃料(填“高”、“低”、“相同”之一),从“绿色化学”角度分析使用氢燃料汽车最突出的优点是 。
18. 结合图示实验装置,回答下列问题。 (1)、指出图中仪器的名称:;(2)、用高锰酸钾固体制取较为纯净的氧气,选用的发生装置是(填字母,下同),反应的化学方程式为 , 收集装置为。(3)、实验室制取二氧化碳,发生反应的化学方程式是 , 如需要E装置干燥二氧化碳气体,则E装置中应装 , 气体应从端通入(填“c”或“d”)。(4)、乙炔(C2H2)气体由碳化钙(块状固体)与水反应生成,且反应非常剧烈,乙炔难溶于水,密度比空气略小。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置组合是。19. 学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质稀盐酸、CaCO3粉末、Na2SO4溶液、BaCl2溶液之间的反应进行如图所示的实验探究。
(1)、指出图中仪器的名称:;(2)、用高锰酸钾固体制取较为纯净的氧气,选用的发生装置是(填字母,下同),反应的化学方程式为 , 收集装置为。(3)、实验室制取二氧化碳,发生反应的化学方程式是 , 如需要E装置干燥二氧化碳气体,则E装置中应装 , 气体应从端通入(填“c”或“d”)。(4)、乙炔(C2H2)气体由碳化钙(块状固体)与水反应生成,且反应非常剧烈,乙炔难溶于水,密度比空气略小。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置组合是。19. 学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质稀盐酸、CaCO3粉末、Na2SO4溶液、BaCl2溶液之间的反应进行如图所示的实验探究。 (1)、大家一致认为试管①中不发生复分解反应,理由。(2)、试管②中观察到的现象是。试管③中发生反应的化学方程式为。(3)、将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究。
(1)、大家一致认为试管①中不发生复分解反应,理由。(2)、试管②中观察到的现象是。试管③中发生反应的化学方程式为。(3)、将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究。【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:NaCl
猜想二:NaCl、Na2SO4
猜想三:
(4)、【设计实验】实验操作
实验现象
结论
步骤一:取少量滤液于试管中,加入适量BaCl2溶液
无明显现象
猜想不成立
步骤二:取少量滤液于试管中,加入适量稀硫酸
猜想三成立
(5)、【反思拓展】Ⅰ.探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑。
Ⅱ.依据复分解反应发生的条件,步骤二中除可用稀硫酸外,还可选用(填字母序号)也能达到同样的实验目的。
a.稀盐酸 b.氢氧化钠溶液 c.碳酸钠溶液
20. 侯德榜是我国制碱工业的先驱,他发明的“联合制碱法”大大提高了原料的利用率,促进了世界制碱技术的发展。制碱的主要流程(部分产物已省略)如图1所示。
回答下列问题:
(1)、操作Ⅰ的名称是。(2)、氯化铵属于化学肥料中的肥。(3)、写出反应②的化学方程式:。(4)、上述已知生产流程中,可循环使用的物质是。(5)、氯化铵和氯化钠的溶解度曲线如图2所示,若氯化铵固体中混有少量的氯化钠,可用方法提纯氯化铵。21. 实验室常用溶质质量分数为10%的过氧化氢溶液制取氧气。(1)、用如图所示的整瓶溶液配制10%的过氧化氢溶液,需加水g。 (2)、配制过程中发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是。(3)、取 35 g该瓶溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如表(不考虑水蒸气逸出)
(2)、配制过程中发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是。(3)、取 35 g该瓶溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如表(不考虑水蒸气逸出)反应时间/min
0
2
4
6
锥形瓶+瓶内物质的总质量/g
340.00
335.64
335.20
335.20
①反应生成氧气的总质量为 g。
②计算该瓶过氧化氢溶液的溶质质量分数。(结果精确到0.1%)