广东省2024年高考二模考试化学试题
试卷更新日期:2024-04-24 类型:高考模拟
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 广东各博物馆馆藏文物丰富。下列文物的主要材料不属于无机非金属的是( )


A.陶屋
B.白玉镂雕


C.龙耳锡底铜簋
D.广彩人物瓷盖盅
A、A B、B C、C D、D2. 我国新能源汽车发展迅速。下列有关新能源汽车的说法不正确的是( )A、锂离子电池充电时电能转化为化学能 B、电机所用的铷铁硼永磁材料属于金属晶体 C、封装电池所用的胶黏剂环氧树脂属于有机高分子材料 D、锂离子电池正极材料中的铁、钴、镍元素均为第Ⅷ族元素3. 利用反应可检验氯气管道是否泄漏。下列说法不正确的是( )A、的球棍模型为 B、与互为同位素
C、分子中含有非极性共价键
D、的电子式为
B、与互为同位素
C、分子中含有非极性共价键
D、的电子式为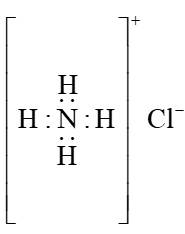 4. 实验室制备并检验其性质,下列装置不能达到实验目的的是( )
4. 实验室制备并检验其性质,下列装置不能达到实验目的的是( )
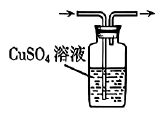
A.生成气体
B.净化气体

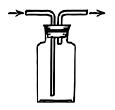
C.检验性质
D.收集气体
A、A B、B C、C D、D5. 化学创造美好生活。下列应用实例与所述的化学知识没有关联的是( )选项
应用实例
化学知识
A
利用聚苯乙烯制作泡沫包装材料
聚苯乙烯燃烧生成和
B
用作潜水艇中的供氧剂
与或反应生成
C
将液态植物油制成人造奶油
液态植物油能与发生加成反应
D
从海带灰中提取碘单质
海带灰中的可被氧化
A、A B、B C、C D、D6. 诺氟沙星是一种常见的抗菌药物,其结构如图所示。关于该化合物,下列说法正确的是( )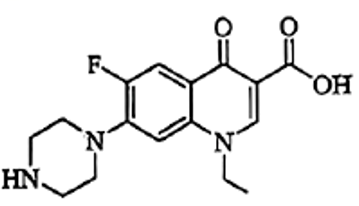 A、属于芳香烃 B、能与盐酸发生反应 C、可以发生酯化反应和消去反应 D、1mol该化合物可与6mol 发生加成反应7. 一种基于原电池原理的氧气传感器可用于测定样气中氧气的含量,其装置如图所示。下列说法正确的是( )
A、属于芳香烃 B、能与盐酸发生反应 C、可以发生酯化反应和消去反应 D、1mol该化合物可与6mol 发生加成反应7. 一种基于原电池原理的氧气传感器可用于测定样气中氧气的含量,其装置如图所示。下列说法正确的是( )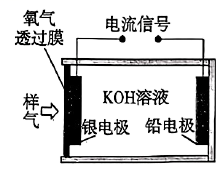 A、铅电极为正极 B、银电极上发生的反应为 C、电子由铅电极经过KOH溶液流向银电极 D、工作过程中,传感器的质量不变8. 下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是( )
A、铅电极为正极 B、银电极上发生的反应为 C、电子由铅电极经过KOH溶液流向银电极 D、工作过程中,传感器的质量不变8. 下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
淀粉水解产生果糖
米饭在口腔中越嚼越甜
B
受热易分解
加热可除去中的
C
Zn的金属性比Fe强
在钢制船壳上镶嵌锌块能减缓船体的腐蚀
D
的熔点比低
工业上电解熔融冶炼铝
A、A B、B C、C D、D9. 宏观辨识与微观探析是化学学科核心素养之一,下列离子方程式书写正确的是( )A、氯水久置颜色逐渐褪去: B、利用氯气再生铜电路板刻蚀液: C、溶液与足量的NaOH溶液混合: D、使酸性高锰酸钾溶液褪色:10. 硫代硫酸钠()在酸性环境中易发生歧化反应:。设为阿伏加德罗常数的值,下列说法正确的是( )A、18g 中含有质子的数目为 B、每生成32g S,转移电子的数目为 C、1mol 固体中含有离子的数目为 D、常温常压下,22.4L 中含有键的数目为11. 下列猜想对应的实验方案以及验证猜想成立的现象均正确的是( )选项
猜想
实验方案
验证猜想成立的现象
A
苯酚能与溶液反应
向苯酚浊液中加入适量固体
苯酚浊液变澄清
B
某溶液中一定含有
取少量该溶液,先滴加少量溶液,再滴加足量稀盐酸
产生白色沉淀且沉淀不溶于稀盐酸
C
加热条件下能与反应
将灼热的铜丝插入无水乙醇中
铜丝由红色变成黑色
D
浓具有漂白性
向滴有酚酞的NaOH溶液中加入浓
溶液红色褪去
A、A B、B C、C D、D12. 一定条件下,在恒容密闭容器中发生分解反应: , 随时间的变化如图所示。已知时反应达到平衡,时改变某单一条件(浓度、温度或催化剂等),下列说法不正确的是( ) A、由0到 , 的浓度不断增大 B、由到 , C、时,可能向容器中通入了 D、平衡常数可能小于13. 安息香酸(HR)是最简单的一元芳香酸,其钠盐(用NaR表示)的水溶液呈碱性。已知常温下,。下列说法正确的是( )A、常温下, HR水溶液的 B、向NaR水溶液中加水稀释,溶液的pH升高 C、NaR水溶液中, D、常温下,NaR溶液的碱性比同浓度的溶液弱14. 一定条件下,与反应合成的反应历程如图所示。已知其他条件不变时,反应物中的元素被质量数更大的同位素替换时,反应速率会变慢。下列说法正确的是( )
A、由0到 , 的浓度不断增大 B、由到 , C、时,可能向容器中通入了 D、平衡常数可能小于13. 安息香酸(HR)是最简单的一元芳香酸,其钠盐(用NaR表示)的水溶液呈碱性。已知常温下,。下列说法正确的是( )A、常温下, HR水溶液的 B、向NaR水溶液中加水稀释,溶液的pH升高 C、NaR水溶液中, D、常温下,NaR溶液的碱性比同浓度的溶液弱14. 一定条件下,与反应合成的反应历程如图所示。已知其他条件不变时,反应物中的元素被质量数更大的同位素替换时,反应速率会变慢。下列说法正确的是( )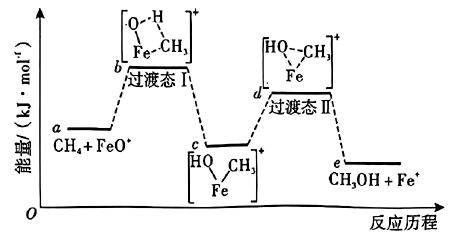
说明:过渡态中“--”表示化学键未完全断裂或形成。
A、反应历程中的两个反应均涉及氢原子的成键 B、相同条件下,与发生上述反应,则其过渡态Ⅰ的能量比b高 C、该反应的 D、与发生上述反应,只能获得1种相对分子质量的有机产物15. 是一种分析试剂,所含的5种元素在前四周期均有分布,基态的d轨道半充满,基态M原子价层电子排布式为 , E和M位于同一主族,X原子比E原子少一个电子。下列说法正确的是( )A、第一电离能: B、单质的沸点: C、Z的单质能与发生置换反应 D、和的VSEPR模型名称相同16. 一种金属钠电极配合运用钠离子及氯离子交换膜设计的氧化还原液流装置能够实现海水的淡化,其工作原理如图所示。下列说法正确的是( ) A、a为电源负极 B、N为氯离子交换膜,M为钠离子交换膜 C、充电时,总反应式为 D、放电时,每转移2mol电子,理论上Ⅱ池溶液质量增加117g
A、a为电源负极 B、N为氯离子交换膜,M为钠离子交换膜 C、充电时,总反应式为 D、放电时,每转移2mol电子,理论上Ⅱ池溶液质量增加117g二、非选择题:本题共4小题,共56分。
-
17. 在生产和生活中用途广泛。(1)、Ⅰ.溶液的配制及浓度的标定
溶液的配制①配制100mL一定浓度的溶液需用到的仪器有(填字母)。

②配制溶液时,需要将固体溶解在浓盐酸中,原因为。
(2)、溶液浓度的标定量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗标准溶液的体积为20.00mL,已知: , 则该溶液的浓度为。
(3)、Ⅱ.与反应的探究预测现象1:向溶液中加入溶液,溶液由黄色变为浅绿色。作出该预测的原因为(用离子方程式表示)。
预测现象2:向溶液中加入溶液,生成红褐色沉淀。
(4)、实验验证:小组同学设计以下实验探究溶液中浓度相同时的加入量对反应的影响,其中溶液为Ⅰ中所配溶液,溶液浓度为。静置6小时观察现象,测定反应后溶液的pH,并记录数据:序号
ⅰ
ⅱ
ⅲ
ⅳ
ⅴ
ⅵ
ⅶ
2.0
2.0
2.0
2.0
2.0
2.0
20
0
1.0
2.0
5.0
a
20.0
26.0
38.0
37.0
36.0
33.0
23.0
18.0
12.0
现象
溶液接近无色透明
出现褐色沉淀
pH
1.7
1.7
1.7
1.8
2.8
5.4
6.2
①请补充表格中的数据:a=。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是。
③实验ⅵ和ⅶ的实验现象说明溶液中的水解与的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:。
④甲同学认为实验ⅵ和ⅶ中,与除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(填实验操作与现象),则说明猜想成立。
(5)、请举出一种水解反应在生产或生活中的应用:。18. 锗是一种战略性金属,广泛应用于光学及电子工业领域。一种用锌浸渣(主要含、 , 另含少量ZnS、以及)提取Ge和的工艺流程如下: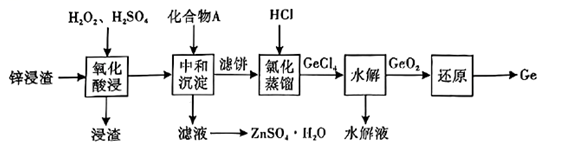
已知:①锗在硫酸中的存在形式:pH≤2.0时主要为 , 时主要为。
②常温下, , 。
请回答下列问题:
(1)、Ge是第四周期第ⅣA族元素,其基态原子的价层电子排布式为。(2)、“氧化酸浸”工序中,溶液 , 浸渣的主要成分为、S和(填化学式);被双氧水氧化的离子方程式为。(3)、“中和沉淀”工序中,所加化合物A为(填一种物质的化学式);调节溶液 , Ge和Fe共沉淀,此时滤液中。(4)、①在水溶液中的溶解度曲线如图所示,则从滤液中回收的操作为蒸发浓缩、、洗涤、干燥。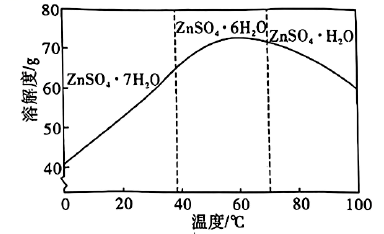
②用惰性电极电解溶液可制取金属锌,电解后的溶液可在上述流程中工序循环使用。
(5)、“水解”工序中,水解生成的化学方程式为;的沸点(1200℃)远高于的沸点(84℃),其原因为。(6)、是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为(填“体心”“面心”或“顶角”);晶体中一个Cs周围与其距离最近的Br的个数为。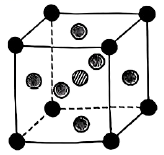 19. 含硫化合物在能源、材料及环境等工业领域均有广泛的应用。(1)、Ⅰ.工业废气分解可制取。
19. 含硫化合物在能源、材料及环境等工业领域均有广泛的应用。(1)、Ⅰ.工业废气分解可制取。
已知热化学方程式:ⅰ.
ⅱ.
ⅲ.
热分解反应的(用含、、的式子表示)。
(2)、一定温度下,2mol 在体积为VL的恒容密闭容器中发生上述分解反应,ts时的产率为40%,则0~ts内的平均分解速率为;充分分解达到平衡时,容器中和的分压相等,则该温度下的平衡常数。(3)、Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中与发生第一、二步络合的反应如下:ⅳ.
ⅴ.
根据以上络合反应,下列说法正确的有____(填字母)。
A、加水稀释后,溶液中离子的总数减少 B、加入少量固体,溶液中含铬微粒总数不变 C、反应的平衡常数 D、溶液中减小,与浓度的比值减小(4)、常温下,某研究小组配制了起始浓度、不同的系列溶液,测得平衡时、、的浓度(含铬微粒)随的变化曲线如图所示,平衡后其他含铬微粒(3≤x≤6,图中未画出)总浓度为amol/L。
①时,图中含铬微粒按浓度由大到小的顺序为;A点时,溶液中的平衡浓度为(列出计算式即可)。
②在某电镀工艺中,的浓度需要在以上,结合计算判断C点所对应的溶液能否用于该电镀工艺(写出计算过程)。
20. 利用生物基原料合成高分子化合物具有广阔的发展前景。一种利用生物基原料ⅳ合成高分子化合物ⅷ的路线如图所示: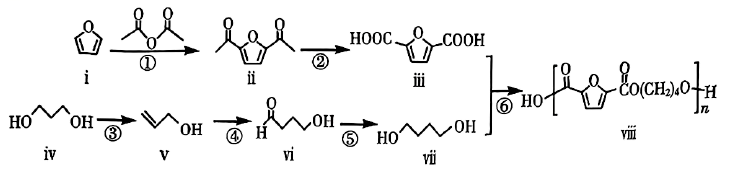 (1)、化合物ⅱ的分子式为 , 化合物ⅳ的名称。(2)、芳香化合物W是化合物ⅱ的同分异构体。W能与碳酸氢钠反应,其核磁共振氢谱显示有四种不同化学环境的氢,且峰面积之比为3∶2∶2∶1,写出一种符合条件的W的结构简式:。(3)、反应④可表示为 , 其中M、N为两种常见的气体,则M、N的化学式分别为。(4)、根据化合物ⅵ的结构特征,分析预测其可能的化学性质,完成下表。
(1)、化合物ⅱ的分子式为 , 化合物ⅳ的名称。(2)、芳香化合物W是化合物ⅱ的同分异构体。W能与碳酸氢钠反应,其核磁共振氢谱显示有四种不同化学环境的氢,且峰面积之比为3∶2∶2∶1,写出一种符合条件的W的结构简式:。(3)、反应④可表示为 , 其中M、N为两种常见的气体,则M、N的化学式分别为。(4)、根据化合物ⅵ的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
取代反应
b
银氨溶液,加热
(5)、下列关于反应⑥的说法中不正确的有____(填字母)。A、另外一种产物分子的空间结构为Ⅴ形 B、反应过程中,有双键和单键的形成 C、化合物ⅲ中碳原子均为杂化,化合物ⅶ 中碳原子均为杂化 D、化合物ⅷ 中存在手性碳原子(6)、以乙烯为有机含碳原料,利用上述流程中反应④的原理,合成化合物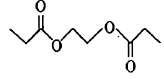 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:(a)利用反应④的原理得到的产物的结构简式为。
(b)相关步骤涉及卤代烃的水解反应,其化学方程式为(注明反应的条件)。