广东省江门市等5地2024年高考一模化学试题
试卷更新日期:2024-04-19 类型:高考模拟
一、选择题:本题共16小题,共44分。第1-10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 中华文化源远流长。下列文物主要由金属材料制成的是( )
文物




选项
A.西周五祀卫鼎
B.唐三彩陶罐
C.东周漆木尊
D.汉代玉璧
A、A B、B C、C D、D2. 近年来我国科技在各个领域都有重大进展。下列说法正确的是( )A、“天和”核心舱太阳能电池翼使用砷化镓器件,砷是s区元素 B、用转基因蚕丝合成高强度、高韧性“蜘蛛丝”,蚕丝的主要成分为纤维素 C、用磷酸钠钡钴盐[Na2BaCo(PO4)2]实现零下273.056℃制冷,磷酸钠钡钴盐为离子晶体 D、在催化剂作用下用煤炭生产烯烃等液体能源,煤炭属于可再生能源3. 衣食住行皆化学。下列说法不正确的是( )A、衣服面料中的聚酯纤维、棉、麻均属于有机高分子 B、制作豆腐时煮沸豆浆的过程中蛋白质发生了盐析 C、建筑材料熟石灰中含有离子键和共价键 D、新能源汽车使用锂离子电池供电时化学能转化为电能4. 用碳酸钠标定盐酸,实验步骤为①研细Na2CO3、②加热Na2CO3 , 至质量不变、③冷却、④称量、⑤溶解、⑥用待测盐酸滴定。下列实验步骤所对应的操作正确的是( )A、步骤②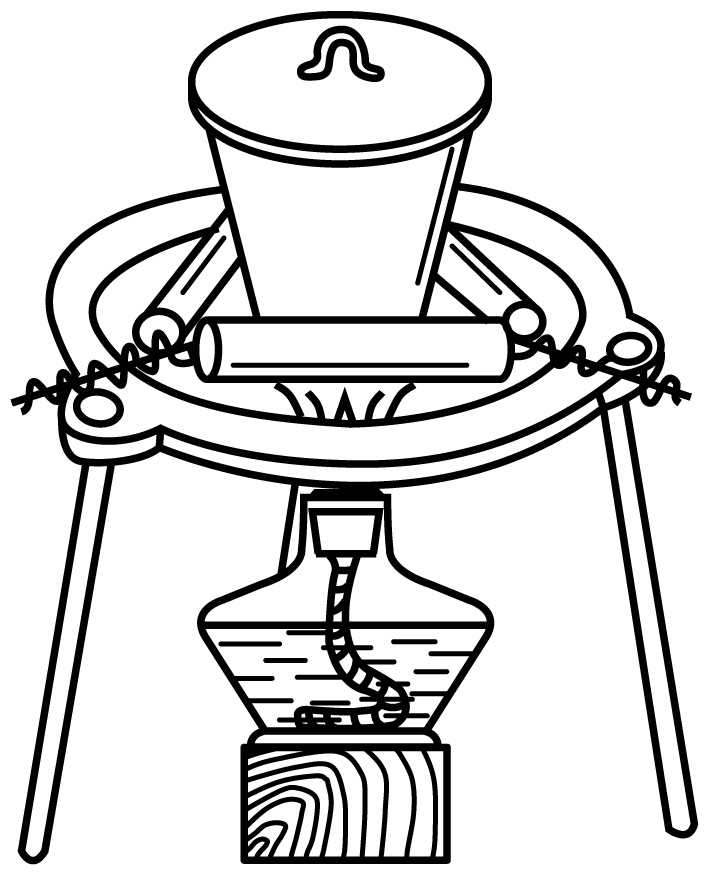 B、步骤④
B、步骤④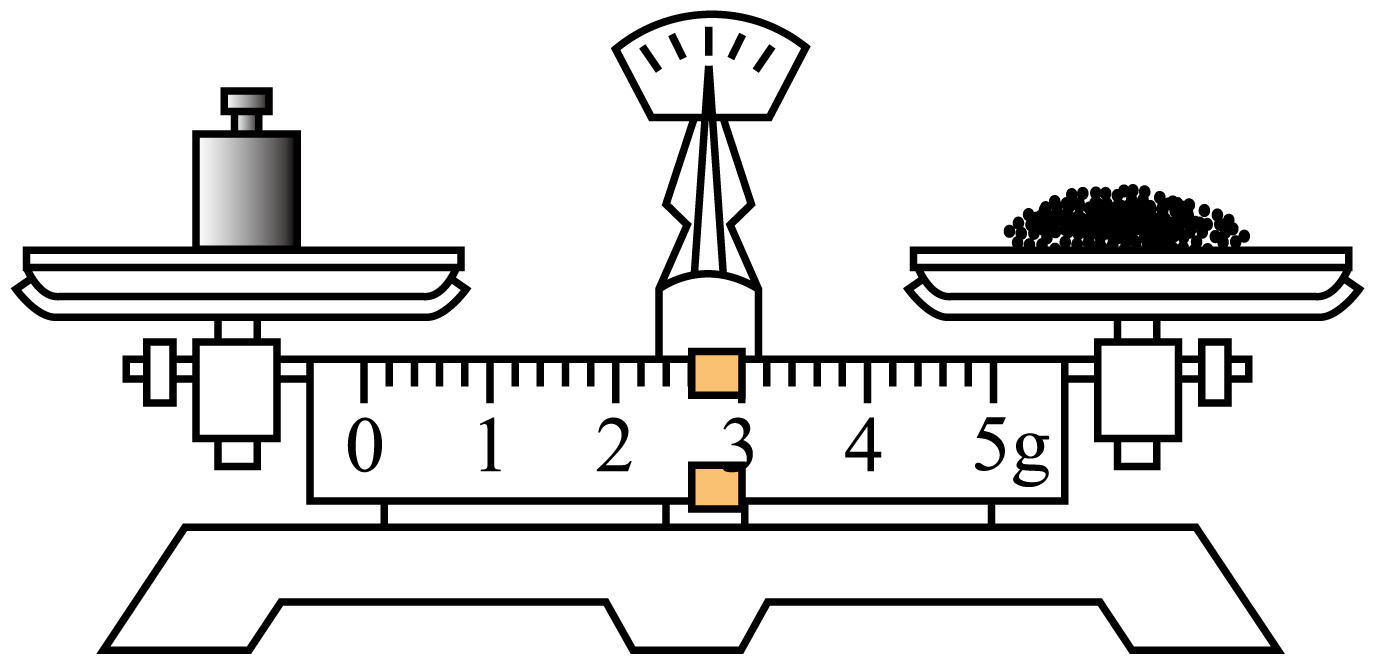 C、步骤⑤
C、步骤⑤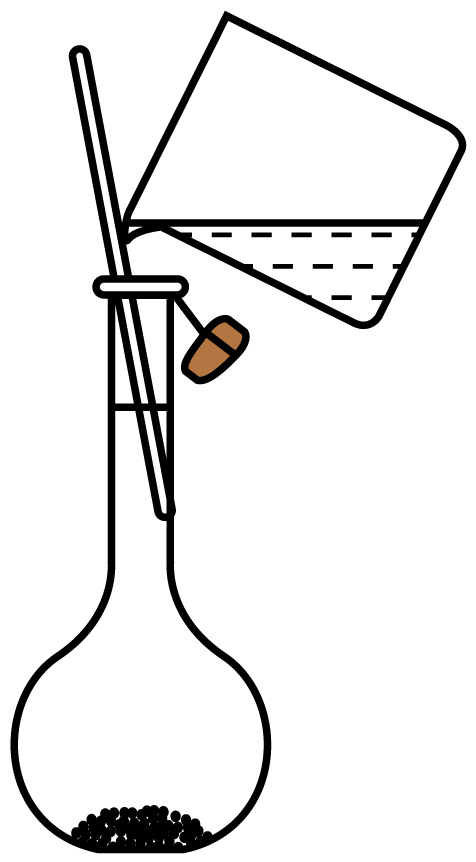 D、步骤⑥
D、步骤⑥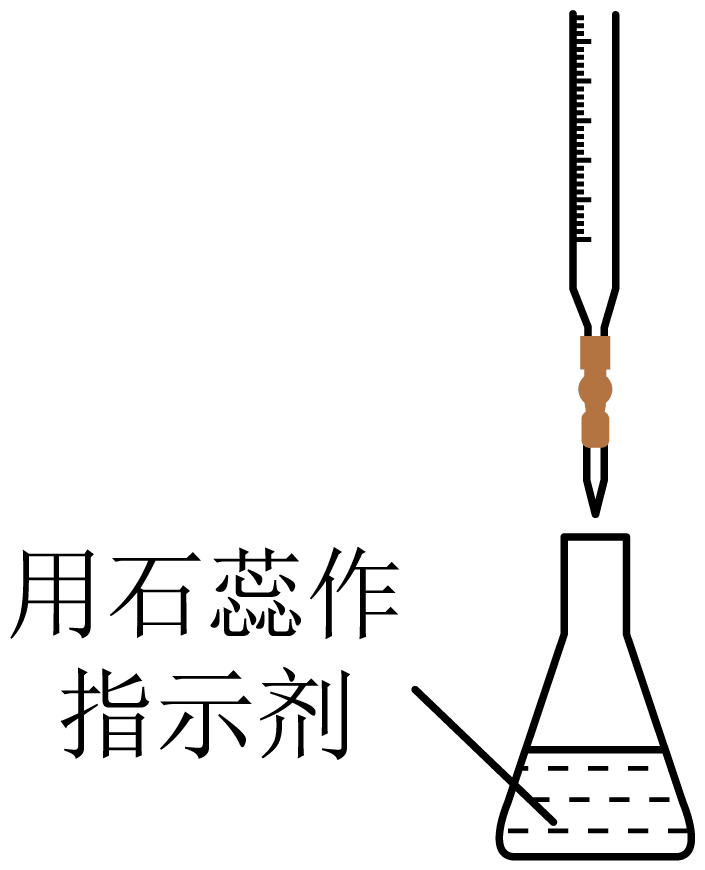 5. 钇稳定氧化锆浓差电池可用于测定待测环境中氧气的含量,在冶金、能源等领域应用广泛。其原理是利用空气与待测环境中氧气的浓度差对电压的影响,某工作状态如图所示。该电池工作时,下列说法不正确的是( )
5. 钇稳定氧化锆浓差电池可用于测定待测环境中氧气的含量,在冶金、能源等领域应用广泛。其原理是利用空气与待测环境中氧气的浓度差对电压的影响,某工作状态如图所示。该电池工作时,下列说法不正确的是( ) A、电极A为正极 B、O2-由电极A向电极B迁移 C、电极B发生的反应为 D、理论上,电解质中O2-的总物质的量会增加6. 劳动创造美好生活。下列劳动项目与所述的化学知识有关联的是( )
A、电极A为正极 B、O2-由电极A向电极B迁移 C、电极B发生的反应为 D、理论上,电解质中O2-的总物质的量会增加6. 劳动创造美好生活。下列劳动项目与所述的化学知识有关联的是( )选项
劳动项目
化学知识
A
传承工艺:使用含淀粉酶的麦芽作用于淀粉,制作饴糖(又称麦芽糖饴)
麦芽糖水解可生成葡萄糖
B
环保活动:用Fe2(SO4)3作净水剂
Fe3+水解形成的氢氧化铁胶体可以吸附水中的悬浮物
C
学农活动:向盐碱地(含Na2CO3、NaCl)洒石膏进行处理
Na2CO3能与CaCl2发生复分解反应
D
学工活动:将铝制品电解氧化形成保护膜
铝制品与电源负极相连能够受保护
A、A B、B C、C D、D7. 咖啡酸甲酯可用作食品增香剂及化妆品中的抗氧化剂,其结构如图所示。关于该化合物,下列说法正确的是( ) A、属于烃类化合物 B、能与Na2CO3溶液反应生成CO2 C、能发生氧化反应、加成反应和取代反应 D、1mol该化合物最多能与2molNaOH反应8. 化学反应中有颜色变化之美。下列相关离子方程式表示不正确的是( )A、向溶液中滴加稀硫酸出现黄色沉淀: B、向溶液中加入出现红褐色沉淀: C、向酸性溶液中通入后溶液紫色褪去: D、向溶液中加入后溶液变为黄色:9. 某学习小组设计如图所示实验装置(装置中空气已排尽)探究氮的氧化物的性质。下列说法不正确的是( )
A、属于烃类化合物 B、能与Na2CO3溶液反应生成CO2 C、能发生氧化反应、加成反应和取代反应 D、1mol该化合物最多能与2molNaOH反应8. 化学反应中有颜色变化之美。下列相关离子方程式表示不正确的是( )A、向溶液中滴加稀硫酸出现黄色沉淀: B、向溶液中加入出现红褐色沉淀: C、向酸性溶液中通入后溶液紫色褪去: D、向溶液中加入后溶液变为黄色:9. 某学习小组设计如图所示实验装置(装置中空气已排尽)探究氮的氧化物的性质。下列说法不正确的是( )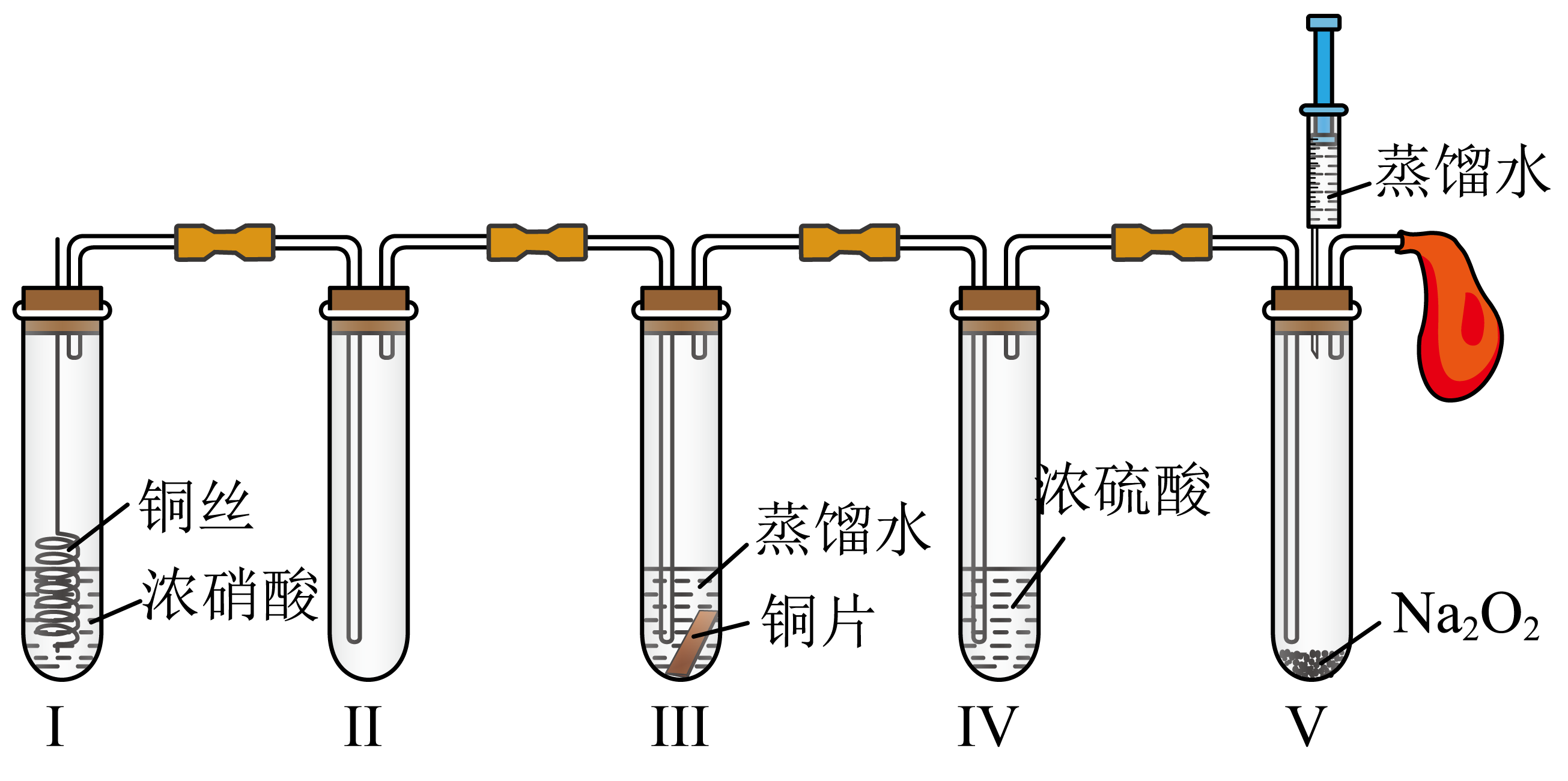 A、装置I中产生红棕色气体,体现浓硝酸的强氧化性 B、将装置Ⅱ浸入热水浴中,气体颜色变深,说明是放热反应 C、装置Ⅲ中的溶液变蓝,说明NO2氧化了金属铜 D、向装置V中加入蒸馏水,无色气体变为红棕色10. 部分含S和Cl的物质分类与相应化合价的关系如图所示。下列说法正确的是( )
A、装置I中产生红棕色气体,体现浓硝酸的强氧化性 B、将装置Ⅱ浸入热水浴中,气体颜色变深,说明是放热反应 C、装置Ⅲ中的溶液变蓝,说明NO2氧化了金属铜 D、向装置V中加入蒸馏水,无色气体变为红棕色10. 部分含S和Cl的物质分类与相应化合价的关系如图所示。下列说法正确的是( ) A、a和e都是强酸 B、向h的溶液中通入c,溶液的酸性增强 C、b或f与金属Cu反应的产物中Cu的化合价均为+2 D、c和g都具有漂白性,其使品红溶液褪色的原理相同11. 下列陈述I与陈述Ⅱ均正确,且具有因果关系的是( )
A、a和e都是强酸 B、向h的溶液中通入c,溶液的酸性增强 C、b或f与金属Cu反应的产物中Cu的化合价均为+2 D、c和g都具有漂白性,其使品红溶液褪色的原理相同11. 下列陈述I与陈述Ⅱ均正确,且具有因果关系的是( )选项
陈述I
陈述Ⅱ
A
可用K3[Fe(CN)6]溶液检验铁制品是否发生了吸氧腐蚀
K3[Fe(CN)6]能与Fe2+反应生成蓝色沉淀
B
相同温度下,0.1mol·L-1NHCl溶液的pH比同浓度NaCl
NH4Cl是弱电解质,NaCl是强电解质
C
向AlCl3溶液中滴加氨水至过量,先产生白色沉淀,之后沉淀溶解
Al(OH)3是两性氢氧化物
D
非金属性:Cl>Br>I
沸点:HCl<HBr<HI
A、A B、B C、C D、D12. 设为阿伏加德罗常数的值。氯碱工业涉及和等物质,下列说法正确的是( )A、固体所含质子的数目为 B、与足量溶液反应转移电子的数目为 C、标准状况下,和的混合气体中所含原子的数目为 D、的氯水中,含和的总数为13. 常温下,向碱溶液中滴加盐酸,溶液的及导电能力随滴加盐酸体积的变化曲线如图所示。下列说法正确的是( )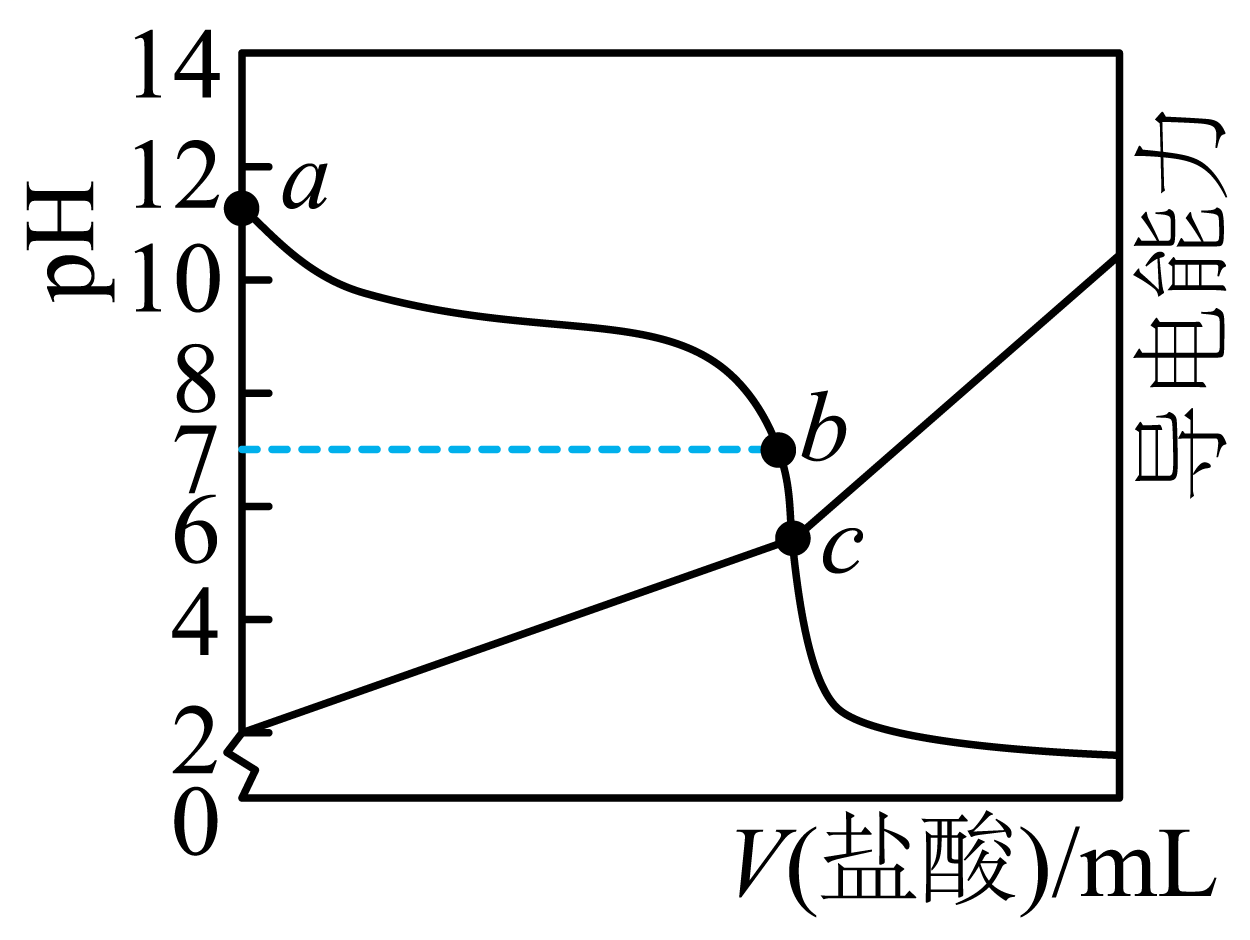 A、的电离方程式为 B、水的电离程度: C、点溶液中 D、点溶液中14. 某肠胃药的主要成分为。为原子序数依次增大的短周期主族元素,且在每个周期均有分布。的基态原子每个能级填充电子数均相同。和形成的化合物是刚玉的主要成分。和位于同一周期,第一电离能。下列说法正确的是( )A、 B、简单离子半径: C、最高价氧化物对应水化物的碱性: D、与或均能形成含有非极性共价键的物质15. 在一密闭容器中,物质发生三个脱水的竞争反应:①
A、的电离方程式为 B、水的电离程度: C、点溶液中 D、点溶液中14. 某肠胃药的主要成分为。为原子序数依次增大的短周期主族元素,且在每个周期均有分布。的基态原子每个能级填充电子数均相同。和形成的化合物是刚玉的主要成分。和位于同一周期,第一电离能。下列说法正确的是( )A、 B、简单离子半径: C、最高价氧化物对应水化物的碱性: D、与或均能形成含有非极性共价键的物质15. 在一密闭容器中,物质发生三个脱水的竞争反应:①② ③反应历程如图所示。相同条件下,下列说法正确的是( )
 A、由图可知,物质M比物质N稳定 B、反应①比反应②和③更快达到化学平衡 C、的反应热 D、平衡后压缩容器,物质E的物质的量不变16. 一种用3-氯丙烯(
A、由图可知,物质M比物质N稳定 B、反应①比反应②和③更快达到化学平衡 C、的反应热 D、平衡后压缩容器,物质E的物质的量不变16. 一种用3-氯丙烯( )电解合成环氧氯丙烷(
)电解合成环氧氯丙烷( )的装置如图所示。该装置无需使用隔膜,且绿色高效,图中X为Cl或Br,工作时X-和OH-同时且等量放电。下列说法正确的是( )
)的装置如图所示。该装置无需使用隔膜,且绿色高效,图中X为Cl或Br,工作时X-和OH-同时且等量放电。下列说法正确的是( ) A、每转移1mole- , 生成1mol环氧氯丙烷 B、电解一段时间后,装置中OH-的物质的量不变 C、若X为Br,则可电解制备环氧溴丙烷 D、该装置工作时需不断补充X-
A、每转移1mole- , 生成1mol环氧氯丙烷 B、电解一段时间后,装置中OH-的物质的量不变 C、若X为Br,则可电解制备环氧溴丙烷 D、该装置工作时需不断补充X-二、非选择题:本题共4小题,共56分。
-
17. 乙烯是重要的化工原料。某小组同学制备乙烯并探究乙烯与溴水反应的产物。(1)、
I.制备乙烯
如图所示为制备纯净的乙烯的部分实验装置。
仪器i的名称为;制备乙烯的化学方程式为。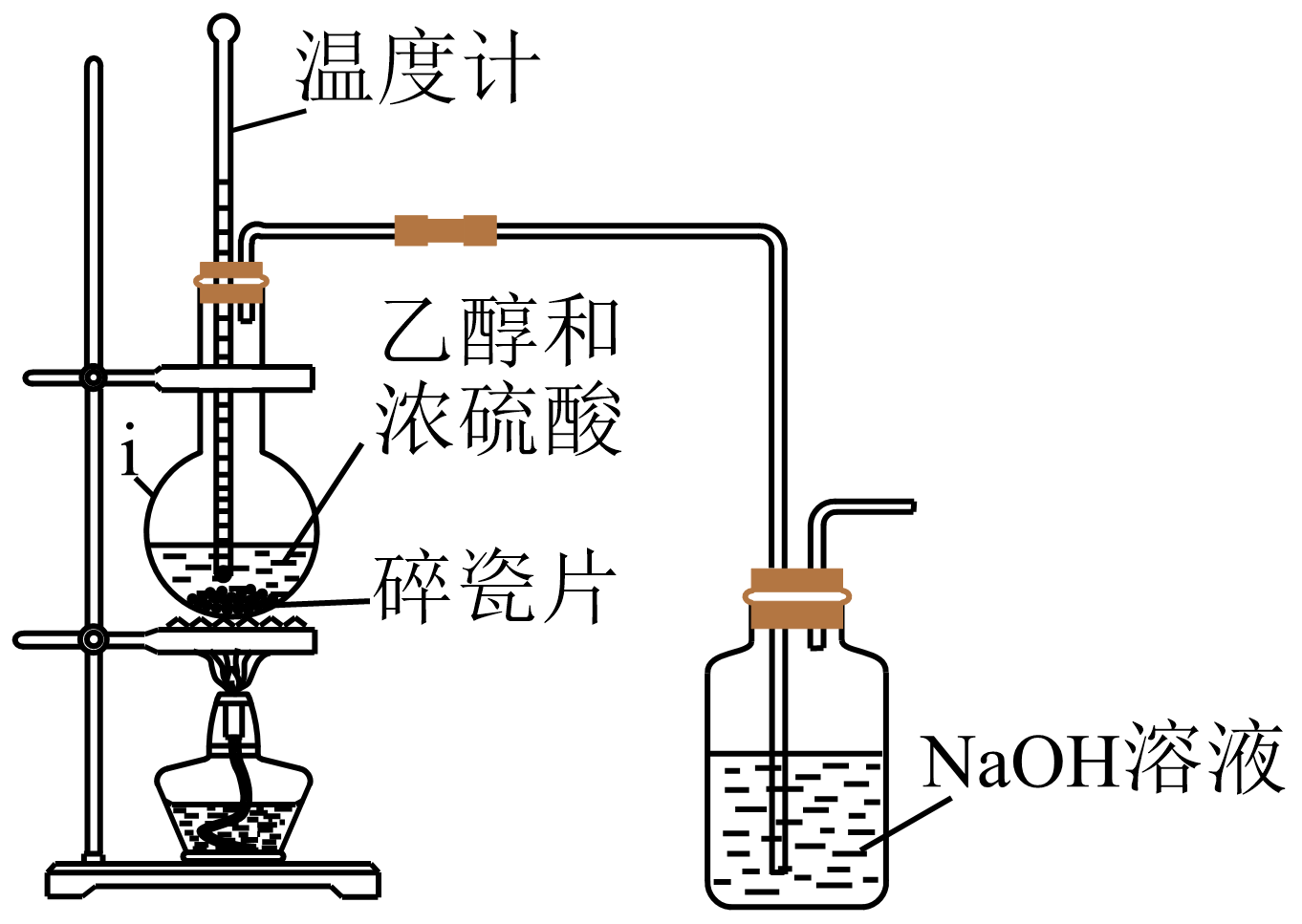 (2)、NaOH溶液的作用为。(3)、写出一种乙烯在生产或生活中的应用:。(4)、Ⅱ.探究乙烯和溴水反应的产物
(2)、NaOH溶液的作用为。(3)、写出一种乙烯在生产或生活中的应用:。(4)、Ⅱ.探究乙烯和溴水反应的产物提出猜想1:发生加成反应只生成1,2-二溴乙烷。
验证猜想1
实验操作
预期实验现象
实际实验现象
向一定浓度的溴水中匀速通入足量纯净的乙烯气体,并用pH传感器检测溶液pH的变化。
( ),溶液的pH变大
溴水褪色,溶液没有明显的分层现象,溶液的pH变小
请补充预期实验现象:。预期实验现象中pH变大,请利用平衡移动的原理说明原因:。
(5)、提出猜想2:发生取代反应生成1-溴乙烯(实验条件下为不溶于水的无色气体)和HBr。
验证猜想2
实验装置
实验操作
实验现象
实验结论
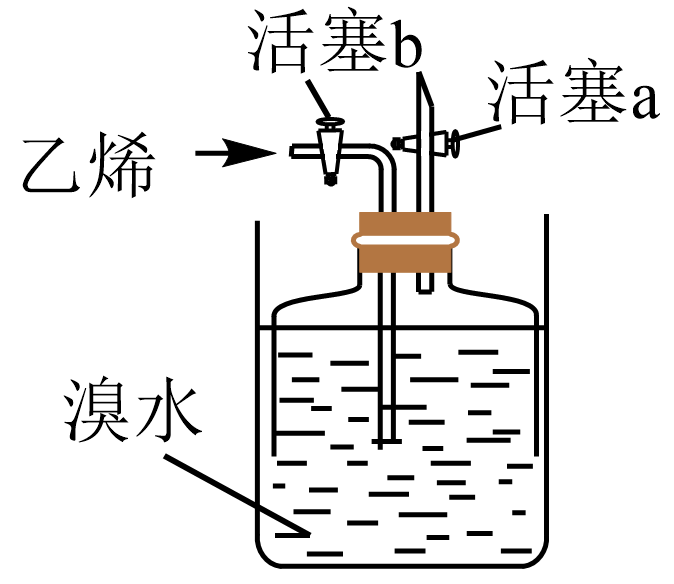
1.向装置中加入足量的溴水,同时打开活塞a、b,下压钟罩排尽体系内空气后关闭活塞a;
2.通入适量的乙烯,排出钟罩内部分溴水后,关闭活塞b。静置一段时间
( )
猜想2不成立
说明:通入的乙烯不能过量,要确保溴水未完全褪色。
证明猜想2不成立的实验现象为;通入的乙烯不能过量的原因为。(6)、查阅资料
乙烯与Br2反应生成1,2-二溴乙烷的机理如下图所示: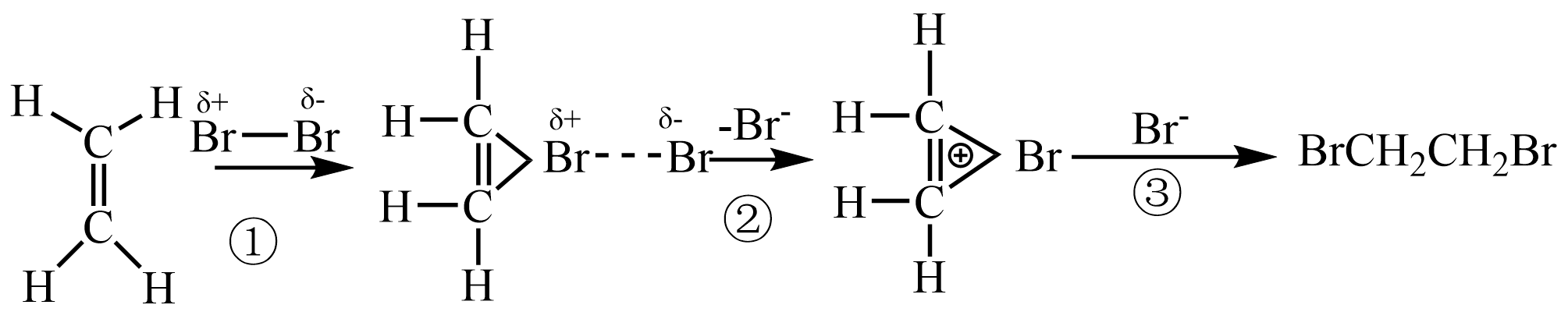
说明:“---”表示共价键未完全断裂或形成。
教师指导:乙烯与溴水反应时,第①步和第②步与上述机理相同,第③步主要是H2O参与了反应,导致溶液的pH变小。
基于第③步中H2O参与反应,写出乙烯与溴水反应的化学方程式:。18. 铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下: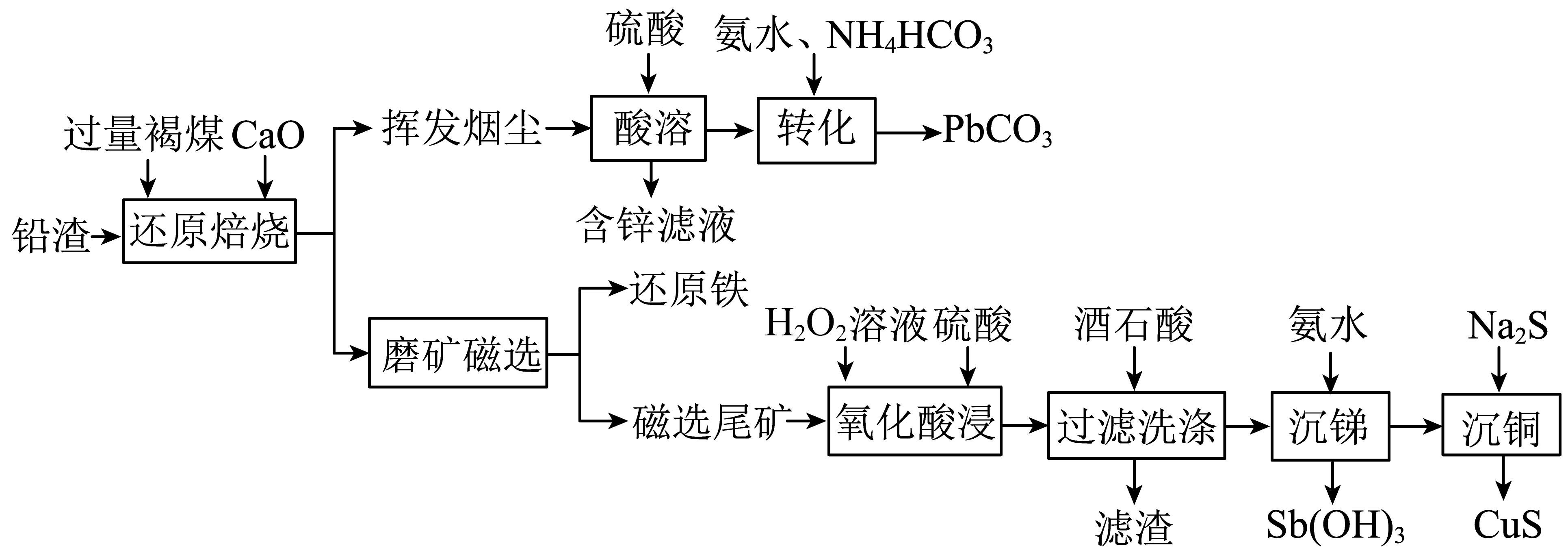
已知:①常温下, ,
金属离子浓度等于时,可认为其恰好完全沉淀。
(1)、位于第六周期,与碳元素同主族,其价层电子排布式为。(2)、“还原焙烧”时,发生反应的化学方程式为。(3)、挥发烟尘中的主要氧化物为。①区分挥发烟尘中的氧化物是晶体还是非晶体的最可靠的科学方法为。
②“转化”过程中,发生反应的化学方程式为。
(4)、“氧化酸浸”过程中,若将物质的量为的合金(其中与物质的量之比为氧化,至少需要的物质的量为mol(用含a、b的式子表示)。(5)、“过滤洗涤”过程中,加入酒石酸(表示为)发生如下配位反应:①上述两个配合物中,提供空轨道的元素为(填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为。
(6)、“沉锑”过程中,锑恰好完全沉淀时,溶液中。(7)、一种铅卤基钙钛矿的晶胞结构如图所示,其中八面体体心为Pb,顶点为Br,晶体中各八面体顶点相连。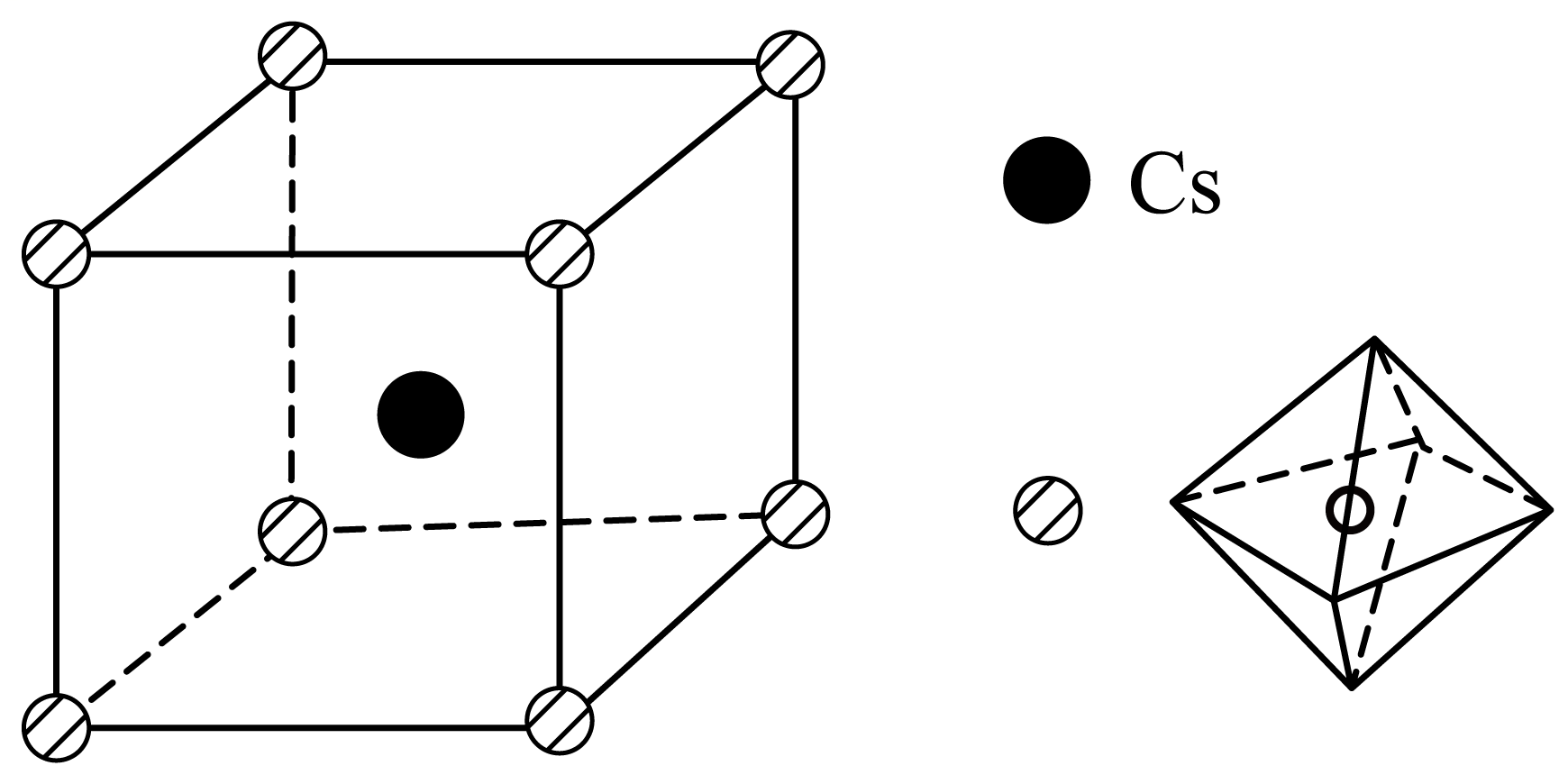
①该晶体的化学式为。
②若该晶体的晶胞以Cs为顶点,则Br在晶胞中的位置为。
19. 铜及其化合物在生产及生活中应用广泛。(1)、铜-铁催化剂可用于电催化还原为 , 完成下列离子方程式:++
(2)、铜-铁催化剂还可以催化分解转化为燃料氢气,反应为。往体积为的密闭容器中加入分解制。图中曲线a、b分别表示在分别表示在铜-铁催化剂I的作用下,时及时随时间的变化;曲线表示在铜-铁催化剂Ⅱ的作用下,时随时间的变化。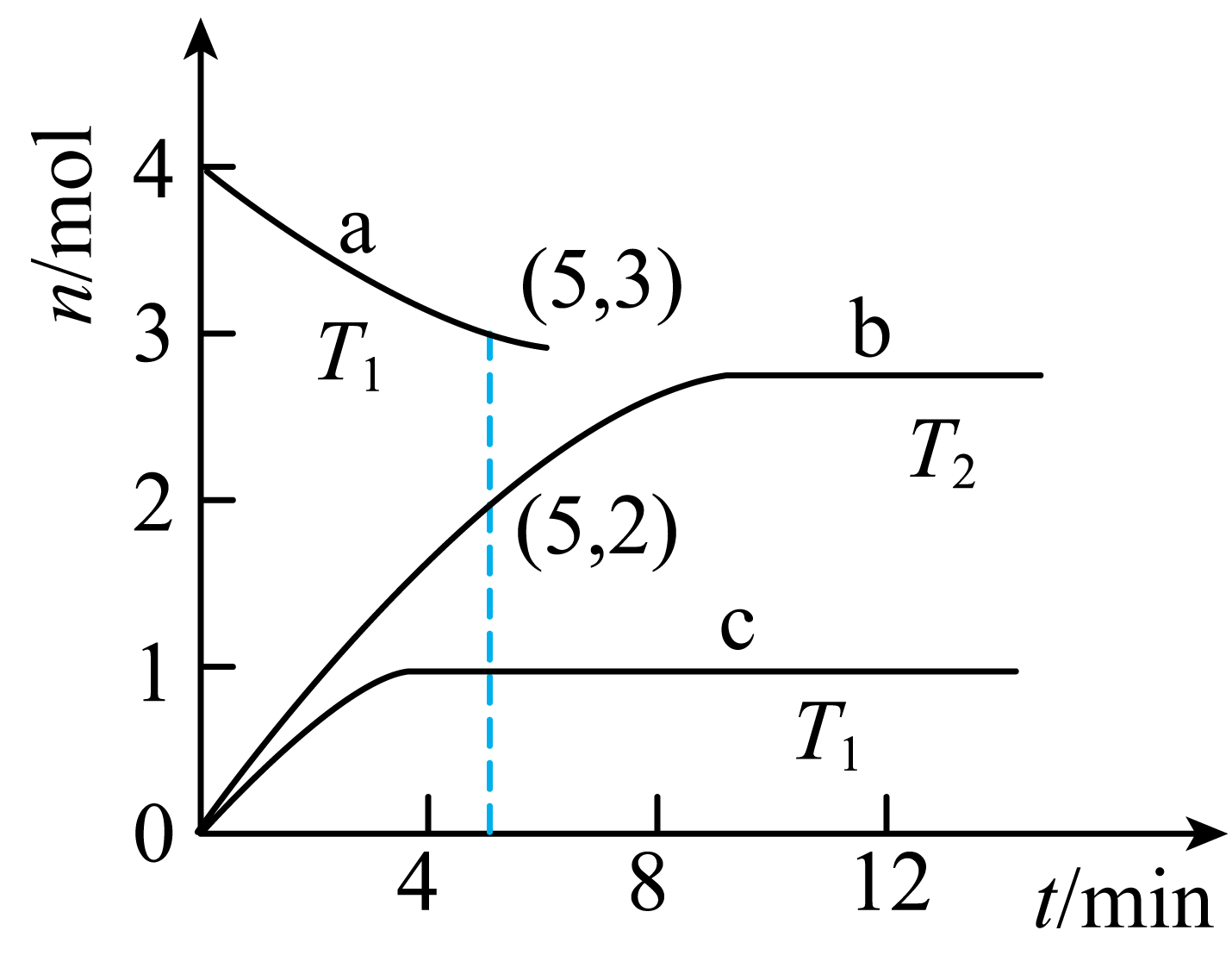
①(填“<”“>”或“=”)。
②在铜-铁催化剂I的作用下,时,内平均反应速率。
③上述三种条件下,分解反应的平衡常数的大小关系为
(3)、工业合成氨中,常用亚铜盐的氨水溶液除去原料气中的 , 反应的离子方程式为 , 该反应的。其他条件不变时,下列说法正确的有____(填字母)。A、与的浓度相等时,反应达到平衡 B、平衡后增大的浓度,的转化率增大 C、平衡后加水稀释,与的浓度之比增大 D、可采用加热溶液的方法实现的再生(4)、工业生产中采用水解中和法处理含铜废水。常温下,水溶贸中含铜微粒和的分布系数(某含铜微粒占总含铜微粒的物质的量分数)随的变化曲线如图所示。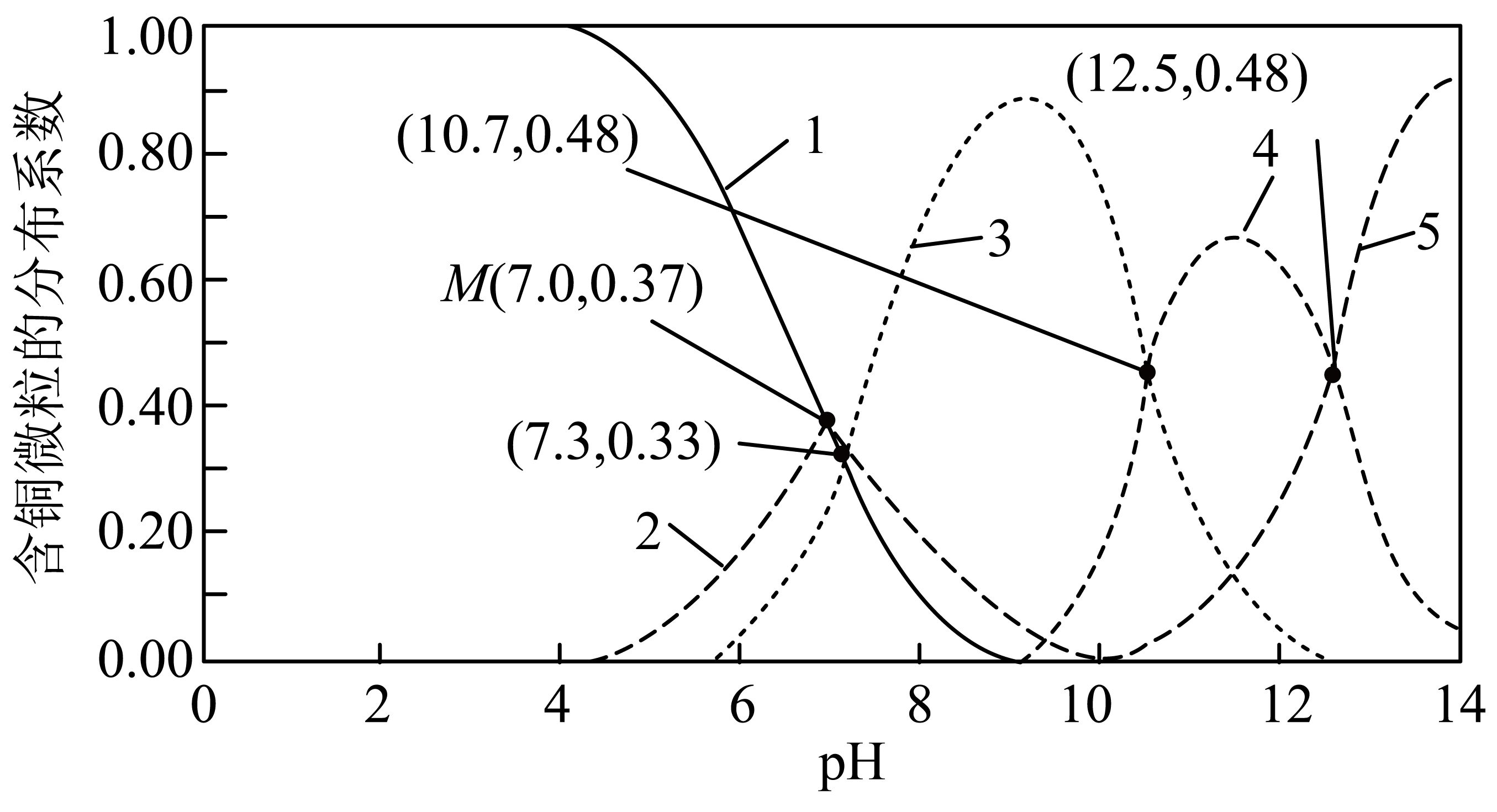
①曲线2代表的含铜微粒为。
②的平衡常数K=。
③若CuSO4溶液起始浓度为 , 加入NaOH固体调节溶液pH(忽略加入固体后引起的溶液体积的变化),求M点混合溶液中Na+的浓度(写出计算过程,结果用含的式子表示)。
20. 偏苯三酸是工业上重要的日用化学品,其合成路线如下: (1)、化合物i的分子式为 , 其含氧官能团的名称为。化合物x为化合物i的同分异构体,其分子中含碳碳双键,能与NaHCO3溶液反应,且核磁共振氢谱峰面积比为1:1:6的化合物的结构简式为(写一种)。(2)、反应①为两分子化合物ii合成化合物iii,原子利用率为100%,则化合物ii的结构简式为。(3)、根据化合物vii的结构特征,分析预测其可能的化学性质,完成下表:
(1)、化合物i的分子式为 , 其含氧官能团的名称为。化合物x为化合物i的同分异构体,其分子中含碳碳双键,能与NaHCO3溶液反应,且核磁共振氢谱峰面积比为1:1:6的化合物的结构简式为(写一种)。(2)、反应①为两分子化合物ii合成化合物iii,原子利用率为100%,则化合物ii的结构简式为。(3)、根据化合物vii的结构特征,分析预测其可能的化学性质,完成下表:序号
反应试剂、条件
反应形成的新结构
反应类型
a
加成反应
b
取代反应
(4)、反应③中,化合物iv脱水可得到两种产物,两种产物之间存在转化平衡反应: , 其中一种产物v与化合物i反应生成化合物vi。下列说法不正确的有____(填字母)。A、化合物v的结构简式为
, 其中一种产物v与化合物i反应生成化合物vi。下列说法不正确的有____(填字母)。A、化合物v的结构简式为 B、反应④发生时,转化平衡反应逆向移动
C、化合物iv易溶于水,因为它能与水分子形成氢键
D、化合物vi中存在sp2与sp3杂化碳原子间的键,且每个vi分子中存在1个手性碳原子
(5)、以2-丁烯为含碳原料,结合反应④~⑦的原理合成
B、反应④发生时,转化平衡反应逆向移动
C、化合物iv易溶于水,因为它能与水分子形成氢键
D、化合物vi中存在sp2与sp3杂化碳原子间的键,且每个vi分子中存在1个手性碳原子
(5)、以2-丁烯为含碳原料,结合反应④~⑦的原理合成 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:(a)反应过程中生成的苯的同系物为(写结构简式)。
(b)相关步骤涉及卤代烃的消去反应,其化学方程式为(注明反应条件)。