云南省大理白族自治州2024年高考第二次复习统一检测理综-化学试卷
试卷更新日期:2024-04-19 类型:高考模拟
一、选择题:本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 化学与生活密切相关,下列说法不合理的是( )A、青铜器“四羊方尊”的主要材质为合金 B、具有导电性,可用于制作光电池 C、乙二醇溶液可用作汽车的防冻液 D、大豆蛋白纤维是一种可降解材料2. 2022年诺贝尔化学奖授予了对点击化学和生物正交反应做出贡献的三位科学家。环辛烯衍生物(A)与四嗪(B)的生物正交反应过程为下列说法错误的是( )
 A、A中碳原子的杂化类型为sp2、sp3 B、B中杂环上四个氮原子共平面 C、反应1和反应2均为消去反应 D、D中苯环上的一氯代物有6种3. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种新型超分子,其分子结构如下图所示(Y和Y之间重复单元的W、X未全部标出),W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素,下列说法正确的是( )
A、A中碳原子的杂化类型为sp2、sp3 B、B中杂环上四个氮原子共平面 C、反应1和反应2均为消去反应 D、D中苯环上的一氯代物有6种3. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种新型超分子,其分子结构如下图所示(Y和Y之间重复单元的W、X未全部标出),W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素,下列说法正确的是( )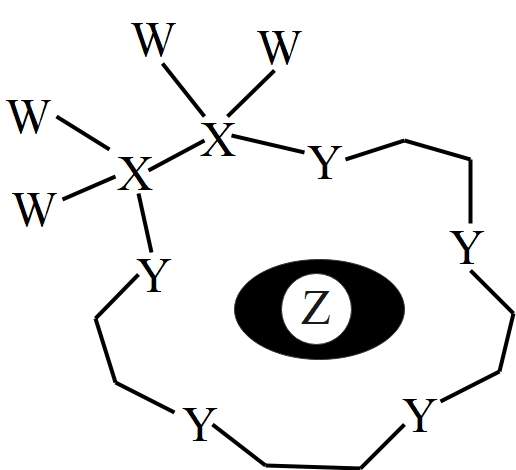 A、简单气态氢化物的沸点: B、第一电离能: C、只含有离子键 D、原子半径:4. 第二代钠离子电池是正极为锰基高锰普鲁士白、负极为镶嵌在硬碳中的钠的一种新型二次电池,其工作原理如下图所示。
A、简单气态氢化物的沸点: B、第一电离能: C、只含有离子键 D、原子半径:4. 第二代钠离子电池是正极为锰基高锰普鲁士白、负极为镶嵌在硬碳中的钠的一种新型二次电池,其工作原理如下图所示。
下列说法正确的是( )
A、充电时,B极发生氧化反应 B、充电时,穿过离子交换膜在A极上得电子 C、配离子中配体为 D、放电时,正极反应为5. 只利用下列实验药品,不能达到实验目的的是( )实验目的
实验药品
A
探究温度对化学平衡的影响
与混合气体、冷水、热水
B
验证乙醇的消去产物是乙烯
乙醇、酸性高锰酸钾溶液、浓硫酸
C
证明牺牲阳极法保护铁
、、酸化的食盐水、溶液
D
比较水和四氯化碳分子的极性
、、
A、A B、B C、C D、D6. 某反应可有效降低汽车尾气污染物的排放,一定条件下该反应(均为气体)经历三个基元反应阶段,反应历程如下图所示(TS表示过渡态)。下列说法错误的是( )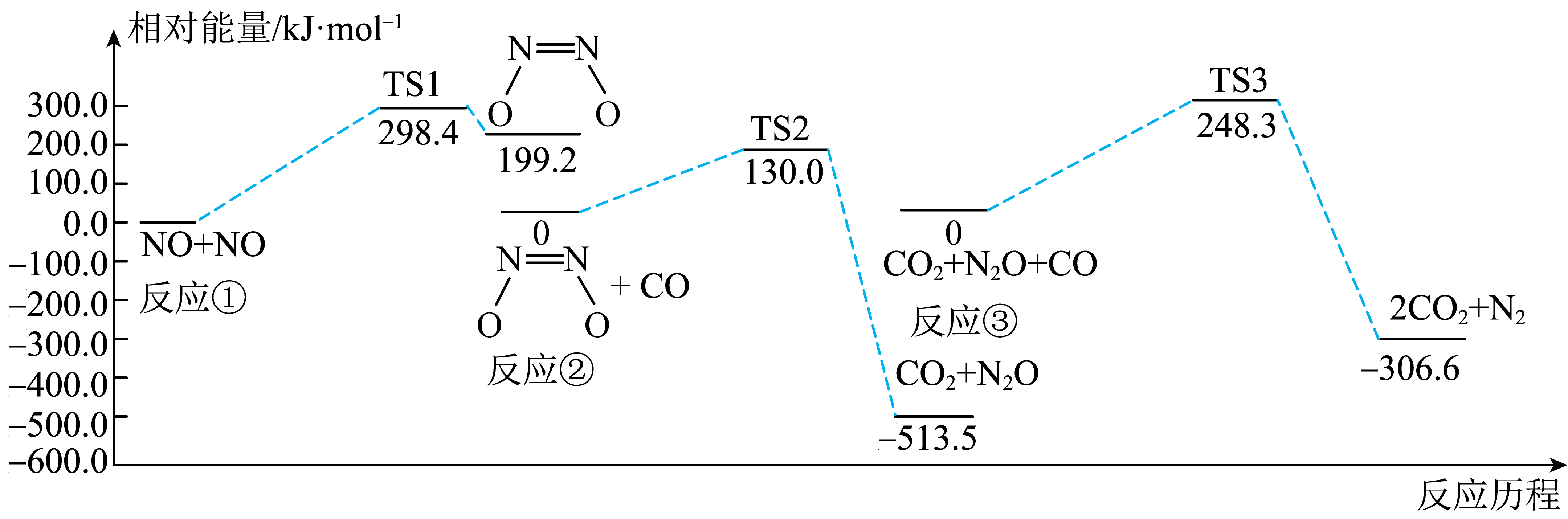 A、该过程包含一个吸热反应和两个放热反应 B、反应②逆反应的活化能为 C、该过程的总反应为 D、反应③生成2mol时,转移电子数为7. 25℃时,用0.1溶液滴定同浓度的溶液,被滴定分数与值、微粒分布分数 , X表示、或]的关系如图所示,下列说法正确的是( )
A、该过程包含一个吸热反应和两个放热反应 B、反应②逆反应的活化能为 C、该过程的总反应为 D、反应③生成2mol时,转移电子数为7. 25℃时,用0.1溶液滴定同浓度的溶液,被滴定分数与值、微粒分布分数 , X表示、或]的关系如图所示,下列说法正确的是( )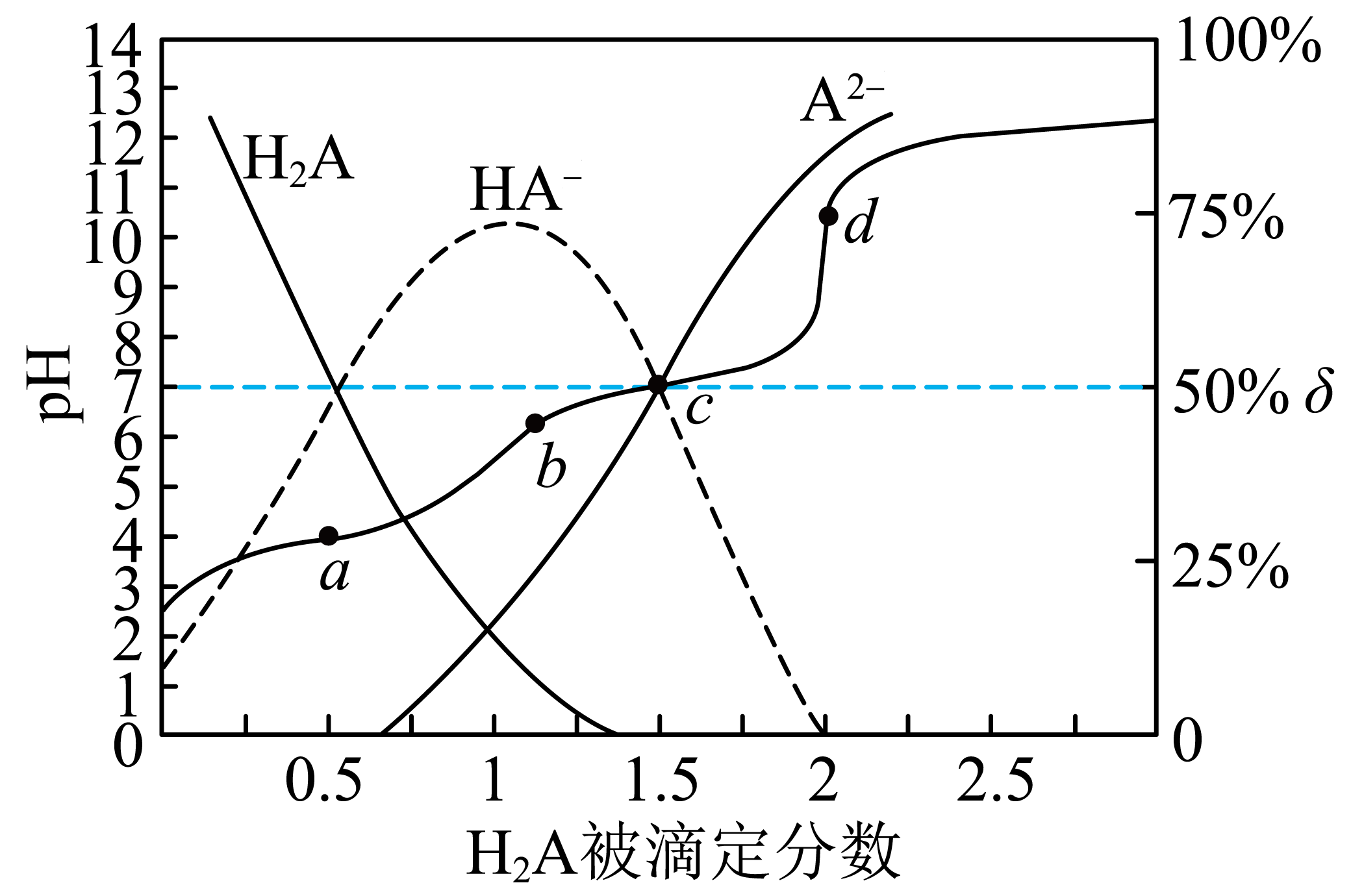 A、用溶液滴定0.1溶液可以用酚酞作指示剂 B、25℃时,第二步电离平衡常数 C、c点溶液中: D、a、b、c、d四点溶液中水的电离程度:
A、用溶液滴定0.1溶液可以用酚酞作指示剂 B、25℃时,第二步电离平衡常数 C、c点溶液中: D、a、b、c、d四点溶液中水的电离程度:二、第II卷(共174分)
-
8. 近年来,人们发现不仅在颜料、防腐工业等方面具有广泛的用途,而且的大单晶体是一种很重要的电光调制晶体,也是有机合成中性能优良的催化剂。研究发现一种利用低品位铜矿(含、和等)为原料制取的工艺流程如下:

已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,的溶度积常数。
(1)、铜矿中未被氧化的物质有。(2)、滤液D中铁离子的浓度约为。(3)、向滤液D中先通氨气的目的是____。A、中和溶液中的 B、调节溶液值,生成沉淀 C、有利于的生成 D、增加的溶解度(4)、固体E主要是 , 生成的离子方程式是。(5)、滤液F加热生成、和 , 反应的化学方程式是。(6)、若要制取99.5g , 理论上至少需要质量分数为25%的的铜矿粉的质量为g。(7)、查阅资料:立方晶胞结构如下图所示,其晶胞参数为apm,以配位键与相结合,其中的配位数为 , 晶体密度为。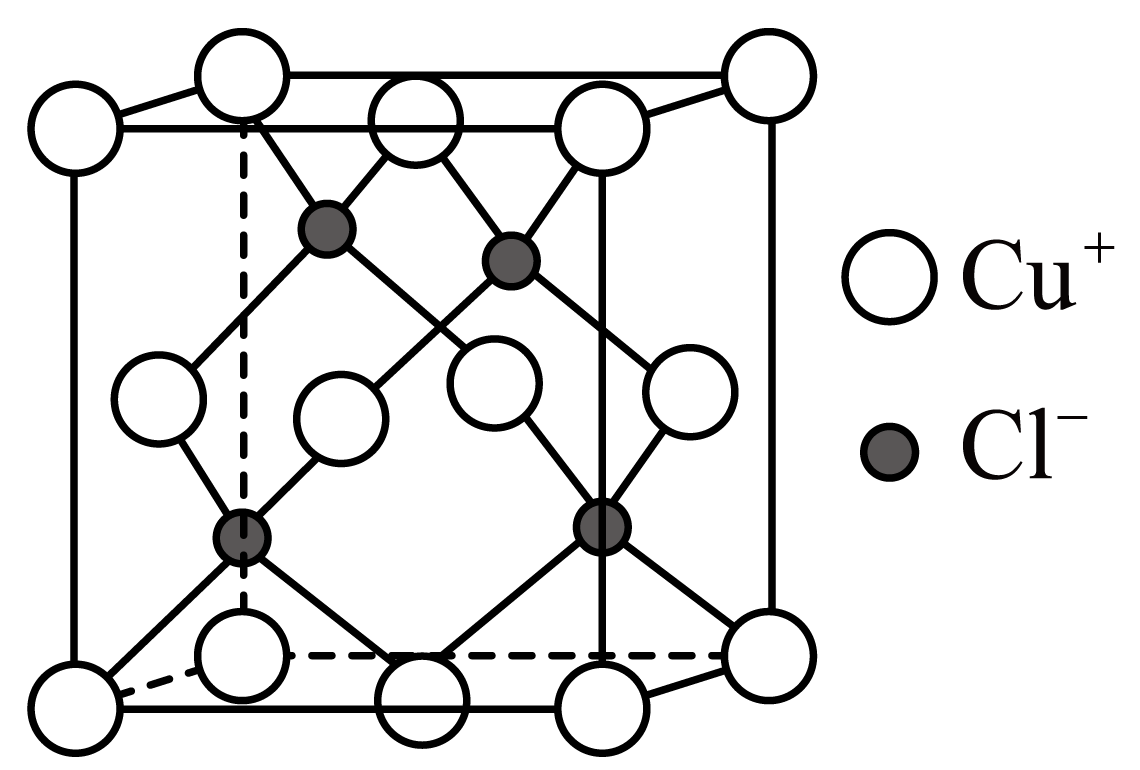 9. 三氯化铬()可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用和制备无水并测定产品纯度,进行如图实验探究,回答下列问题:(1)、制备无水
9. 三氯化铬()可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用和制备无水并测定产品纯度,进行如图实验探究,回答下列问题:(1)、制备无水
①所选装置的连接顺序为:A→→C→E(填“B”或“D”),不选另一装置的原因是:。
②实验开始时,点燃酒精喷灯适合在水浴加热之(填“前”或“后”)。
③已知制备时有气体生成,制备反应的化学方程式为;
气体易水解则尾气处理时适合选用的试剂为(填序号)。
A.溶液 B.稀溶液 C.水
(2)、测定产品纯度(杂质不参加反应)已知:
准确称取31.7g产品,温水溶解后稀释至250 , 量取25.00溶液加入锥形瓶中,向其中加入足量充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量溶液;滴加淀粉作指示剂,用2标准溶液滴定 , 达到滴定终点时消耗标准液的体积为15。
①加入足量的主要作用为。
②写出加硫酸酸化后的橙色物质与溶液发生反应的离子方程式。
③反应后溶液煮沸的目的为。
④产品中的质量分数为。
10. 丙烯是重要的化工原料,可用于生产丙醇、卤代烃和塑料。(1)、工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯。反应原理如下:I.
Ⅱ.
Ⅲ.。
(2)、某研究小组向密闭容器中充入一定量的和 , 分别在A、B两种不同催化剂作用下发生反应I,一段时间后测得的产率与温度的关系如图所示。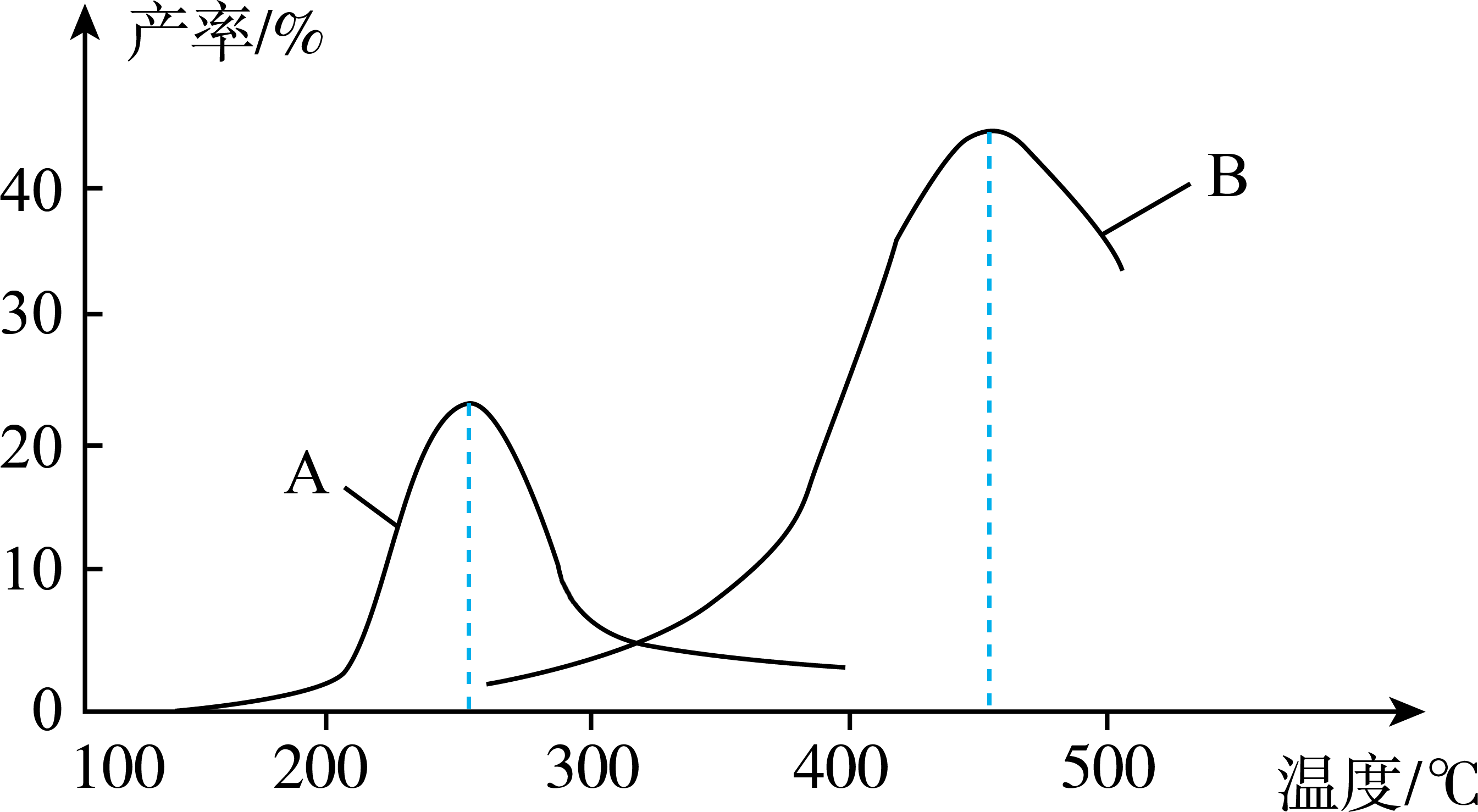
①下列说法正确的是(填序号)。
A.使用催化剂B的最佳温度约为250℃
B.相同条件下,改变压强会影响的产率
C.催化剂不仅能改变反应速率,还能改变平衡时的产率
D.两种催化剂均能降低反应的活化能,但不能改变的数值
②在催化剂A作用下,温度低于200℃时,的产率随温度升高变化不大,主要原因是。
(3)、反应在不同温度下达到平衡,在总压强分别为和时,测得丙烷及丙烯的物质的量分数如图所示。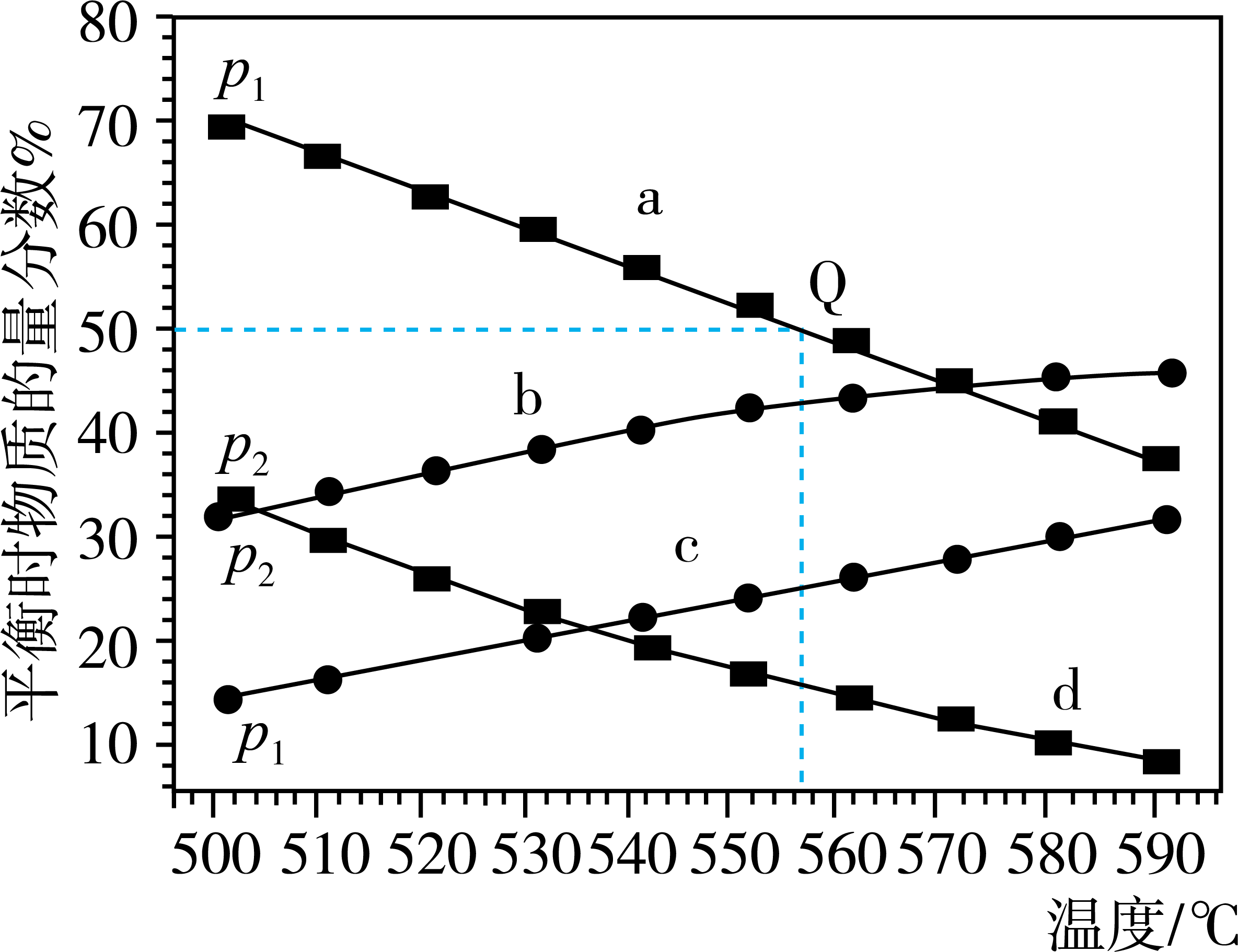
①b、c代表(填“丙烷”或“丙烯”),(填“大于”“小于”或“等于”)
②起始时充入一定量丙烷,在恒压条件下发生反应,Q点对应温度下丙烷的转化率为(用分数表示),该反应的平衡常数=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)、丙烷氧化脱氢法制备丙烯的反应为 , 过程中还生成、等副产物。相同时间内,的转化率和的产率随温度变化的关系如图所示。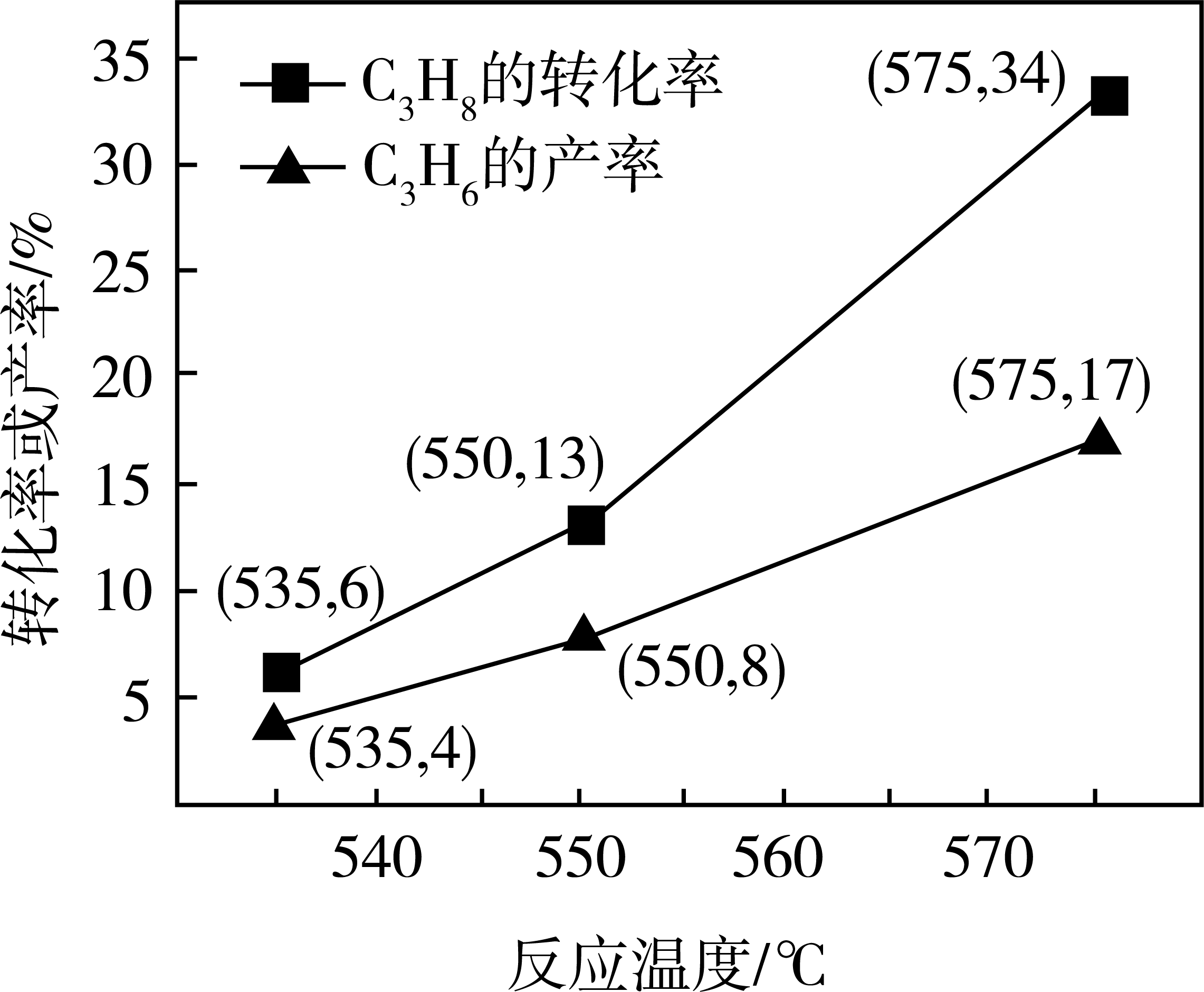
①550℃时,的选择性为%(的选择性= , 计算结果精确到0.1)。
②基于上述研究结果,能提高的选择性的措施是。
11. 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):
已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)、B→C的反应类型为 , C中含氧官能团的名称为 , C分子是否为手性分子:(填“是”或“否”)。(2)、已知: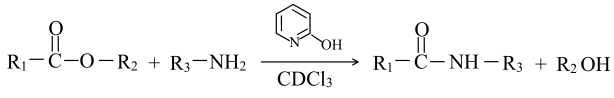 , 通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小解释原因。
, 通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小解释原因。元素
H
C
O
电负性
2.1
2.5
3.5
(3)、E→F过程中,反应i的化学方程式为:。(4)、J的结构简式为 , 其中氮原子的杂化轨道类型为。(5)、写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式。i.含有3个六元环,其中1个是苯环;
ii.含有
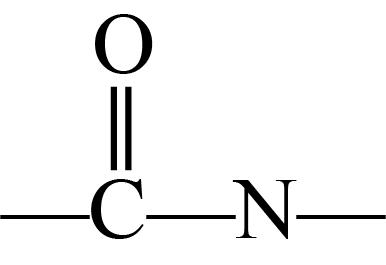 结构,不含键;
结构,不含键;iii.含有4种不同化学环境的氢原子。
(6)、综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①;②;③。