广东省湛江市2024年高考一模化学试题
试卷更新日期:2024-04-19 类型:高考模拟
一、单选题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的
-
1. “葡萄美酒夜光杯,欲饮琵琶马上催”。下列中国酒具中,主要由硅酸盐材料制成的是( )
A
B
C
D




青铜兽面纹爵
犀角雕玉兰花果纹杯
斫木云纹漆耳杯
清代彩绘龙纹蓝瓷壶
A、A B、B C、C D、D2. 近年来,我国科技迅猛发展,下列科技成果中所蕴含的化学知识叙述不正确的是( )A、在“人造太阳”中发生核聚变的、是的同位素 B、华为麒麟芯片的主要成分是单质硅 C、歼-20战斗机采用大量先进复合材料、石墨烯材料等,其中石墨烯材料属于有机高分子材料 D、“奋斗者”号载人潜水器球壳所使用的钛合金能承受深海高压3. 化学让生活变得更美好。下列化学物质的应用说法正确的是( )A、牡蛎、虾类等海洋产品均为高蛋白食物,可为人体补充多种氨基酸 B、碳酸钠可作为膨松剂,用来制作糕点 C、甘油是护肤品中常见的成分,不溶于水,可用于隔绝水分,起到保湿、保润作用 D、医学上常用体积分数为95%的乙醇溶液杀菌消毒4. 是一种广泛应用于工业、农业和医药领域的重要化工气体,下列有关氨气的实验中,能达到实验目的的是( )A
B
C
D


制取
干燥
收集
先从a口通 , 再从b口通制
A、A B、B C、C D、D5. 岭南文化包罗万象,新旧文化相互交融。下列有关岭南文化的说法不正确的是( )A、“戏剧文化”:现代粤剧舞台上灯光光柱的形成是因为丁达尔现象 B、“节日文化”:深圳新年烟花秀中绚烂的颜色来自焰色试验 C、“茶艺文化”:沏泡工夫茶利用了萃取原理,水作萃取剂 D、“粤菜文化”:制作正宗盐焗鸡所用的粗盐由海水晒制而成,涉及复杂的化学变化6. 如图是一种酸性燃料电池酒精检测仪,具有自动吹起、流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是( ) A、电子由氧气通入的Pt电极流出 B、质子()通过质子交换膜从负极流向正极 C、每消耗22.4 L , 会产生1 mol醋酸 D、左侧Pt电极表面发生的反应:7. 劳动是全面发展素质教育的必要条件之一。下列劳动项目与所述的化学知识没有关联的是( )
A、电子由氧气通入的Pt电极流出 B、质子()通过质子交换膜从负极流向正极 C、每消耗22.4 L , 会产生1 mol醋酸 D、左侧Pt电极表面发生的反应:7. 劳动是全面发展素质教育的必要条件之一。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
用热的纯碱溶液洗涤餐具
纯碱能促进油脂水解
B
用糯米酿制米酒
酵母能将淀粉水解为葡萄糖,进而转化为乙醇
C
汽油中添加乙醇
乙醇分子间易形成氢键
D
回收铝制易拉罐
再利用废旧金属,节约资源
A、A B、B C、C D、D8. 绿原酸(结构如图)是金银花中富含的一类酚类化合物,具有抗菌、保肝、消炎、解热的作用。下列关于绿原酸的说法不正确的是( ) A、能发生加成反应 B、1 mol绿原酸最多能与8 mol NaOH完全反应 C、能使溴水和酸性溶液褪色 D、能与氨基酸和蛋白质中的氨基反应9. 制备并检验性质的装置如图所示。下列说法正确的是( )
A、能发生加成反应 B、1 mol绿原酸最多能与8 mol NaOH完全反应 C、能使溴水和酸性溶液褪色 D、能与氨基酸和蛋白质中的氨基反应9. 制备并检验性质的装置如图所示。下列说法正确的是( ) A、紫色石蕊试纸先变红后褪色 B、品红溶液褪色体现了的强氧化性 C、用98%浓硫酸代替70%浓硫酸能加快反应速率 D、棉花可用饱和溶液浸泡,用于尾气处理10. 部分含Fe物质的分类与相应化合价的关系如图所示。下列推断不合理的是( )
A、紫色石蕊试纸先变红后褪色 B、品红溶液褪色体现了的强氧化性 C、用98%浓硫酸代替70%浓硫酸能加快反应速率 D、棉花可用饱和溶液浸泡,用于尾气处理10. 部分含Fe物质的分类与相应化合价的关系如图所示。下列推断不合理的是( ) A、可存在a→e→b的转化 B、e溶液可与KSCN溶液反应生成红色沉淀 C、能用a制作的容器运输浓硫酸 D、a可与稀硝酸恰好反应,生成只含b的溶液11. 设为阿伏加德罗常数的值。下列关于钠及其化合物的叙述正确的是( )A、1 mol Na在空气中受热完全转化成转移电子数目为2 B、0.1 溶液中所含的数目小于0.1 C、与反应的过程中涉及离子键、极性共价键和非极性共价键的断裂 D、Al与NaOH溶液的反应中NaOH作氧化剂12. 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )
A、可存在a→e→b的转化 B、e溶液可与KSCN溶液反应生成红色沉淀 C、能用a制作的容器运输浓硫酸 D、a可与稀硝酸恰好反应,生成只含b的溶液11. 设为阿伏加德罗常数的值。下列关于钠及其化合物的叙述正确的是( )A、1 mol Na在空气中受热完全转化成转移电子数目为2 B、0.1 溶液中所含的数目小于0.1 C、与反应的过程中涉及离子键、极性共价键和非极性共价键的断裂 D、Al与NaOH溶液的反应中NaOH作氧化剂12. 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
氨气的水溶液能导电
氨气是电解质
B
H—F键能比H—Cl键能大
HF的沸点比HCl高
C
工业合成氨需在高温、高压下才能进行
该反应是吸热反应
D
浓硫酸具有吸水性
可用于、等气体干燥
A、A B、B C、C D、D13. 我国某科研团队设计了一种新型能量存储/转化装置。闭合、断开时,制氢并储能;断开、闭合时,供能。已知与的性质相似。下列说法正确的是( )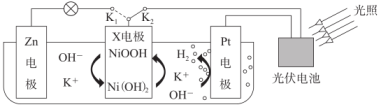 A、连接时,X电极发生还原反应 B、连接时,溶液pH不变 C、连接时,Zn电极表面生成沉淀 D、该装置能直接将光能转化成化学能14. 化合物是一种常见的复合肥,所含的4种元素均为前20号元素,每个周期都有。Y的基态原子价层p轨道半充满,X最常见的同位素没有中子,M在地壳中含量最多。下列说法正确的是( )A、元素电负性:M>Z>X B、简单氢化物的熔点:Z>Y>M C、第一电离能:X>Z>Y D、为极性分子15. 在处理汽车尾气的三元催化剂中,Rh的主要作用是消除 , Pd的主要作用是消除CO,部分催化机理及能量变化如图所示。下列说法不正确的是( )
A、连接时,X电极发生还原反应 B、连接时,溶液pH不变 C、连接时,Zn电极表面生成沉淀 D、该装置能直接将光能转化成化学能14. 化合物是一种常见的复合肥,所含的4种元素均为前20号元素,每个周期都有。Y的基态原子价层p轨道半充满,X最常见的同位素没有中子,M在地壳中含量最多。下列说法正确的是( )A、元素电负性:M>Z>X B、简单氢化物的熔点:Z>Y>M C、第一电离能:X>Z>Y D、为极性分子15. 在处理汽车尾气的三元催化剂中,Rh的主要作用是消除 , Pd的主要作用是消除CO,部分催化机理及能量变化如图所示。下列说法不正确的是( ) A、在NO和CO的整个反应过程中步骤Ⅲ是决速步骤 B、反应进行的三步分别是放热反应、放热反应和吸热反应 C、第一步反应: D、CO能促进NO转化成16. 已知:常温下,碳酸的电离平衡常数 , 。常温下,向20 mL 0.1溶液中缓慢滴加20 mL 0.2盐酸,溶液中各离子的物质的量浓度(不含和)随加入盐酸的体积的变化如图所示。下列说法不正确的是( )
A、在NO和CO的整个反应过程中步骤Ⅲ是决速步骤 B、反应进行的三步分别是放热反应、放热反应和吸热反应 C、第一步反应: D、CO能促进NO转化成16. 已知:常温下,碳酸的电离平衡常数 , 。常温下,向20 mL 0.1溶液中缓慢滴加20 mL 0.2盐酸,溶液中各离子的物质的量浓度(不含和)随加入盐酸的体积的变化如图所示。下列说法不正确的是( ) A、曲线为的物质的量浓度变化曲线 B、滴加至A点时,溶液pH约为10.32 C、滴加至C点时,溶液中 D、滴加至D点时,溶液中存在
A、曲线为的物质的量浓度变化曲线 B、滴加至A点时,溶液pH约为10.32 C、滴加至C点时,溶液中 D、滴加至D点时,溶液中存在二、实验题:共15分
-
17. Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但是固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用进行标定。但是由于与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用与过量的KI反应,定量生成 , 再用Na2S2O3滴定 , 发生反应的化学方程式为:、。我们将这种与联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知:与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
(1)、标准溶液的配制:①配制480 mL 0.1 mol/L的标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、。
②将下述实验步骤A到F按实验过程先后次序排列。
 (2)、标准溶液的标定:取20.00 mL 0.017 mol/L 溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算标准溶液的浓度。
(2)、标准溶液的标定:取20.00 mL 0.017 mol/L 溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算标准溶液的浓度。①用量取220.00 mL 0.017 mol/L 溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是。
③如何判定滴定结束?。
④列式并计算标准溶液的浓度。
溶液
KI溶液
20.00 mL 0.017 mol/L
10 mL 100 g/L
20.35
20.45
20.40
21.20
(3)、借鉴(2)的方法,用碘量法测量溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L 溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用溶液继续滴定至终点。①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?。
②写出溶液与KI反应的离子方程式。
(4)、借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中的物质的量浓度。提出问题:与是可逆反应,的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出与反应的离子方程式:。
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用溶液进行标定,发现消耗的溶液体积相同。
实验小结:是否会影响滴定:。
三、工业流程题:共14分
-
18. 镓(Ga)是重要的半导体材料,氮化镓、砷化镓和氧化镓分别是第二代、第三代、第四代半导体材料的代表材料。金属镓在自然界中通常以微量分散于铝土矿、闪锌矿等矿石中,提取非常困难。从闪锌矿渣中提取镓是种常见的方法,具体工艺流程如下:

已知:①金属镓在化学性质上非常接近金属铝,其单质、氧化物和氢氧化物均有两性;
②闪锌矿渣通常含有 , 、 , 硅酸盐等杂质;
③25℃时,、。
回答下列问题:
(1)、为了提高镓的浸取率,可以采取的措施为(填写一种)。(2)、滤渣Ⅰ中主要含有。(3)、写出加入氧化锌后发生反应的离子方程式(以Ga为例):。(4)、工业上通常向溶液中通入过量 , 产生大量白色沉淀,过滤后加热固体能得到高纯 , 写出加入过量后的化学方程式:。(5)、在工业上,通常用高纯镓作阴极,石墨作阳极,溶液作为电解质,通过电解制备高纯Ga.写出阴极电极反应式:。(6)、氮化镓是目前应用最广泛的半导体材料之一,目前广泛应用于相控阵雷达、快速充电器等行业。氮化镓有不同的晶型,其中六方氮化镓和立方氮化镓之间可以相互转化。
①六方氮化镓晶体硬度极高,熔点为1700℃,其高温熔融物不导电。六方氮化镓属于晶体。
②写出六方氮化镓晶胞的组成:。
(7)、①已知的坐标为 , 请写出的坐标。②若立方氮化镓的边长为a nm,则其密度为(列出计算式)。
四、原理综合题:共13分
-
19. 是重要的化工原料,在生产和生活中都发挥着重要作用。(1)、配合物广泛存在于自然界,其中能与形成深蓝色溶液。
①基态的3d电子轨道表示式为。
②的配位原子是 , 氨气中H—N—H的键角小于配合物中H—N—H的键角,其原因是。
(2)、氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:Ⅰ.
Ⅱ.
①反应 。
②不同温度下氨催化氧化的平衡常数如下();
温度(℃)
300
500
700
900
1100
反应Ⅰ()
6.3×1041
1.1×1026
21×1019
3.8×1015
3.4×1011
反应Ⅱ()
7.3×1056
7.1×1034
2.6×1025
1.5×1020
6.7×1016
下列说法正确的是。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)、已知可通过下列方法合成尿素:第一步:
第二步:在体积为5 L的密闭容器中加入1 mol 和4 mol , 在一定条件下反应进行到10 min时,测得和尿素的物质的量均为0.25 mol,15 min后,测得的物质的量为0.1 mol,如图所示。

①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成(氨基甲酸铵)的平均反应速率为。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是 , 第一步反应的平衡常数(列出算式即可)。
五、有机推断题:共14分
-
20. 莫西赛利(化合物K)是一种治疗心脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。以下为其合成路线之一:

已知:的结构为。
回答下列问题:
(1)、化合物A的名称是。化合物Ⅰ的分子式为。(2)、写出催化E生成化合物G的反应方程式。(3)、根据化合物a的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
①
消去反应
②
水解反应
(4)、下列说法中,不正确的有____。A、反应A→B过程中,有C—Br键和H—O键断裂 B、反应G→I过程中,苯环直接连接的N原子由杂化变成sp杂化 C、产物K中不存在手性碳原子 D、CO属于极性分子,分子中存在由p轨道“头碰头”形成的π键(5)、在B的同分异构体中,同时满足下列条件的共有种(不考虑立体异构):①含有苯环;②苯环上二取代;③遇氯化铁溶液显紫色。
其中,含有手性碳的同分异构体的结构简式为(写出一种)。
-
-
-