2024年广东省深圳市中考化学模拟卷 02
试卷更新日期:2024-04-17 类型:中考模拟
一、单选题
-
1. 化学与我们的身体健康息息相关。下列有关说法中,不合理的是( )A、青少年儿童不能盲目地大量吃各种营养补品 B、变质食品中常含有霉菌毒素,不可食用 C、为了自己和他人的健康,拒绝烟草,远离毒品 D、人体无法消化吸收纤维素,所以食物中的纤维素对人体毫无意义2. 下面关于“2”的含义的解释中,正确的是( )A、Zn2+中的“2+”表示锌元素显正2价 B、2NO中的“2”表示2个一氧化氮分子 C、H2SO4中的“2”表示硫酸含有二个氢原子 D、2Fe中的“2”表示2个铁元素3. 在四个小烧杯中分别盛放下列物质,在空气中放置一段时间后,质量会增加的是( )A、浓硫酸 B、浓盐酸 C、汽水 D、饱和食盐水4. 印刷机的照明光源是镝灯,具有亮度大、体积小、电孤稳定等优点。镝元素的相关信息如图所示,下列有关该元素的说法正确的是( )
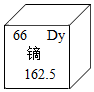 A、属于非金属元素 B、相对原子质量是162.5g C、元素符号是DY D、核外电子数是665. 同学们在完成“电解水实验”时,发现该反应速率较慢,且产物氢气与氧气的体积比很难达到理论值。为探究电解水时所需NaOH溶液的最佳浓度,在图1所示装置中分别注入质量分数为10%、12%、14%、16%、18%、20%的NaOH溶液,在9V电压下电解3min,产生氢气和氧气的体积如图2所示。下列说法正确的是( )
A、属于非金属元素 B、相对原子质量是162.5g C、元素符号是DY D、核外电子数是665. 同学们在完成“电解水实验”时,发现该反应速率较慢,且产物氢气与氧气的体积比很难达到理论值。为探究电解水时所需NaOH溶液的最佳浓度,在图1所示装置中分别注入质量分数为10%、12%、14%、16%、18%、20%的NaOH溶液,在9V电压下电解3min,产生氢气和氧气的体积如图2所示。下列说法正确的是( )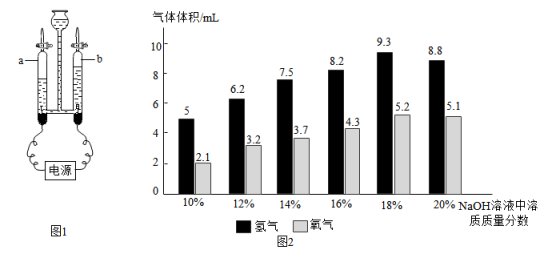 A、管b中产生的气体可做燃料 B、上述反应中原子、分子的种类和数目都不变 C、该实验中氢氧化钠溶液的浓度越大,产生气体的速率越快 D、电解质量分数为14%的NaOH溶液所产生的氢气、氧气体积比最接近理论值6. 麻黄碱(C10H15NO)是部分感冒药的成分,其水溶液pH≈10。因有显著的中枢兴奋作用,是国际奥委会严禁使用的兴奋剂之一。下列有关麻黄碱的叙述正确的是( )
A、管b中产生的气体可做燃料 B、上述反应中原子、分子的种类和数目都不变 C、该实验中氢氧化钠溶液的浓度越大,产生气体的速率越快 D、电解质量分数为14%的NaOH溶液所产生的氢气、氧气体积比最接近理论值6. 麻黄碱(C10H15NO)是部分感冒药的成分,其水溶液pH≈10。因有显著的中枢兴奋作用,是国际奥委会严禁使用的兴奋剂之一。下列有关麻黄碱的叙述正确的是( )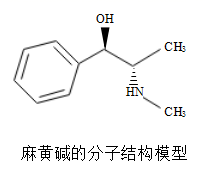 A、麻黄碱由碳、氢、氧、氮四种元素构成 B、麻黄碱是有机高分子化合物,其水溶液能使紫色石蕊溶液变蓝 C、麻黄碱分子中的质子与电子的数目相等 D、麻黄碱分子中氮、氧元素原子的质量比为1:17. 下列对主题知识的归纳,完全正确的是( )
A、麻黄碱由碳、氢、氧、氮四种元素构成 B、麻黄碱是有机高分子化合物,其水溶液能使紫色石蕊溶液变蓝 C、麻黄碱分子中的质子与电子的数目相等 D、麻黄碱分子中氮、氧元素原子的质量比为1:17. 下列对主题知识的归纳,完全正确的是( )选项
主题知识
归纳
A
化学与健康
①食用乳制品、豆制品可补充钙元素
②长期饮用可乐等碳酸饮料不利于健康
B
化学与环境
①为治理雾霾,禁止使用化石燃料
②为节约和环保,分类回收生活垃圾
C
化学与生活
①霉变大米多次淘洗后可以食用
②用灼烧的方法区分羊毛与纯棉织物
D
化学与农业
①用苛性钠治理改良酸性土壤
②科学合理使用化肥能促进粮食增产
A、A B、B C、C D、D8. 含碳元素物质之间发生转化:C→CO2→CO→CO2→CaCO3其中不包括的化学反应类型有( )A、氧化反应 B、化合反应 C、置换反应 D、复分解反应9. 我国科学家研制出在可见光条件下将水和二氧化碳转化为甲烷的复合光催化剂,其催化反应的微观示意图如下。下列说法正确的是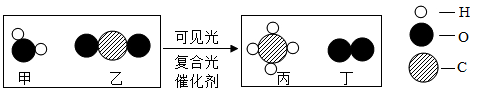 A、参加反应的甲、乙的分子数相等 B、反应前后催化剂的质量和性质不变 C、反应前后氧元素的化合价不变 D、反应后生成物丙、丁的质量比为1:410.
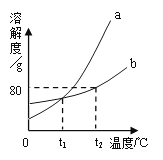
A、参加反应的甲、乙的分子数相等 B、反应前后催化剂的质量和性质不变 C、反应前后氧元素的化合价不变 D、反应后生成物丙、丁的质量比为1:410.如图是a、b两种固体物质的溶解度曲线。下列说法正确的是()
 A、b物质的溶解度大于a物质的溶解度 B、t1℃时,a、b两种物质的溶解度相等 C、t2℃时,100克b物质的溶液中含有80克b物质 D、将t2℃时接近饱和的a溶液变为饱和溶液,可采用升高温度的方法11. 下列操作能达到目的的是( )
A、b物质的溶解度大于a物质的溶解度 B、t1℃时,a、b两种物质的溶解度相等 C、t2℃时,100克b物质的溶液中含有80克b物质 D、将t2℃时接近饱和的a溶液变为饱和溶液,可采用升高温度的方法11. 下列操作能达到目的的是( )选项
目的
操作
A
除去CO中的少量
点燃
B
除去溶液中的少量
加入过量的铁粉,过滤
C
鉴别和
分别加入澄清的石灰水
D
鉴别NaCl溶液和稀盐酸
分别加入无色酚酞溶液
A、A B、B C、C D、D12. 钛合金有良好的耐热强度、低温韧性。生产金属钛的步骤主要有:①在高温下,向金红石(含 TiO2)与焦炭的混合物中通入氯气,得到 TiCl4和一种可燃性气体;②在稀有气体环境和加热条件下,用 Mg 与 TiCl4反应得到 Ti 和 MgCl2。下列说法错误的是( )A、①中的反应为 B、反应②中稀有气体的作用是防止 Mg 与空气反应 C、可用反应①产生的气体冶炼金属 D、反应①、②中的钛元素化合价未发生改变二、实验题
-
13. 根据下图回答问题。
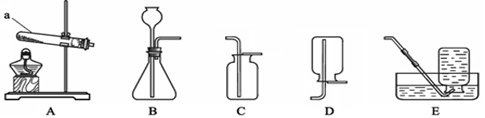 (1)、仪器 a 的名称是 。(2)、实验室用高锰酸钾制取氧气的化学方程式为 , 选用的发生装置是(填字母序号,下同)。可用E装置收集氧气,原因是。若用C装置收集氧气,检验气体已经收集满的方法是。(3)、实验室用大理石(固)和稀盐酸(液)在常温下制取二氧化碳,应选择的发生装置是 , 若用C装置收集二氧化碳,将 放在瓶口,若观察到 , 说明瓶中已充满二氧化碳。
(1)、仪器 a 的名称是 。(2)、实验室用高锰酸钾制取氧气的化学方程式为 , 选用的发生装置是(填字母序号,下同)。可用E装置收集氧气,原因是。若用C装置收集氧气,检验气体已经收集满的方法是。(3)、实验室用大理石(固)和稀盐酸(液)在常温下制取二氧化碳,应选择的发生装置是 , 若用C装置收集二氧化碳,将 放在瓶口,若观察到 , 说明瓶中已充满二氧化碳。三、科学探究题
-
14. 化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图1),同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
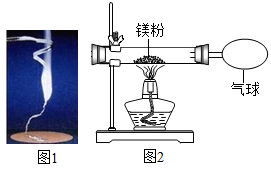 (1)、请写出镁条燃烧的化学方程式:。(2)、同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是。(3)、小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(1)、请写出镁条燃烧的化学方程式:。(2)、同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是。(3)、小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2。
(实验探究)
实验操作
实验现象
实验结论
取少量黄色固体于试管中,加入适量水,把放在试管口
黄色固体是Mg3N2
(4)、(反思与交流)写出氮气和镁反应的化学方程式: , 通过对该反应分析,你对燃烧条件的新认识:。四、流程题
-
15. 某废弃物中可能有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收铜,取样品进行如下图实验。
 (1)、步骤Ⅰ中氧化铜和稀硫酸反应的化学方程式为。(2)、固体B中的物质是 , 步骤Ⅲ中产生的现象是。(3)、若溶液C中只含一种溶质,该溶质为 , 则样品的成分是 , w的值为。(用m和n的代数式表示)
(1)、步骤Ⅰ中氧化铜和稀硫酸反应的化学方程式为。(2)、固体B中的物质是 , 步骤Ⅲ中产生的现象是。(3)、若溶液C中只含一种溶质,该溶质为 , 则样品的成分是 , w的值为。(用m和n的代数式表示)五、综合应用题
-
16. 运用所学知识回答问题(1)、某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8t(溶质质量分数为20%),与足量的废铁屑反应,可生产FeSO4的质量是?(写出计算过程)(2)、实验室用足量大小、形状相同的镁片和铁片分别与相同质量、浓度相同的稀硫酸反应,用数据采集器测得装置内压强随时间的变化关系图(如图)。


已知:相同温度下,装置内压强与产生气体的体积成正比。
①曲线BC段下降的原因是。
②根据图乙可知,充分反应后产生氢气的质量:MgFe(填“>”、“<”或“=”)。
③t4时消耗镁片与铁片的质量比为。
④画出反应中镁片、铁片分别与H2SO4反应生成的氢气的变化随反应时间的大致图像。

-
-
-