2023-2024学年高一下学期期中考试化学模拟卷(二)(人教版)
试卷更新日期:2024-04-15 类型:期中考试
一、单选题
-
1. 下列劳动项目与化学知识关联错误的是( )
选项
劳动项目
化学知识
A
家务劳动:用洁厕灵(主要含浓盐酸)清洗马桶
含氯化合物具有杀菌消毒功能
B
学农活动:用厨余垃圾制肥料
厨余垃圾含N、P、K等元素
C
志愿者服务:“厨房废油制肥皂”爱心暑托班活动
皂化反应
D
自主探究:果蔬电池
原电池原理
A、A B、B C、C D、D2. 下列反应既是氧化还原反应,又是放热反应的是A、Ba(OH)2·8H2O与NH4Cl的反应 B、灼热的炭与CO2的反应 C、铝片与稀硫酸的反应 D、红热的焦炭与水蒸气的反应3. 2021年5月15日,我国火星探测器“天问一号”成功着陆火星。据介绍,该火星车除装有光电转换效率较高的4块太阳电池板外,在其顶部还装有一个像双筒望远镜样子的设备,叫作集热窗,它可以直接吸收太阳能,然后利用一种叫作正十一烷的物质储存能量。白天,火星温度升高,这种物质吸热融化,到了晚上温度下降,这种物质在凝固的过程中释放热能。从上述资料中不能直接得出的结论是( )A、“4块太阳电池板”可将光能转换成电能 B、“集热窗”可将光能转化成化学能储存在化学物质中 C、物质的融化和凝固伴随着能量的变化 D、“天问一号”的动力来源主要是太阳能和氢氧燃料电池4. 下列实验装置能达到实验目的的是( )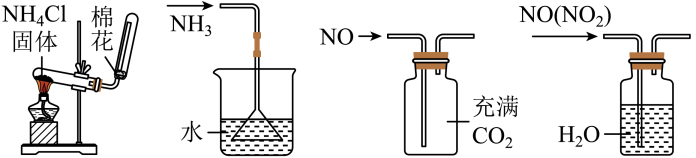 A、制备氨气 B、防止倒吸 C、收集气体 D、除去中的5. 下列有关反应速率的说法中,正确的是( )A、合成氨过程是一个放热反应,所以升高温度,反应速率反而减小 B、等质量的镁粉和镁条与同体积、同浓度的稀硫酸作用,其反应速率相等 C、铝片与硫酸溶液反应可产生氢气,常温下用98%的浓硫酸可以加快生成氢气的速率 D、同温同体积时,浓度大的草酸溶液比浓度较小的使酸化高锰酸钾溶液褪色速度快6. 在一定温度下,反应2HBr(g) H2(g)+Br2(g) △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( )A、减小压强 B、缩小体积 C、降低温度 D、增大氢气的浓度7. 废水脱氮工艺中有一种方法是在废水中加入过量NaClO使 完全转化为 ,该反应可表示为 。下列说法中正确的是( )A、反应中氧化剂和还原剂的物质的量之比为2:3 B、还原性: C、反应中每生成 ,转移 电子 D、经此法处理过的废水需要加生石灰处理后再排放8. 用如图装置分别进行两个实验:①先注入 , 再打开止水夹;②先打开止水夹 , 再将中水注入烧瓶。下列说法正确的是( )
A、制备氨气 B、防止倒吸 C、收集气体 D、除去中的5. 下列有关反应速率的说法中,正确的是( )A、合成氨过程是一个放热反应,所以升高温度,反应速率反而减小 B、等质量的镁粉和镁条与同体积、同浓度的稀硫酸作用,其反应速率相等 C、铝片与硫酸溶液反应可产生氢气,常温下用98%的浓硫酸可以加快生成氢气的速率 D、同温同体积时,浓度大的草酸溶液比浓度较小的使酸化高锰酸钾溶液褪色速度快6. 在一定温度下,反应2HBr(g) H2(g)+Br2(g) △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( )A、减小压强 B、缩小体积 C、降低温度 D、增大氢气的浓度7. 废水脱氮工艺中有一种方法是在废水中加入过量NaClO使 完全转化为 ,该反应可表示为 。下列说法中正确的是( )A、反应中氧化剂和还原剂的物质的量之比为2:3 B、还原性: C、反应中每生成 ,转移 电子 D、经此法处理过的废水需要加生石灰处理后再排放8. 用如图装置分别进行两个实验:①先注入 , 再打开止水夹;②先打开止水夹 , 再将中水注入烧瓶。下列说法正确的是( )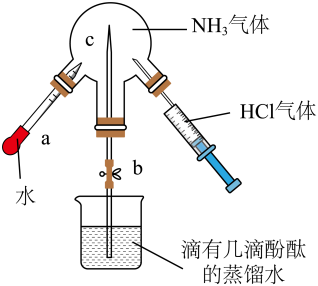 A、实验室可以加热直接制取 B、实验②观察到烧瓶中产生红色的“喷泉” C、实验①先产生白雾,然后观察到喷泉现象 D、实验①后烧瓶中一定存在9. 由下列实验操作及现象得出的结论正确的是( )
A、实验室可以加热直接制取 B、实验②观察到烧瓶中产生红色的“喷泉” C、实验①先产生白雾,然后观察到喷泉现象 D、实验①后烧瓶中一定存在9. 由下列实验操作及现象得出的结论正确的是( )选项
实验操作
现象
结论
A
取5 mL0.11 mol·L-1KI 溶液于试管中,加入1 mL0.1 mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液
溶液变血红色
KI与FeCl3的反应有一定限度
B
向溶液X中滴加少量NaOH稀溶液,将湿润的红色石蕊试纸靠近试管口
石蕊试纸不变蓝
溶液X中肯定不含
C
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中
溶液变黄色
氧化性:H2O2> Fe3+ (酸性条件)
D
向一定浓度的CuSO4溶液中通入适量H2S气体
产生黑色沉淀
H2S的酸性比H2SO4的强
A、A B、B C、C D、D10. 含氯苯的废水可通过加入适量乙酸钠设计成微生物电池,该微生物电池可将氯苯转化为苯而除去,其原理如图所示。下列说法错误的是( ) A、交换膜为阳离子交换膜 B、N极的电极反应式: C、处理后的废水变大 D、M极为正极,发生还原反应11. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应: , 测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
A、交换膜为阳离子交换膜 B、N极的电极反应式: C、处理后的废水变大 D、M极为正极,发生还原反应11. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应: , 测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )编号
表面积/
0min
20min
40min
60min
80min
①
a
2.40
2.00
1.60
1.20
0.80
②
a
1.20
0.80
0.40
x
③
2a
2.40
1.60
0.80
0.40
0.40
A、实验①,0~20min, B、实验②,60min时可能处于平衡状态, C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大12. 向绝热恒容密闭容器(绝热容器指该容器可阻止热量的传递,散失,对流)中通入和 , 在一定条件下发生反应 , 正反应速率随时间变化的示意图如图所示,下列结论中正确的个数为( )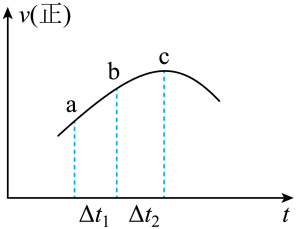
①反应在c点达到反应进行的限度
②浓度:a点小于c点
③逆反应速率图像在此时间段内和图中趋势相同
④ , ab段的消耗量小于bc段的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
A、2个 B、3个 C、4个 D、5个13.对于可逆反应N2(g)+3H2(g)
 2NH3(g) ΔH<0,下列说法正确的是( )A、达到平衡时反应物和生成物浓度一定相等 B、恒温恒压时达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时减小 C、达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以反应向逆反应的方向移动 D、加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率14. 某反应由两步反应构成,其反应能量变化曲线如图所示,下列叙述正确的是( )
2NH3(g) ΔH<0,下列说法正确的是( )A、达到平衡时反应物和生成物浓度一定相等 B、恒温恒压时达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时减小 C、达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以反应向逆反应的方向移动 D、加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率14. 某反应由两步反应构成,其反应能量变化曲线如图所示,下列叙述正确的是( ) A、两步反应均为吸热反应 B、的反应一定需要加热 C、A与C的能量差为 , 发生反应时,会向环境释放能量 D、三种物质中C最不稳定15. 一定温度下,向某容积可变的密闭容器中加入足量碳酸钙,发生反应 , 并达到平衡。下列说法正确的是( )A、保持容器容积不变,充入He,平衡向逆反应方向移动 B、将容器容积增大为原来的2倍,当体系再次达到平衡时,气体密度不变 C、增加的物质的量,平衡向正反应方向移动,的浓度增大 D、将容器容积缩小为原来的一半,当体系再次达到平衡时,的浓度介于原浓度的1倍到2倍之间16.
A、两步反应均为吸热反应 B、的反应一定需要加热 C、A与C的能量差为 , 发生反应时,会向环境释放能量 D、三种物质中C最不稳定15. 一定温度下,向某容积可变的密闭容器中加入足量碳酸钙,发生反应 , 并达到平衡。下列说法正确的是( )A、保持容器容积不变,充入He,平衡向逆反应方向移动 B、将容器容积增大为原来的2倍,当体系再次达到平衡时,气体密度不变 C、增加的物质的量,平衡向正反应方向移动,的浓度增大 D、将容器容积缩小为原来的一半,当体系再次达到平衡时,的浓度介于原浓度的1倍到2倍之间16.对于可逆反应mA(g)+nB(g)⇌pC(g)+qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v﹣t图象.下列判断正确的是( )
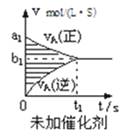
 A、b1>b2 , t1>t2 B、两图中阴影部分面积一定相等 C、A的平衡转化率(Ⅱ)大于(Ⅰ)中A的转化率 D、若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
A、b1>b2 , t1>t2 B、两图中阴影部分面积一定相等 C、A的平衡转化率(Ⅱ)大于(Ⅰ)中A的转化率 D、若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大二、非选择题
-
17.
Ⅰ对于4FeS2+11O2═2Fe2O3+8SO2 , 试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率
(2)为了提高生成SO2的速率,可以采取的措施是
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
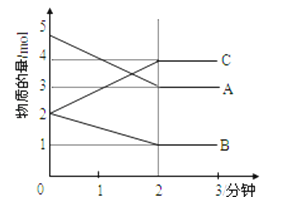
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
(3)该反应的化学方程式为
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化.
 18. 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.
18. 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.请回答下列问题:
 (1)、加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .(2)、关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.(3)、读取量气管读数时,要先 , 然后再读取读数.(4)、数据分析:①从B中取20mL溶液,恰好中和用去0.1mol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 .
(1)、加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .(2)、关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.(3)、读取量气管读数时,要先 , 然后再读取读数.(4)、数据分析:①从B中取20mL溶液,恰好中和用去0.1mol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 .②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为 .
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.
19. 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如图所示。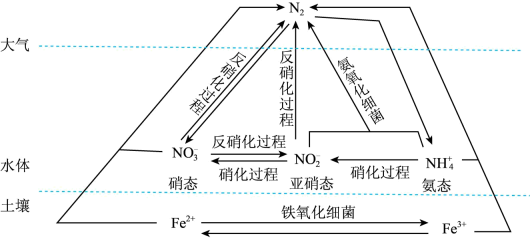 (1)、图中所示氮循环中,属于氮的固定的有____(填字母序号)。A、转化为的过程 B、转化为的过程 C、转化为的过程 D、转化为的过程(2)、氮肥是水体中氨态氮的主要来源之一,检验氨态氮肥中的实验方法是。(3)、反硝化过程中,含氮物质发生(填“氧化”或“还原”)反应。(4)、在氨氧化细菌的作用下,与可以转化为氮气。该反应中,当产生0.1mol氮气时,转移的电子的物质的量为mol。(5)、土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素转化为气体从水体中除去)。
(1)、图中所示氮循环中,属于氮的固定的有____(填字母序号)。A、转化为的过程 B、转化为的过程 C、转化为的过程 D、转化为的过程(2)、氮肥是水体中氨态氮的主要来源之一,检验氨态氮肥中的实验方法是。(3)、反硝化过程中,含氮物质发生(填“氧化”或“还原”)反应。(4)、在氨氧化细菌的作用下,与可以转化为氮气。该反应中,当产生0.1mol氮气时,转移的电子的物质的量为mol。(5)、土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素转化为气体从水体中除去)。①酸性条件下,脱除水体中硝态氮(NH4+)的原理为 , 该反应中氧化产物与还原产物的物质的量之比为。
②酸性条件下,脱除水体中硝态氮()生成的离子方程式为。
20. 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。(1)、Fe还原水体中NO3-的反应原理如图所示。
①作负极的物质是。
②正极的电极反应式是。
(2)、将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:初始pH
pH=2.5
pH=4.5
NO3-的去除率
接近100%
<50%
24小时pH
接近中性
接近中性
铁的最终物质形态


pH=4.5时,NO3-的去除率低。其原因是。
(3)、其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:初始pH
pH=2.5
pH=4.5
NO3-的去除率
约10%
约3%
1小时pH
接近中性
接近中性
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:。