2023-2024学年高一下学期期中考试化学模拟卷(一)(人教版)
试卷更新日期:2024-04-15 类型:期中考试
一、单选题
-
1. 我国在探索太空、开发深海、建设高铁、5G技术等方面取得举世瞩目的成就,这些成就与化学有着密切联系。下列说法正确的是( )A、航天服壳体使用的铝合金材料熔点比纯铝高 B、打印机墨粉中常加有Fe3O4 , 这是利用了其颜色和磁性特点,可用CuO替代Fe3O4 C、华为5G手机芯片的主要成分是二氧化硅 D、中国天眼FAST用到的高性能碳化硅是一种新型的无机非金属材料2. 下列有关物质的性质与用途具有对应关系的是( )A、ClO2具有强氧化性,可用于消毒杀菌 B、浓硫酸具有脱水性,可用于干燥气体 C、铝具有良好导热性,可用铝罐贮运浓硝酸 D、FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂3. 实验室进行含硫化合物性质探究的装置(夹持装置省略)如图所示,分液漏斗①中盛有浓硫酸,将其逐滴加入到试管②的固体中。下列说法正确的是( )
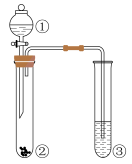 A、若②中为固体,③中盛石蕊溶液,则③中溶液先变红后褪色 B、若②中为蔗糖,③中盛有溴水,能说明浓硫酸具有脱水性和氧化性 C、若②中为固体,③中盛有氯化钡溶液,则③中生成白色沉淀 D、若②中为铜单质,③中盛有硫化氢水溶液,则③中生成黄色沉淀4. a、b两个烧杯中均盛有过量的稀 , 将等质量的两份锌粉分别加入两个烧杯中,同时向a中加入少量溶液,下列产生氢气的体积(V)与时间(t)的关系正确的是( )A、
A、若②中为固体,③中盛石蕊溶液,则③中溶液先变红后褪色 B、若②中为蔗糖,③中盛有溴水,能说明浓硫酸具有脱水性和氧化性 C、若②中为固体,③中盛有氯化钡溶液,则③中生成白色沉淀 D、若②中为铜单质,③中盛有硫化氢水溶液,则③中生成黄色沉淀4. a、b两个烧杯中均盛有过量的稀 , 将等质量的两份锌粉分别加入两个烧杯中,同时向a中加入少量溶液,下列产生氢气的体积(V)与时间(t)的关系正确的是( )A、 B、
B、 C、
C、 D、
D、 5. 化学电源在日常生活和高科技领域中都有广泛应用,下列说法不正确的是
5. 化学电源在日常生活和高科技领域中都有广泛应用,下列说法不正确的是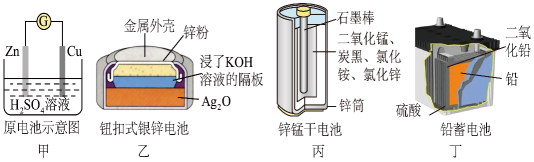 A、乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH- B、甲:溶液中Zn2+向Cu电极方向移动,电子由锌经电解质溶液流向铜电极 C、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 D、丙:锌筒作负极,发生氧化反应,锌筒会变薄6. 利用反应 构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是
A、乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH- B、甲:溶液中Zn2+向Cu电极方向移动,电子由锌经电解质溶液流向铜电极 C、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 D、丙:锌筒作负极,发生氧化反应,锌筒会变薄6. 利用反应 构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是 A、电流从左侧电极经过负载后流向右侧电极 B、电极A极反应式为 C、为使电池持续放电,离子交换膜需选用阴离子交换膜 D、当有 被处理时,转移电子数为7. 科学家用X射线激光技术观察CO与O在催化剂表面形成化学键的过程,如图所示:
A、电流从左侧电极经过负载后流向右侧电极 B、电极A极反应式为 C、为使电池持续放电,离子交换膜需选用阴离子交换膜 D、当有 被处理时,转移电子数为7. 科学家用X射线激光技术观察CO与O在催化剂表面形成化学键的过程,如图所示:
下列说法错误的是( )
A、在该过程中,CO断键形成C和O B、CO和O生成了具有极性共价键的CO2 C、CO和O生成CO2是放热反应 D、催化剂可加快该反应的速率8. 甲烷燃料电池以铂为电极、KOH溶液为电解质溶液,在两极区分尉通入甲烷和氧气即可产生电流.下列叙述正确的是( )A、通入甲烷的电极为正极 B、电池工作一段时间后,溶液的碱性增强 C、负极的电极反应:CH4+l0OH﹣﹣8e﹣=CO32﹣+7H2O D、通入甲烷的电极的电极反应:O2+2H2O+4e﹣=4OH﹣9. 某溶液可能含有Al3+、NH、Fe2+、Na+、CO、SO、Cl-、NO中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对溶液进行如图实验,下列结论正确的是(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)( )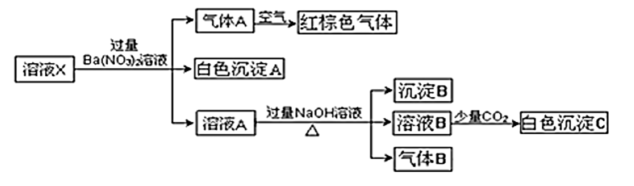 A、原溶液中一定存在NH、Fe2+、SO B、原溶液中可能含有NO和Al3+ C、白色沉淀C可能是Al(OH)3 D、沉淀B可能是Fe(OH)2和Fe(OH)3的混合物10. 一定条件下,在的密闭容器中,X、Y、Z三种气体发生可逆反应的反应。反应过程中测得各气体的物质的量随时间的变化如图所示。下列说法正确的是( )
A、原溶液中一定存在NH、Fe2+、SO B、原溶液中可能含有NO和Al3+ C、白色沉淀C可能是Al(OH)3 D、沉淀B可能是Fe(OH)2和Fe(OH)3的混合物10. 一定条件下,在的密闭容器中,X、Y、Z三种气体发生可逆反应的反应。反应过程中测得各气体的物质的量随时间的变化如图所示。下列说法正确的是( ) A、该反应达到平衡状态的时间是 B、用Y表示内该反应的平均速率为 C、第末,X的转化率为90% D、该反应的化学方程式为11. 反应NH4HS(s) NH3(g)+H2S(g)在某一温度下达到平衡,下列各种情况中,能使化学平衡正向移动的是( )A、加入NH4HS固体 B、压强、温度不变,充入少量氩气 C、容积、温度一定,充入氦气 D、温度、容积一定,充入H2S气体12. 下列图示与对应的叙述一定正确的是( )
A、该反应达到平衡状态的时间是 B、用Y表示内该反应的平均速率为 C、第末,X的转化率为90% D、该反应的化学方程式为11. 反应NH4HS(s) NH3(g)+H2S(g)在某一温度下达到平衡,下列各种情况中,能使化学平衡正向移动的是( )A、加入NH4HS固体 B、压强、温度不变,充入少量氩气 C、容积、温度一定,充入氦气 D、温度、容积一定,充入H2S气体12. 下列图示与对应的叙述一定正确的是( ) A、图1所示反应:X(g) +Y(g) 2Z(g),曲线b一定是增大了反应体系的压强。 B、图2 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 C、图3 表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质最变化 D、图4 表示明矾溶液受热时氢氧根离子浓度随温度的变化13. 我国科学家最近发明了一种电池,电解质为、和KOH,通过a和b两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如下。下列说法不正确的是( )
A、图1所示反应:X(g) +Y(g) 2Z(g),曲线b一定是增大了反应体系的压强。 B、图2 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 C、图3 表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质最变化 D、图4 表示明矾溶液受热时氢氧根离子浓度随温度的变化13. 我国科学家最近发明了一种电池,电解质为、和KOH,通过a和b两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如下。下列说法不正确的是( ) A、a为阳离子交换膜、b为阴离子交换膜 B、电子由Zn电极经过外电路流向电极 C、放电时,Zn电极反应为 D、消耗6.5gZn的同时,电极理论上应增重3.2g14. 反应 , 在200℃和℃时,X的物质的量浓度(单位:mol·L)
A、a为阳离子交换膜、b为阴离子交换膜 B、电子由Zn电极经过外电路流向电极 C、放电时,Zn电极反应为 D、消耗6.5gZn的同时,电极理论上应增重3.2g14. 反应 , 在200℃和℃时,X的物质的量浓度(单位:mol·L)随时间变化的有关实验数据见下表:
时间/min
0
2
4
6
8
10
200℃
1.60
1.10
0.70
0.40
0.30
0.30
t℃
2.00
1.30
0.70
0.36
0.36
0.36
下列有关该反应的描述正确的是( )
A、在200℃时,4 min内用Y表示的化学反应速率为 B、t℃下,6 min时反应刚好达到平衡状态 C、根据上表内X的浓度变化,可知浓度越大,反应速率越大 D、从表中可以看出15. CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( ) A、反应开始2分钟内平均反应速率最大 B、反应4分钟后平均反应速率最小 C、反应开始4分钟内温度对反应速率的影响比浓度大 D、反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小16. 某学习小组为探究传统的Al—空气—海水电池,设计了如图所示的实验装置。该电池工作时,下列说法正确的是( )
A、反应开始2分钟内平均反应速率最大 B、反应4分钟后平均反应速率最小 C、反应开始4分钟内温度对反应速率的影响比浓度大 D、反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小16. 某学习小组为探究传统的Al—空气—海水电池,设计了如图所示的实验装置。该电池工作时,下列说法正确的是( )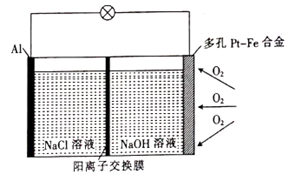 A、多孔Pt—Fe合金电极有利于吸附O2 B、负极的电极反应式为 C、若反应中消耗5.4 g Al,则消耗3.36 L O2 D、当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
A、多孔Pt—Fe合金电极有利于吸附O2 B、负极的电极反应式为 C、若反应中消耗5.4 g Al,则消耗3.36 L O2 D、当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜二、填空题
-
17. 完成下列填空。(1)、已知A、B、C、D为气体,其中A、B为单质,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
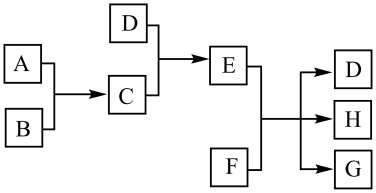
请回答下列问题:
①C的化学式是 , D的电子式为。
②如何检验E溶液中阳离子?。
(2)、在高压下,NO在下分解生成两种化合物,体系中各组分的物质的量随时间变化曲线如图甲所示。NO分解的化学方程式为。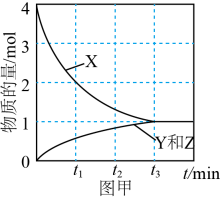 (3)、有色金属提取工艺中会产生大量含氰(CN·)废水,对环境造成了极大的负担。在碱性条件下可用ClO-将其氧化成和写出反应的离子方程式:。(4)、向酸性废水中加入NaClO,消除污染。写出相应的离子方程式为。(5)、将软锰矿与硫铁矿粉碎混合,用硫酸浸取。研究发现,酸浸时,和颗粒构成两个原电池反应,其原理如图所示(部分产物未标出)。
(3)、有色金属提取工艺中会产生大量含氰(CN·)废水,对环境造成了极大的负担。在碱性条件下可用ClO-将其氧化成和写出反应的离子方程式:。(4)、向酸性废水中加入NaClO,消除污染。写出相应的离子方程式为。(5)、将软锰矿与硫铁矿粉碎混合,用硫酸浸取。研究发现,酸浸时,和颗粒构成两个原电池反应,其原理如图所示(部分产物未标出)。
若原电池中生成单质S,其反应的离子方程式为。
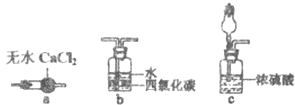
18.某小组同学欲探究NH3催化氧化反应,按下图装置进行实验.
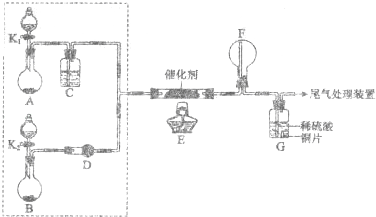
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2
(1)NH3催化氧化的化学方程式是 ;
(2)装置B中产生气体的原因有(结合化学用语解释) ;
(3)甲乙两同学分别按上述装置进行实验.一段时间后,装置G中溶液都变成蓝色.
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是 ;
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式) ;
③用离子方程式解释装置G中溶液变成蓝色的原因: ;
(4)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进.
①甲认为可调节K1和K2控制A、B装置中的产气量,应(填“增加”或“减少”) 装置A中的产气量,或(填“增加”或“减少”) 装置B中的产气量.
②乙认为可在装置E、F间增加一个装置,该装置可以是(填序号)
 19. 研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
19. 研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。 (1)、反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
(1)、反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。①该反应为(填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是。
③若要使该反应的反应速率加快,下列措施可行的是(填字母)。
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)、若将上述反应设计成原电池,装置如图3所示。
①铜为(填“正”或“负”)极;负极的电极反应式为。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是L。
20.(1)下列反应属于吸热反应的是
A.C6H12O6(葡萄糖)+6O2═6CO2+6H2O
B.CH3COOH+KOH═CH3COOK+H2O
C.大多数化合反应
D.破坏生成物全部化学键所需能量小于破坏反应物全部化学键的能量
E.Ba(OH)2•8H2O晶体与NH4Cl晶体反应
F.金属与酸或水的反应
(2)在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)⇌C(g)+D(g),能表明反应已达平衡状态的是
A.混合气体的压强不变
B.混合气体的密度不变
C.单位时间内生成n molC的同时生成n mol D
D.气体总物质的量不变
E.A的物质的量不再变化
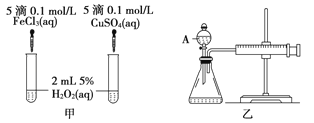
(3)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察 来定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为 , 实验中需要测量的数据是 . 检查乙装置气密性的方法是 .