重庆市开州区文峰教育集团2023-2024学年九年级下学期3月月考化学试题
试卷更新日期:2024-04-12 类型:月考试卷
一、选择题(本大题包括16个小题,每小题2分,共32分)每小题只有一个选项符合题意。
-
1. 2022年4月16日,神舟十三号飞船返回舱在东风着陆场成功着陆。返回过程中下列活动一定涉及化学变化的是( )A、站船分离 B、外壳烧焦 C、自由落体 D、抛降落伞2. 下列物质属于溶液的是( )A、牛奶 B、豆浆 C、米粥 D、汽水3. 下列有关水的说法正确的是( )A、可用肥皂水鉴别硬水和软水 B、生活污水可以随意排放 C、水是一种良好的溶剂,能溶解所有物质 D、淡水资源是取之不尽的4. 下列认识和描述正确的是( )A、分子、原子、离子、元素都能构成物质 B、原子核一定是由质子和中子构成 C、与元素化学性质关系最密切的是原子的核外电子数 D、原子是化学变化中的最小粒子5. 分类是化学学习中常用的思维方法,下列有关物质分类正确的是( )A、合金:黄铜、青铜、氧化铜 B、氧化物:干冰、二氧化锰、氧化铁 C、混合物:空气、石油、碳酸钙 D、地壳中元素含量由高到低:氧、硅、铁、铝6. 溶液的知识广泛应用于生产生活。下列说法正确的是( )A、植物油加入水中可得到溶液 B、氯化钠溶于水温度明显上升 C、洗涤剂去油污的原理是溶解 D、溶液是均一的、稳定的混合物7. 根据如下微观示意图分析,结论正确的是( )
 A、该反应为置换反应 B、生成物都是由分子构成 C、参加反应的两种物质的化学计量数之比为2:1 D、反应物、生成物中共有三种氧化物8. 下列有关溶液的叙述,正确的是( )A、饱和溶液的浓度一定比其不饱和溶液的浓度大 B、同一温度下,分别将两份不同质量的KCl饱和溶液恒温蒸发掉10g水,析出晶体的质量不一定相等 C、饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小 D、某物质的饱和溶液变为不饱和溶液,溶质的质量分数不一定变小9. 结合下列图示或符号,有关说法正确的是( )A、Al2O3氧化铝中铝元素的化合价为+2 B、2H:表示两个氢元素 C、
A、该反应为置换反应 B、生成物都是由分子构成 C、参加反应的两种物质的化学计量数之比为2:1 D、反应物、生成物中共有三种氧化物8. 下列有关溶液的叙述,正确的是( )A、饱和溶液的浓度一定比其不饱和溶液的浓度大 B、同一温度下,分别将两份不同质量的KCl饱和溶液恒温蒸发掉10g水,析出晶体的质量不一定相等 C、饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小 D、某物质的饱和溶液变为不饱和溶液,溶质的质量分数不一定变小9. 结合下列图示或符号,有关说法正确的是( )A、Al2O3氧化铝中铝元素的化合价为+2 B、2H:表示两个氢元素 C、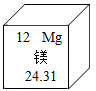 镁原子的相对原子质量是24.31
D、
镁原子的相对原子质量是24.31
D、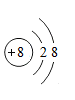 该粒子是阳离子
10. 如图为了测定金属活动性强弱,向打磨过的金属X和金属Y上滴加不同溶液,金属X上①②处均有明显现象,金属Y仅④处有明显现象。据此可以判断金属X、金属Y、铁、银的活动性从强到弱分别为( )
该粒子是阳离子
10. 如图为了测定金属活动性强弱,向打磨过的金属X和金属Y上滴加不同溶液,金属X上①②处均有明显现象,金属Y仅④处有明显现象。据此可以判断金属X、金属Y、铁、银的活动性从强到弱分别为( ) A、X、Fe、Ag、Y B、Y、Fe、X、Ag C、X、Fe、Y、Ag D、Y、Fe、Ag、X11. 端午节是我国的传统节日,民间有挂艾草的习俗。艾草中含有丰富的黄酮素(C15H10O2),其药用价值非常高。下列关于黄酮素说法正确的是( )A、黄酮素分子由碳、氢、氧三种元素组成 B、黄酮素由15个碳原子、10个氢原子和2个氧原子构成 C、黄酮素的相对分子质量为222g D、黄酮素中氢元素的质量分数为4.5%12. 下列实验不能达到目的的是( )
A、X、Fe、Ag、Y B、Y、Fe、X、Ag C、X、Fe、Y、Ag D、Y、Fe、Ag、X11. 端午节是我国的传统节日,民间有挂艾草的习俗。艾草中含有丰富的黄酮素(C15H10O2),其药用价值非常高。下列关于黄酮素说法正确的是( )A、黄酮素分子由碳、氢、氧三种元素组成 B、黄酮素由15个碳原子、10个氢原子和2个氧原子构成 C、黄酮素的相对分子质量为222g D、黄酮素中氢元素的质量分数为4.5%12. 下列实验不能达到目的的是( ) A、验证硝酸铵溶解时吸热 B、测定空气中氧气含量 C、除去粗盐中难溶性杂质 D、探究可燃物燃烧需达到着火点13. 除去下列物质中混有的杂质,所用试剂和操作方法不正确的是( )
A、验证硝酸铵溶解时吸热 B、测定空气中氧气含量 C、除去粗盐中难溶性杂质 D、探究可燃物燃烧需达到着火点13. 除去下列物质中混有的杂质,所用试剂和操作方法不正确的是( )物质
所含杂质
除杂质选用的试剂或方法
A
CaCl2溶液
HCl
加入过量CaCO3并过滤
B
CuO
C
在氧气流中加热
C
CO2
CO
在氧气中点燃
D
KCl
MnO2
加入足量的水溶解并过滤、蒸发结晶
A、A B、B C、C D、D14. 化学中常常出现“1+1≠2”的有趣现象,但也有例外。下列说法中符合“1+1=2”事实的是( )A、10L酒精与10L水混合后的体积等于20L B、10g硫粉在10g氧气中完全燃烧后生成20g二氧化硫 C、10g锌片与10g稀硫酸充分反应后所得的溶液质量为20g D、某氧原子核内有8个质子和8个中子,该原子的核外电子数为1615. 推理和归纳是学习化学的重要方法。以下推理正确的是( )A、催化剂在化学反应前后质量不变,所以反应前后质量不变的物质一定是催化剂 B、置换反应有单质生成,所以有单质生成的反应一定是置换反应 C、单质一定由同种元素组成,所以由同种元素组成的物质一定是单质 D、同种元素原子的质子数相同,所以质子数相同的原子一定属于同种元素16. 下列四个图象中,能正确反映对应变化关系的是( )A、向一定量硝酸铜、硝酸银的混合溶液中缓慢连续加锌粉 B、某温度时,向一定量的饱和石灰水中加入少量生石灰
B、某温度时,向一定量的饱和石灰水中加入少量生石灰 C、向两份完全相同的稀盐酸中分别加入足量锌粉、镁粉
C、向两份完全相同的稀盐酸中分别加入足量锌粉、镁粉 D、将水通电一段时间
D、将水通电一段时间
二、填空题(本大题包括5个小题,共21分)
-
17. 用化学用语填空。(1)、碘酒用于预防皮肤感染和消毒,其中的溶剂是。(2)、食盐水具有一定的消毒和杀菌作用,其溶质是由微粒构成的。(3)、铁与空气中的同时接触易生锈。(4)、工业冶炼赤铁矿石(用化学方程式表示)。18. 某反应的表达式为:X(单质)+Y(化合物)→甲(单质)+乙(化合物),完成下列填空。(1)、该反应的基本反应类型是反应。(2)、若Y的溶液为蓝色,甲为红色固体单质,其反应的方程式可能为。(3)、若X为黑色固体,Y为红色固体,甲是年产量最高的金属,则X的化学式为 , 该反应的方程式是。19. 金属非常宝贵的自然资源,请回答下列问题。(1)、黄铜是一种常见的铜合金,主要成分为铜和锌,其熔点(填“高于”、“低于”或“等于”)铜或锌的熔点。(2)、实验室某废液的溶质为硝酸铜、硝酸银,取该废液进行如图1所示实验。

若实验所得滤液为蓝色,则滤液中一定含有的溶质是 , 滤渣中一定有。写出实验中一定发生的反应的化学方程式。
(3)、一定质量的M、N两种金属。分别与相同质量和相同质量分数的稀硫酸反应,生成氢气的质量与反应时间的关系如图2所示。分析图象得到的以下结论中,正确的是____。A、消耗金属的质量:M=N B、两种金属生成氢气的质量:M=N C、两种金属消耗稀硫酸的质量:M=N D、充分反应后,得到溶液的质量:M=N20. 中国向世界宣布了2030年前实现“碳达峰”,2060年前实现“碳中和”的目标。(1)、大气中的CO2过多会引起效应。(2)、要实现“碳中和”,需要减少煤、石油和等化石燃料的使用。(3)、以CO2和物质X合成尿素【CO(NH2)2】是固定和利用CO2的成功范例,该反应的化学方程式为: , 则X的化学式为。(4)、电动汽车的使用可减少大气中二氧化碳含量,LiCoO2是电动车的锂电池常用的正极材料之一,已知Li元素的化合价为+1,则LiCoO2中Co元素的化合价为。21. 甲、乙、丙三种物质的溶解度曲线如图所示,请回答。 (1)、P点的含义是。(2)、气体的溶解度随温度变化的趋势与(填“甲”、“乙”或“丙)相似。(3)、t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为g。(4)、将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,对所得溶液的分析正确的是____(填字母序号)。A、溶剂质量:丙>乙>甲 B、溶液质量:丙>乙>甲 C、溶质质量分数:乙>甲>丙
(1)、P点的含义是。(2)、气体的溶解度随温度变化的趋势与(填“甲”、“乙”或“丙)相似。(3)、t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为g。(4)、将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,对所得溶液的分析正确的是____(填字母序号)。A、溶剂质量:丙>乙>甲 B、溶液质量:丙>乙>甲 C、溶质质量分数:乙>甲>丙三、实验题(本大题包括2个小题,共11分)
-
22. 溶液对动植物的生理活动和人类的生产、科研活动具有重要意义。室温下,某同学欲配制50g质量分数为10%的氯化钠溶液,请回答下列问题:

 (1)、计算:需要氯化钠固体的质量是g。(2)、称量:①用如图所示的序号表示正确配制该溶液的操作顺序为。
(1)、计算:需要氯化钠固体的质量是g。(2)、称量:①用如图所示的序号表示正确配制该溶液的操作顺序为。②用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是(从下列中选用:10mL、50mL、100mL)。
③用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应。
A.增加适量氯化钠固体 B.减少适量氯化钠固体
C.调节游码 D.添加砝码
(3)、溶解:将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是。(4)、反思:经检测,所配制氯化钠溶液的溶质质量分数偏小,其原因可能是 。 (填序号)①用量筒量取水时,俯视读数 ②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取水时,仰视读数 ④用于溶解的烧杯中有少量的蒸馏水
⑤转移溶液时有部分体溅出
23. 如图为实验室常见的气体制备、收集和性质探究的实验装置,据图回答。 (1)、实验室用大理石与稀盐酸反应制取CO2 , 应选择的装置是 , 反应的化学方程式是。(2)、实验室用加热氯化铵和氢氧化钙固体混合物的方法制取氨气。为探究氨气的性质,小红利用图中F装置进行氨气与氧化铜反应的实验,实验中观察到黑色氧化铜粉末变成红色。
(1)、实验室用大理石与稀盐酸反应制取CO2 , 应选择的装置是 , 反应的化学方程式是。(2)、实验室用加热氯化铵和氢氧化钙固体混合物的方法制取氨气。为探究氨气的性质,小红利用图中F装置进行氨气与氧化铜反应的实验,实验中观察到黑色氧化铜粉末变成红色。【提出问题】得到的红色粉末是什么?
查阅资料:Cu2O是红色,易与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O
【猜想假设】红色粉末是①Cu;②Cu2O;③。
(3)、【设计实验】小明设计如下实验验证红色粉末中是否含有Cu2O:实验步骤
实验现象
实验结论
取红色粉末于试管中,加入足量稀硫酸
红色粉末中含有Cu2O
(4)、【实验反思】小明设计的实验无法证明红色粉末中是否含有Cu,原因是。四、计算题(本大题包括1个小题,共6分)
-
24. 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某工厂用152kgNH4SCN固体、282kg一定溶质质量分数的KOH溶液为原料制取KSCN,反应恰好完全,方程式为: ,假设生成的气体全部逸出。试计算:(1)、NH4SCN中硫和碳元素的质量比为(填最简整数比)。(2)、反应后所得溶液的溶质质量分数是多少?(3)、为将所得溶液的浓度稀释到40%,需加水的质量。