广西柳州市第十五中学2023-2024学年九年级下学期3月阶段性检测化学试题
试卷更新日期:2024-04-12 类型:月考试卷
一、选择题(本大题共20小题,每小题2分,共40分。每小题有四个选项,其中只有一个选项符合题意,请用2B铅笔在答题卡上将选定的选项标号涂黑)
-
1. 空气中含量最多的气体是( )A、氮气 B、氧气 C、二氧化碳 D、稀有气体2. 如图所示的图标表示( )
 A、禁止吸烟 B、节约用水 C、当心火灾 D、禁止燃放鞭炮3. 下列化肥中,属于磷肥的是( )A、 B、 C、K2CO3 D、Ca3(PO4)24. 把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )A、面粉 B、牛奶 C、白糖 D、花生油5. 垃圾分类,从我做起。下列可回收垃圾属于金属材料的是( )A、玻璃瓶 B、废纸箱 C、塑料袋 D、易拉罐6. 下列物质属于纯净物的是( )A、蒸馏水 B、汽水 C、果汁 D、奶茶7. 下列物质在氧气中燃烧,产生蓝紫色火焰的是( )A、红磷 B、木炭 C、硫磺 D、铁丝8. 下列实验基本操作不正确的是( )A、取用固体药品
A、禁止吸烟 B、节约用水 C、当心火灾 D、禁止燃放鞭炮3. 下列化肥中,属于磷肥的是( )A、 B、 C、K2CO3 D、Ca3(PO4)24. 把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )A、面粉 B、牛奶 C、白糖 D、花生油5. 垃圾分类,从我做起。下列可回收垃圾属于金属材料的是( )A、玻璃瓶 B、废纸箱 C、塑料袋 D、易拉罐6. 下列物质属于纯净物的是( )A、蒸馏水 B、汽水 C、果汁 D、奶茶7. 下列物质在氧气中燃烧,产生蓝紫色火焰的是( )A、红磷 B、木炭 C、硫磺 D、铁丝8. 下列实验基本操作不正确的是( )A、取用固体药品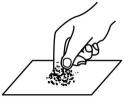 B、读取液体体积
B、读取液体体积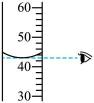 C、二氧化碳的验满
C、二氧化碳的验满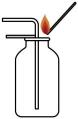 D、倾倒液体
D、倾倒液体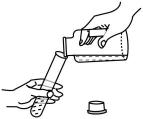 9. 《汉书》记载:交趾有甘蔗,榨取汁,曝数时成饴,入口消释,彼人谓之石蜜。“石蜜”主要的成分是( )A、糖类 B、蛋白质 C、维生素 D、油脂10. “加强防范意识,守护生命安全”。下列做法不符合安全要求的是( )A、家用电器着火时直接用水浇灭 B、发生火灾时,用湿毛巾捂住口鼻逃生 C、加油站、面粉加工厂严禁烟火 D、图书档案着火,用二氧化碳灭火器扑灭11. 智能燃气灶在发生干烧时会自动关闭燃气阀门,其灭火原理为( )A、隔离可燃物 B、隔绝空气 C、降低温度 D、降低燃气的着火点12. 城市因水而灵动,南宁因江而秀美。下列关于水的说法错误的是( )A、水中加入明矾可使悬浮杂质沉降 B、可用肥皂水鉴别硬水和软水 C、江水经杀菌消毒后即可变成纯水 D、水中有异味时可加入活性炭除味13. 下列有关物质用途,错误的是( )A、铜作导线 B、一氧化碳用于人工降雨 C、稀有气体作电光源 D、生石灰作食品干燥剂14. 取四朵用石蕊溶液染成紫色的干燥纸花,进行如下图所示的实验。有关此实验的说法正确( )
9. 《汉书》记载:交趾有甘蔗,榨取汁,曝数时成饴,入口消释,彼人谓之石蜜。“石蜜”主要的成分是( )A、糖类 B、蛋白质 C、维生素 D、油脂10. “加强防范意识,守护生命安全”。下列做法不符合安全要求的是( )A、家用电器着火时直接用水浇灭 B、发生火灾时,用湿毛巾捂住口鼻逃生 C、加油站、面粉加工厂严禁烟火 D、图书档案着火,用二氧化碳灭火器扑灭11. 智能燃气灶在发生干烧时会自动关闭燃气阀门,其灭火原理为( )A、隔离可燃物 B、隔绝空气 C、降低温度 D、降低燃气的着火点12. 城市因水而灵动,南宁因江而秀美。下列关于水的说法错误的是( )A、水中加入明矾可使悬浮杂质沉降 B、可用肥皂水鉴别硬水和软水 C、江水经杀菌消毒后即可变成纯水 D、水中有异味时可加入活性炭除味13. 下列有关物质用途,错误的是( )A、铜作导线 B、一氧化碳用于人工降雨 C、稀有气体作电光源 D、生石灰作食品干燥剂14. 取四朵用石蕊溶液染成紫色的干燥纸花,进行如下图所示的实验。有关此实验的说法正确( )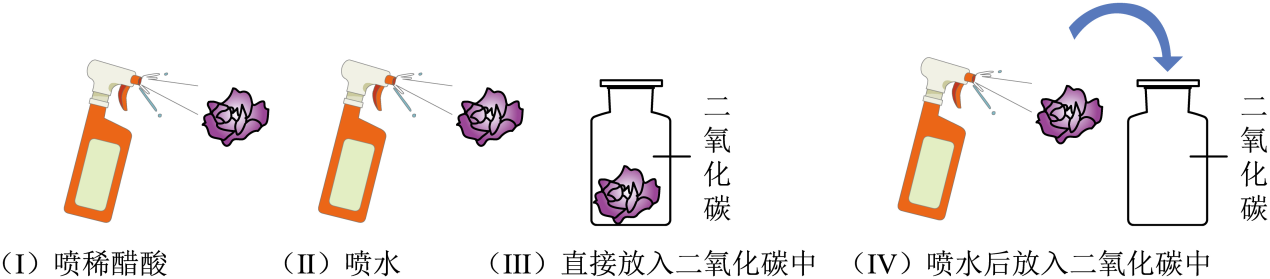 A、只有实验Ⅳ中的紫色石蕊纸花会变红 B、实验Ⅳ就能说明二氧化碳与水发生了反应 C、实验Ⅳ中,对比小花放入集气瓶前后的现象,可以不做实验Ⅲ D、对比实验Ⅱ、Ⅳ可知紫色石蕊纸花变红是因为生成了酸性物质15. 晋代葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银”,丹砂指的是HgS。该反应的微观示意图如下。下列说法不正确的是( )
A、只有实验Ⅳ中的紫色石蕊纸花会变红 B、实验Ⅳ就能说明二氧化碳与水发生了反应 C、实验Ⅳ中,对比小花放入集气瓶前后的现象,可以不做实验Ⅲ D、对比实验Ⅱ、Ⅳ可知紫色石蕊纸花变红是因为生成了酸性物质15. 晋代葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银”,丹砂指的是HgS。该反应的微观示意图如下。下列说法不正确的是( )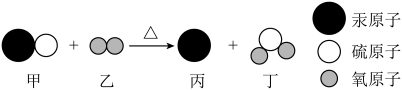 A、该反应中共有两种氧化物 B、该反应中,乙、丁两种物质的质量比为1:2 C、物质丙是由原子构成的 D、物质丁是形成酸雨的主要物质之一16. 推理是常用的学习方法。下列推理正确的是( )A、中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 B、化合物由不同种元素组成,所以由一种元素组成的物质一定不是化合物 C、碱溶液能使无色酚酞溶液变红,所以使无色酚酞溶液变红的一定是碱溶液 D、催化剂能改变反应速率,所以能改变反应速率的物质一定是该反应的催化剂17. 下列实验方案错误的是( )
A、该反应中共有两种氧化物 B、该反应中,乙、丁两种物质的质量比为1:2 C、物质丙是由原子构成的 D、物质丁是形成酸雨的主要物质之一16. 推理是常用的学习方法。下列推理正确的是( )A、中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 B、化合物由不同种元素组成,所以由一种元素组成的物质一定不是化合物 C、碱溶液能使无色酚酞溶液变红,所以使无色酚酞溶液变红的一定是碱溶液 D、催化剂能改变反应速率,所以能改变反应速率的物质一定是该反应的催化剂17. 下列实验方案错误的是( )选项
实验目的
实验方案
A
鉴别羊毛和棉花
灼烧,闻气味
B
检验碳酸盐
滴加稀盐酸,观察是否有气体产生
C
除去NaCl溶液中混有的CaCl2
加入适量Na2CO3溶液,过滤
D
分离KCl和MnO2固体
溶解,过滤,洗涤、干燥。滤液蒸发结晶
A、A B、B C、C D、D18. “盐穴储气”是一种地下储能技术、储气时采集盐水,注水时排天然气,原理如图所示,回答下列题。采集的盐水主要含NaCl和少量MgSO4.根据下图判断,下列说法正确的是( )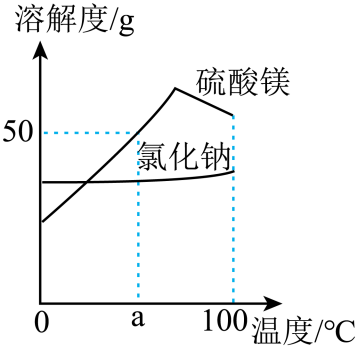 A、溶解度:MgSO4>NaCl B、MgSO4的溶解度随温度升高而增大 C、a℃时,MgSO4溶液的溶质质量分数为50% D、将盐水蒸发结晶,可得到较纯的NaCl19. 向少量氯化钙和稀盐酸的混合液中逐滴加入一定质量分数的碳酸钠溶液,采用pH传感器采集的实验数据如图所示。下列有关说法正确的是( )
A、溶解度:MgSO4>NaCl B、MgSO4的溶解度随温度升高而增大 C、a℃时,MgSO4溶液的溶质质量分数为50% D、将盐水蒸发结晶,可得到较纯的NaCl19. 向少量氯化钙和稀盐酸的混合液中逐滴加入一定质量分数的碳酸钠溶液,采用pH传感器采集的实验数据如图所示。下列有关说法正确的是( )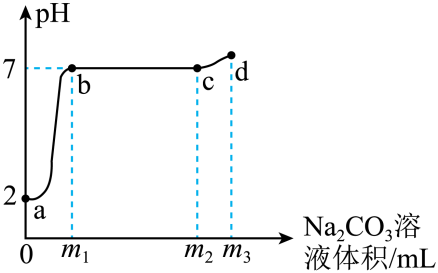 A、a→b过程,溶液的酸性逐渐增强 B、b点时碳酸钠和稀盐酸恰好完全反应 C、c点时溶液中的溶质为氯化钠和碳酸钠 D、a→b→c→d过程,溶液中氯化钠的质量不断增加20. 有一包白色粉末,可能由NaCl、、、NaOH、中的一种或几种组成,为确定其成分,进行如下实验:
A、a→b过程,溶液的酸性逐渐增强 B、b点时碳酸钠和稀盐酸恰好完全反应 C、c点时溶液中的溶质为氯化钠和碳酸钠 D、a→b→c→d过程,溶液中氯化钠的质量不断增加20. 有一包白色粉末,可能由NaCl、、、NaOH、中的一种或几种组成,为确定其成分,进行如下实验:①取一定量的白色粉末加入足量水,得到无色溶液。
②向①所得溶液中加入过量Ba(OH)2溶液,产生白色沉淀,过滤,往沉淀中加入足量稀硝酸,沉淀部分溶解。
③往②滤液中先加入几滴无色酚酞溶液,溶液变红,然后加入过量稀盐酸,再滴入几滴硝酸银溶液,产生白色沉淀。
下列关于该白色粉末成分的判断,正确的是( )
A、一定含有、一定没有 , 可能含有NaOH、NaCl B、一定含有、、 , 一定没有 , 可能含有NaCl C、一定含有、、NaCl,一定没有 , 可能含有NaOH D、一定含有、、NaOH、NaCl,一定没有二、填空题(本大题共5小题,每个化学方程式2分,其余每空1分,共26分)
-
21. 用化学用语填空。(1)、氦元素;(2)、2个氧原子;(3)、一氧化氮分子;(4)、氯酸钾中的阳离子;(5)、五氧化二磷。22. 化学就在我们身边。(1)、“高钙奶粉”“加铁酱油”中的“钙”“铁”指的是____(填字母序号)。A、分子 B、原子 C、单质 D、元素(2)、废弃的塑料水瓶应放入(填“可回收”或“不可回收”)垃圾箱。(3)、用漏勺可将牛肉丸与肉汤分离,其分离方法相当于实验基本操作中的。(4)、燃煤取暖时一定要注意通风,防止(写化学式)中毒。(5)、重要的档案材料要用碳素墨水书写,是因为。23. 中国某研究团队受“弓弩”等结构启发,研制出一种名为“碳弹簧”的新型碳材料,被认为是制造智能磁性材料的理想原料,有望用于外太空探测。
 (1)、“碳弹簧”由多孔碳材料制作而成。碳元素能组成多种碳单质,它们的物理性质存在较大差异的原因是。(2)、也是制造智能磁性材料的原料之一,已知中铁元素的化合价为+3价,则钴(Co)元素的化合价为。钴在元素周期表中的信息如图2由此可知,钴原子核外电子数为。(3)、发射外太空探测设备最理想的燃料是液态氢。实验室可通过电解水的方法制取氢气,反应的化学方程式为。24. 古篇中的化学。(1)、战国《韩非子·内储说上(七术)》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以(填“单质”或“化合物”)形式存在。(2)、战国《周礼》“烧蛎房成灰”(蛎房的主要成分是),该反应的化学反应方程式。(3)、《本草纲目》卷八赤铜条,时珍曰:“赤铜,以炉甘石炼为黄铜,其色如金”意思是用炉甘石(主要含)、赤铜()和木炭共炼,能制成黄铜(铜锌合金)。
(1)、“碳弹簧”由多孔碳材料制作而成。碳元素能组成多种碳单质,它们的物理性质存在较大差异的原因是。(2)、也是制造智能磁性材料的原料之一,已知中铁元素的化合价为+3价,则钴(Co)元素的化合价为。钴在元素周期表中的信息如图2由此可知,钴原子核外电子数为。(3)、发射外太空探测设备最理想的燃料是液态氢。实验室可通过电解水的方法制取氢气,反应的化学方程式为。24. 古篇中的化学。(1)、战国《韩非子·内储说上(七术)》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以(填“单质”或“化合物”)形式存在。(2)、战国《周礼》“烧蛎房成灰”(蛎房的主要成分是),该反应的化学反应方程式。(3)、《本草纲目》卷八赤铜条,时珍曰:“赤铜,以炉甘石炼为黄铜,其色如金”意思是用炉甘石(主要含)、赤铜()和木炭共炼,能制成黄铜(铜锌合金)。①生成黄铜的过程中,化合价升高的元素是。
②将黄铜投入硫酸铜溶液中,发生的反应方程式为。
25. 价类二维图反映元素化合价与物质类别的关系。氮元素的部分价类二维图如图1所示。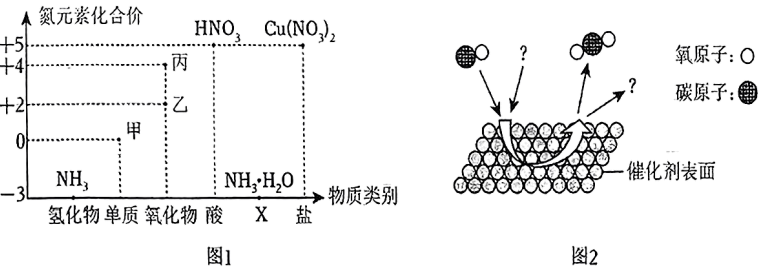 (1)、的物质类别X是。(2)、大量丙物质排放到空气中会导致雨水的pH< , 形成酸雨。(3)、结合价类二维图信息,从含氮物质中选择合适的物质完成下列化学方程式:
(1)、的物质类别X是。(2)、大量丙物质排放到空气中会导致雨水的pH< , 形成酸雨。(3)、结合价类二维图信息,从含氮物质中选择合适的物质完成下列化学方程式:。
(4)、“乙→甲”是汽车尾气转化器中发生的反应,其微观示意图如图2所示,该反应的化学方程式为。三、简答题(本大题共2小题,每个化学方程式2分,其余每空1分,共12分)
-
26. 阅读材料,根据短文回答下列问题。
为减缓温室效应,我国政府向世界庄严承诺,力争在2060年前实现“碳中和”。“碳中和”是指采取多种方式去除二氧化碳,抵消一定时间内产生的二氧化碳排放量,实现二氧化碳的“净零排放”。
目前汽车使用的燃料主要是汽油,它燃烧后不仅会产生二氧化碳,还会释放多种有害物质。
开发能够取代汽油的新能源,研发、生产和使用环保、零污染的绿色汽车都是实现“碳中和”的有效措施。研发绿色环保汽车,主要有以下途径:一是改进现有车型,采用铝合金、钛合金、塑料等轻量化材料;二是开发汽车代用燃料,主要包括天然气、乙醇、生物柴油、氢气等,实现能源多元化;三是大力发展电动汽车,尤其是氢燃料电池汽车。
(1)、化石燃料包括、石油和天然气等。(2)、从材料中可知,实现“碳中和”的有效措施有____。A、开发能够取代汽油的新能源 B、研发、生产和使用环保、零污染的绿色汽车(3)、文中的“轻量化材料”中属于合成材料的是____(填字母序号)。A、铝合金 B、钛合金 C、塑料 D、碳纤维(4)、在汽油中加入适量乙醇()作为汽车燃料,可适当节省石油资源,实现能源多元化。乙醇充分燃烧的化学方程式是。(5)、氢气作为新能源的优点是(写一点即可)。27. 实验室以软锰矿(主要含的矿石)为原料制备的流程如下: (1)、催化分解的化学反应方程式为。(2)、“酸浸”时,为使软锰矿充分反应,可采取的措施有(写一条)。(3)、“沉锰”反应为。加热温度不能过高的原因是。(4)、在空气中“煅烧”会生成不同的锰氧化物,各锰氧化物质量分数随煅烧温度的变化关系如图所示。
(1)、催化分解的化学反应方程式为。(2)、“酸浸”时,为使软锰矿充分反应,可采取的措施有(写一条)。(3)、“沉锰”反应为。加热温度不能过高的原因是。(4)、在空气中“煅烧”会生成不同的锰氧化物,各锰氧化物质量分数随煅烧温度的变化关系如图所示。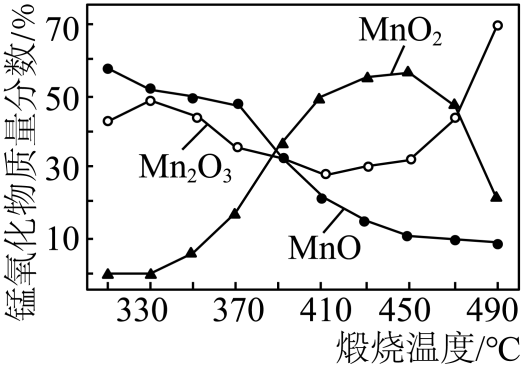
①370~410℃发生主要反应为。该反应属于基本反应类型中的反应。
②已知酒精灯外焰的最高温度可达600℃以上。称取一定质量的 , 与混合均匀,充分加热后冷却,溶解、过滤、洗涤、烘干后称量,发现固体质量减少。质量减少的主要原因是。
四、实验探究题(本大题共2小题,每个化学方程式2分,其余每空1分,共16分)
-
28. 具备基本的实验技能是学习化学的基础和保证。如图是实验室制取气体的部分装置,请回答下列问题。
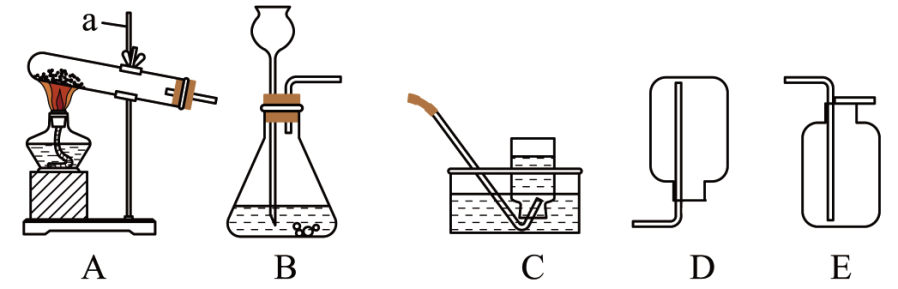 (1)、写出仪器a的名称。(2)、实验室用氯酸钾和二氧化锰制取氧气,在组装好仪器后,装入药品前应进行的操作是。如图C所示,若集气瓶位置固定不变,则收集过程中集气瓶口处的压强(填“逐渐变大”或“保持不变”或“逐渐变小”)。(3)、实验室制取二氧化碳,反应的化学方程式为 , 应选用的发生装置是。对比装置D、E的异同,选用E而不用D收集的理由是。(4)、实验室用加热氯化铵和熟石灰两种固体混合物的方法制取氨气(氨气极易溶于水,密度比空气小),应选用的发生和收集装置组合是。29. 已知:。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。某兴趣小组对还原氧化铜实验的产物及应用开展项目式学习。(1)、
(1)、写出仪器a的名称。(2)、实验室用氯酸钾和二氧化锰制取氧气,在组装好仪器后,装入药品前应进行的操作是。如图C所示,若集气瓶位置固定不变,则收集过程中集气瓶口处的压强(填“逐渐变大”或“保持不变”或“逐渐变小”)。(3)、实验室制取二氧化碳,反应的化学方程式为 , 应选用的发生装置是。对比装置D、E的异同,选用E而不用D收集的理由是。(4)、实验室用加热氯化铵和熟石灰两种固体混合物的方法制取氨气(氨气极易溶于水,密度比空气小),应选用的发生和收集装置组合是。29. 已知:。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。某兴趣小组对还原氧化铜实验的产物及应用开展项目式学习。(1)、【任务一】设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。
制取氢气的化学方程式为。 (2)、实验开始时,____(填序号)A、先向长颈漏斗中加稀硫酸后点酒精灯 B、先点燃酒精灯加热后向长颈漏斗中加稀硫酸(3)、取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到 , 证明固体产物有Cu2O。(4)、【任务二】探究反应生成Cu2O的变化情况。
(2)、实验开始时,____(填序号)A、先向长颈漏斗中加稀硫酸后点酒精灯 B、先点燃酒精灯加热后向长颈漏斗中加稀硫酸(3)、取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到 , 证明固体产物有Cu2O。(4)、【任务二】探究反应生成Cu2O的变化情况。称取若干份质量均为0.8000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2.
由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是。
(5)、为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是。(6)、【任务三】探究反应生成Cu2O的原因。为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1.
经历 , 两个反应,且在同一条件下两个反应同时进行。
假设2.
经历、、三个反应。
结合【任务二】的结果,通过计算分析,假设1“同一条件下两个反应同时进行”依据是。
(7)、若要确认“假设2”是否合理,在【任务二】的基础上,还需进行如下实验:操作
现象
结论
溶液变蓝色
假设2合理
五、计算题
-
30. 计算下列小题。(1)、用100克溶质质量分数为30%的过氧化氢溶液配制成溶质质量分数为5%的过氧化氢溶液,需加水 克。(2)、取75克某过氧化氢溶液放入锥形瓶中并加入一定量的二氧化锰,用电子秤测其质量,不同时间电子秤的读数如表所示。试计算该过氧化氢溶液的溶质质量分数(不考虑H2O逸出,写出计算过程,结果保留到0.1%)。
反应时间/min
0
1
2
3
4
5
6
锥形瓶+瓶内物质的总质量/g
375.00
371.56
366.28
365.56
365.40
365.40
365.40