新疆维吾尔自治区2024年中考一模化学试题
试卷更新日期:2024-04-11 类型:中考模拟
一、单项选择题(本大题共10小题,每小题2分,共20分)
-
1. 下列变化属于化学变化的是( )A、石榴榨汁 B、石蜡熔化 C、钢铁生锈 D、干冰升华2. 骨质疏松症是因为人体中缺少( )A、Ca元素 B、Fe元素 C、O元素 D、I元素3. 石英砂(SiO2)制取高纯硅的反应原理为 , 则X的化学式是( )A、O2 B、CO C、CO2 D、SiC4. 下列图示实验操作中,错误的是( )A、
 取用固体粉末
B、
取用固体粉末
B、 倾倒液体
C、
倾倒液体
C、 滴加液体
D、
滴加液体
D、 加热液体
5. 科学家利用“基因剪刀”技术降低了水稻中砷的含量。下图是砷元素在元素周期表中的信息及原子结构示意图。下列说法中错误的是( )
加热液体
5. 科学家利用“基因剪刀”技术降低了水稻中砷的含量。下图是砷元素在元素周期表中的信息及原子结构示意图。下列说法中错误的是( ) A、砷属于非金属元素 B、砷的原子序数为33 C、砷原子的相对原子质量为 D、在化合物中砷元素的化合价可能为价6. 粉尘爆炸实验如图所示,下列说法错误的是( )
A、砷属于非金属元素 B、砷的原子序数为33 C、砷原子的相对原子质量为 D、在化合物中砷元素的化合价可能为价6. 粉尘爆炸实验如图所示,下列说法错误的是( ) A、实验中燃着的蜡烛能提高面粉的着火点 B、可燃物与氧气的接触面积越大燃烧越剧烈 C、加油站、面粉厂和煤矿井内必须严禁烟火 D、易燃易爆物存放点周围要有足够的防火距离7. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、分子能构成物质,所以物质都是由分子构成的 B、阳离子带正电荷,所以带正电荷的粒子一定是阳离子 C、氧气和臭氧的组成元素相同,所以它们的化学性质相同 D、溶液是由溶质和溶剂组成的,所以溶液一定是混合物8. 向5 mL碘的水溶液(黄色)中加入2 mL汽油(无色),振荡静置,实验现象如图所示。由该实验不能得出的结论是( )
A、实验中燃着的蜡烛能提高面粉的着火点 B、可燃物与氧气的接触面积越大燃烧越剧烈 C、加油站、面粉厂和煤矿井内必须严禁烟火 D、易燃易爆物存放点周围要有足够的防火距离7. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、分子能构成物质,所以物质都是由分子构成的 B、阳离子带正电荷,所以带正电荷的粒子一定是阳离子 C、氧气和臭氧的组成元素相同,所以它们的化学性质相同 D、溶液是由溶质和溶剂组成的,所以溶液一定是混合物8. 向5 mL碘的水溶液(黄色)中加入2 mL汽油(无色),振荡静置,实验现象如图所示。由该实验不能得出的结论是( )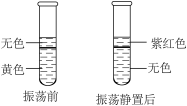 A、汽油的密度比水小,且不溶于水 B、汽油易挥发,沸点比水低 C、碘在汽油中的溶解性比在水中强 D、碘在不同溶剂中形成的溶液颜色可能不同9. 是一种新型的火箭燃料。下列有关的说法中正确的是( )A、由3种元素组成 B、N、O原子的个数比为1:2 C、燃烧时放出大量的热 D、1个中含有3个氧分子10. 下列实验方法不能达到实验目的的是( )
A、汽油的密度比水小,且不溶于水 B、汽油易挥发,沸点比水低 C、碘在汽油中的溶解性比在水中强 D、碘在不同溶剂中形成的溶液颜色可能不同9. 是一种新型的火箭燃料。下列有关的说法中正确的是( )A、由3种元素组成 B、N、O原子的个数比为1:2 C、燃烧时放出大量的热 D、1个中含有3个氧分子10. 下列实验方法不能达到实验目的的是( )选项
实验目的
实验方法
A
检验甲烷中含有氢元素
点燃后在火焰上方罩干冷小烧杯
B
分离硝酸钾和氯化钠的固体混合物
加水溶解后,蒸发溶剂
C
鉴别稀硫酸和稀盐酸
加入溶液和稀
D
除去中混有的少量
将气体通过加热的
A、A B、B C、C D、D二、填空题(本大题共3小题,每空1分,共21分)
-
11. 水是生命的源泉,人类的生产、生活都离不开水。(1)、海水淡化可解决一些地区水资源短缺的问题,其技术之一是膜分离法,即利用薄膜的选择透过性实现海水淡化。例如,给石墨烯“打上”许多特定大小的孔,制成单层纳米孔二维薄膜,可淡化海水。石墨烯海水淡化膜工作原理如图所示。

①石墨烯海水淡化膜允许(填微粒符号)通过。
②石墨烯、金刚石和都属于碳单质,下列说法中正确的是(选填字母)。
A.都由碳元素组成 B.都由碳原子构成 C.物理性质相似
(2)、家用净水机常用活性炭除去水中的异味,这是利用活性炭的。(3)、如图所示是电解水实验通电一段时间后的情况。
①试管(选填“a”或“b”)中产生的气体可使带火星的木条复燃。
②写出电解水的化学反应方程式。
③气态储氢是将氢气压缩存储于高压罐中,请从微观角度分析氢气能被压缩的原因。
④氢燃料电池汽车基本实现碳的“零排放”。目前在生活生产中大量使用氢能源还存在一定困难,原因是(选填字母)。
A.氢气本身无毒 B.氢气制取成本高和贮存困难
C.氢气燃烧放出热量多 D.氢气燃烧产物不污染空气
12. 多角度认识物质及其变化,能帮助我们全面了解物质世界。 (1)、图1为空气成分的示意图,物质B的化学式为。利用红磷燃烧测定空气中物质B含量的实验装置如图2所示,红磷燃烧反应的化学方程式为。(2)、向氢氧化钙溶液(澄清石灰水)中滴加稀盐酸,无明显现象。设计实验获取反应发生的证据。
(1)、图1为空气成分的示意图,物质B的化学式为。利用红磷燃烧测定空气中物质B含量的实验装置如图2所示,红磷燃烧反应的化学方程式为。(2)、向氢氧化钙溶液(澄清石灰水)中滴加稀盐酸,无明显现象。设计实验获取反应发生的证据。①甲同学设计如图3所示实验:将无色酚酞溶液滴入试管中,溶液颜色变为红色;再将浓盐酸滴入试管b中,一段时间后,a中溶液红色消失,说明与发生了反应。该反应的基本类型是。该实验还说明浓盐酸的性质有酸性和。
②乙同学将氢氧化钙溶液与稀盐酸混合,然后检验了混合液中含有和 , 他据此认为与发生了反应,且生成了。你认为乙同学是否找到了反应发生的证据?请说出你的观点并阐述理由:。
(3)、医疗上碳酸氢钠可用于治疗胃酸过多症,请根据图分析该反应的微观实质。 (4)、可用图所示方法自制汽水。打开汽水瓶盖时,汽水会喷出来,说明气体在水中的溶解度与有关。
(4)、可用图所示方法自制汽水。打开汽水瓶盖时,汽水会喷出来,说明气体在水中的溶解度与有关。 13. 金属和金属材料与生产生活和社会发展的关系非常密切。(1)、我国自主研发的时速可达的高温超导高速磁浮工程化样车及试验线已正式启用。下列制造该列车的材料中属于金属材料的是____(选填字母)。A、有机玻璃车窗 B、碳纤维车体 C、钇铋镁超导材料 D、涤纶座套(2)、易拉罐以铝或铁作为罐体材料。易拉罐置于冰箱中能快速降温,体现了金属的性。(3)、利用如图所示实验探究铝、铜、铁三种金属的化学性质。
13. 金属和金属材料与生产生活和社会发展的关系非常密切。(1)、我国自主研发的时速可达的高温超导高速磁浮工程化样车及试验线已正式启用。下列制造该列车的材料中属于金属材料的是____(选填字母)。A、有机玻璃车窗 B、碳纤维车体 C、钇铋镁超导材料 D、涤纶座套(2)、易拉罐以铝或铁作为罐体材料。易拉罐置于冰箱中能快速降温,体现了金属的性。(3)、利用如图所示实验探究铝、铜、铁三种金属的化学性质。
①实验1:实验中,观察到发出白光后铁丝并未燃烧,原因是。
②实验2:向两个盛有同样大小的铁片和铝片的试管中,分别滴加相同浓度的稀盐酸比较铁和铝的金属活动性强弱。实验之前铝片需要先用砂纸打磨的目的是。
③实验3:该反应的化学方程式为。
④在实验3的基础上,再补充一个实验可得出三种金属活动性顺序。将实验步骤和实验现象填入表中、
实验步骤(可用图示)
实验现象
实验结论
三、实验探究题(本大题共2小题,每空1分,共15分)
-
14. 实验室现提供的药品和仪器有: , 块状大理石,稀盐酸,棉花等。
 (1)、图中仪器a的名称是。(2)、根据现有药品制取氧气,发生装置应选用(选填字母)。制取一瓶较干燥的氧气应选择的收集装置是(选填字母)。若用装置F收集氧气,当时开始收集。(3)、根据现有药品选用和稀盐酸反应制取。验满的方法是。(4)、将制取的通入紫色石蕊溶液中,可观察到实验现象为。(5)、采用装置C制取气体的优点是。15. 化学项目学习小组同学在老师的带领下,探究影响过氧化氢()分解速率的因素。(1)、【学习任务一】探究催化剂对溶液分解的影响。
(1)、图中仪器a的名称是。(2)、根据现有药品制取氧气,发生装置应选用(选填字母)。制取一瓶较干燥的氧气应选择的收集装置是(选填字母)。若用装置F收集氧气,当时开始收集。(3)、根据现有药品选用和稀盐酸反应制取。验满的方法是。(4)、将制取的通入紫色石蕊溶液中,可观察到实验现象为。(5)、采用装置C制取气体的优点是。15. 化学项目学习小组同学在老师的带领下,探究影响过氧化氢()分解速率的因素。(1)、【学习任务一】探究催化剂对溶液分解的影响。【实验过程】学生利用如图所示装置,以收集的气体为标准,比较反应的快慢,实验方案如下表所示(分液漏斗可控制液体的滴加速度):

序号
温度
溶液浓度
溶液体积
催化剂
时间
1
20
5
40
37
2
20
10
40
14
3
20
5
40
氧化铜
b
4
80
5
40
29
【实验分析】
①写出实验3发生反应的化学方程式。
②对比实验1和2,得出的结论是。
③通过对比实验1和3,得出二氧化锰的催化效果比氧化铜强的实验依据是。
④实验中,使用注射器的优点是。
(2)、【学习任务二】探究氯化物对溶液分解的影响。
氯化物
放出氧气的体积
2.0
4.0
420.0
溶液的分解率
0.30
0.60
63.18
【实验过程】反应条件:溶液,氯化物,室温;实验时间:。
【实验分析】
由上表数据可知溶液保存时应绝对避免引入的离子是(写离子符号)。
(3)、【学习任务三】探究对溶液分解的影响。
【实验过程】反应条件:溶液,;用溶液调;实验时间:。
【实验分析】
由图可知,为(填数字)时,溶液的分解率最高。
 (4)、用溶液可制得“钙多宝”。“钙多宝”是鱼塘增氧剂。
(4)、用溶液可制得“钙多宝”。“钙多宝”是鱼塘增氧剂。“钙多宝”主要成分是 , 常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有的主要杂质是(填化学式)、。
四、计算题(本大题共1小题,共4分。解题时要有必要的公式和文字说明,只写出结果不得分)
-
16. 氯化铵是一种常见的化学肥料。取含有氯化铵的混合肥料样品于烧杯中,加入足量的氢氧化钠溶液,充分反应(其他成分和杂质不参与反应),产生氨气的质量为。反应的化学方程式为。(1)、氯化铵属于(选填“氮”“磷”或“钾”)肥。(2)、计算该混合肥料中氯化铵的质量。(写出计算过程)