广东省湛江市廉江市2024年中考一模化学试题
试卷更新日期:2024-04-11 类型:中考模拟
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 广东糍粑是以糯米粉、花生等为主料的食品。制作广东糍粑时,涉及化学变化的是( )A、将熟花生搅碎作馅料 B、将糯米粉加水揉成团 C、将馅料加入成团糯米粉中并压扁 D、用柴火烧制并蒸熟包好粽叶的糍粑2. 2023年12月21日,神舟十七号航天员乘组又创佳绩,汤洪波作为我国首位重返空间站的航天员时隔两年再度漫步太空,唐胜杰成为我国目前为止执行出舱任务年龄最小的航天员。出舱任务中必不可少的航天服用到的以下材料属于有机合成材料的是( )
 A、形状记忆合金 B、弹性氨纶材料 C、玻璃纤维硬壳 D、棉针织品中的棉花原料3. 超市陈列的商品中,标签上注明“含氟牙膏”“高钙牛奶”“加碘食盐”“铁强化酱油”,这里的氟、钙、碘、铁指的是( )A、元素 B、原子 C、分子 D、单质4. 以下哪位中国科学家因其在中草药成分研究领域的杰出贡献而获得诺贝尔生理学或医学奖( )A、张青莲 B、屠呦呦 C、侯德榜 D、杨振宁5. 以下微粒的化学用语、化学式、所带质子数均无误的是( )A、2个氢氧根离子 2OH- 18 B、1个三氧化硫分子 1SO3 40 C、2个碳-60分子 2C60 1440 D、2个氢原子 H2 26. 关于“碳达峰、碳中和”中的二氧化碳,下列说法不正确的是( )A、过量的二氧化碳会造成温室效应 B、向紫色石蕊试液中通入二氧化碳,使紫色石蕊试液变红的物质不是二氧化碳 C、可用点燃的方法除去二氧化碳中混有的少量一氧化碳 D、固态的二氧化碳俗称“干冰”,常用于人工降雨7. 2023年广东云浮一超级砂石大矿启动出让,预期评估收益超20亿元,下列不需要张贴在矿井入口处的是( )A、
A、形状记忆合金 B、弹性氨纶材料 C、玻璃纤维硬壳 D、棉针织品中的棉花原料3. 超市陈列的商品中,标签上注明“含氟牙膏”“高钙牛奶”“加碘食盐”“铁强化酱油”,这里的氟、钙、碘、铁指的是( )A、元素 B、原子 C、分子 D、单质4. 以下哪位中国科学家因其在中草药成分研究领域的杰出贡献而获得诺贝尔生理学或医学奖( )A、张青莲 B、屠呦呦 C、侯德榜 D、杨振宁5. 以下微粒的化学用语、化学式、所带质子数均无误的是( )A、2个氢氧根离子 2OH- 18 B、1个三氧化硫分子 1SO3 40 C、2个碳-60分子 2C60 1440 D、2个氢原子 H2 26. 关于“碳达峰、碳中和”中的二氧化碳,下列说法不正确的是( )A、过量的二氧化碳会造成温室效应 B、向紫色石蕊试液中通入二氧化碳,使紫色石蕊试液变红的物质不是二氧化碳 C、可用点燃的方法除去二氧化碳中混有的少量一氧化碳 D、固态的二氧化碳俗称“干冰”,常用于人工降雨7. 2023年广东云浮一超级砂石大矿启动出让,预期评估收益超20亿元,下列不需要张贴在矿井入口处的是( )A、 B、
B、 C、
C、 D、
D、 8. 下列实验方案不能达到实验目的的是( )A、
8. 下列实验方案不能达到实验目的的是( )A、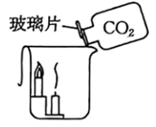 证明二氧化碳密度大于空气
B、
证明二氧化碳密度大于空气
B、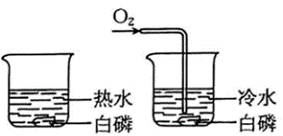 研究白磷燃烧是否需要氧气
C、
研究白磷燃烧是否需要氧气
C、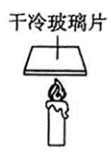 证明蜡烛燃烧的产物有水
D、
证明蜡烛燃烧的产物有水
D、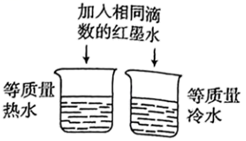 证明温度对分子运动快慢的影响
9. 钕是最活泼的稀土金属之一,钕玻璃可代替红宝石做激光材料亦可做护目镜。钕在元素周期表中的部分信息如图1所示,其原子结构示意图如图2所示,则下列说法不正确的是( )
证明温度对分子运动快慢的影响
9. 钕是最活泼的稀土金属之一,钕玻璃可代替红宝石做激光材料亦可做护目镜。钕在元素周期表中的部分信息如图1所示,其原子结构示意图如图2所示,则下列说法不正确的是( )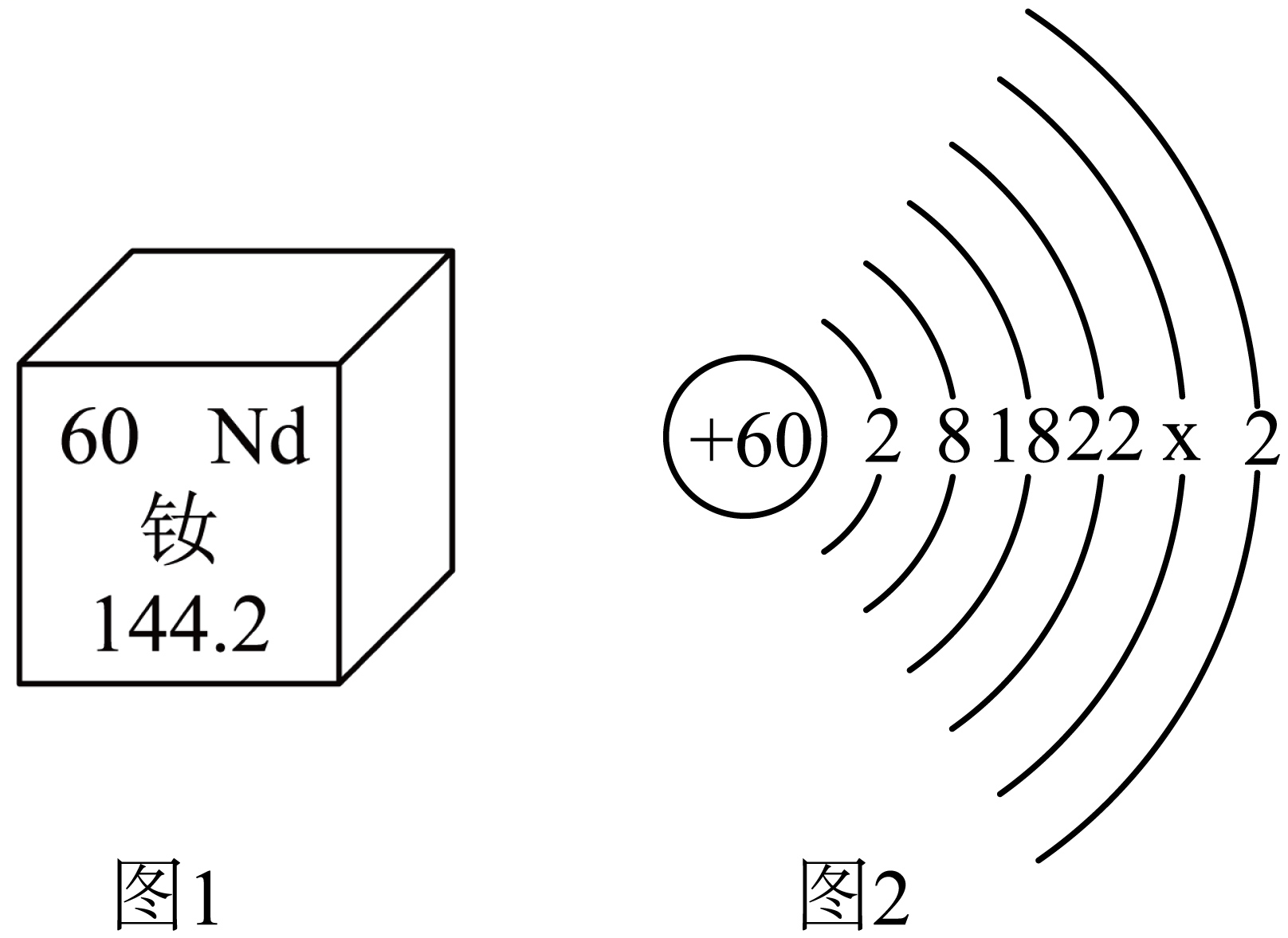 A、图2中,x=8 B、钕离子的符号为Nd2+ C、钕原子的相对原子质量为144.2g D、钕的核电荷数为6010. 某反应中的各物质存在下表所示的关系,则下列选项判断正确的是( )
A、图2中,x=8 B、钕离子的符号为Nd2+ C、钕原子的相对原子质量为144.2g D、钕的核电荷数为6010. 某反应中的各物质存在下表所示的关系,则下列选项判断正确的是( )物质
A
B
C
D
反应前质量/g
10
10
10
0
反应中质量/g
6
x
10
y
反应后质量/g
z
0
10
18
A、该反应为分解反应 B、物质C一定为该反应的催化剂 C、反应物恰好完全反应 D、x=5;y=9;z=211. 甲醇(CH3OH)又被称为“工业酒精”,是一种有机化合物,有毒,可用于制造农药、甲醇燃料等。氢动力潜艇中CO2的含量与动力的来源这一课题,始终是科学家们研究的方向,下图是某科学家针对上述问题提出的解决方案,以下说法不正确的是( )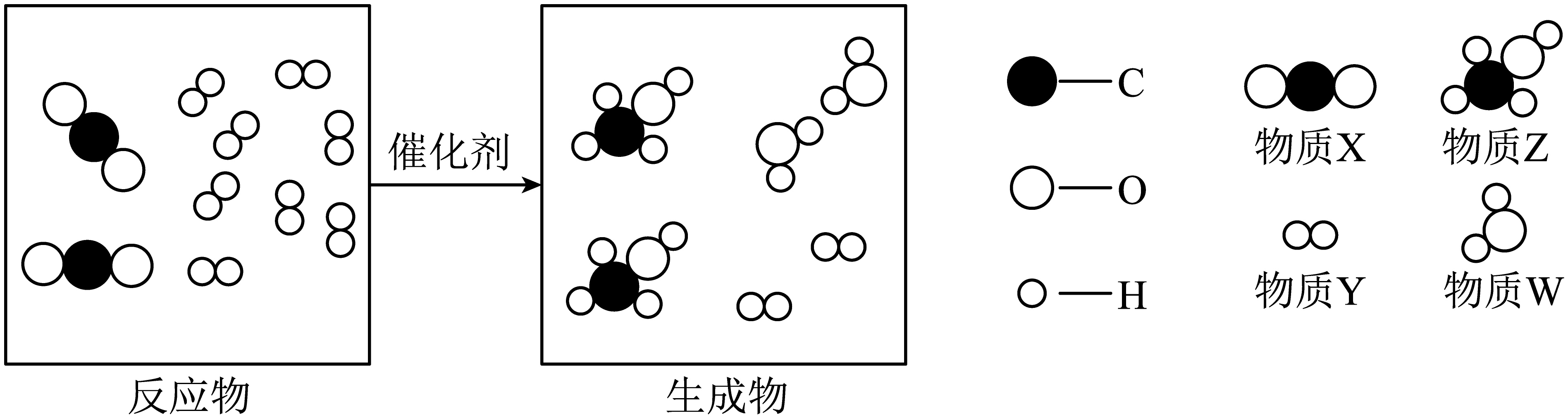 A、参与反应的X、Y的个数比为2:8 B、可将Z物质与汽油按一定的体积(质量)比经过严格的流程调配成一种新型环保燃料 C、物质X、W均为化合物且都是氧化物,Y为单质 D、甲醇完全燃烧的化学方程式:12. 下图为某些物质的溶解度曲线,下列说法不正确的是( )
A、参与反应的X、Y的个数比为2:8 B、可将Z物质与汽油按一定的体积(质量)比经过严格的流程调配成一种新型环保燃料 C、物质X、W均为化合物且都是氧化物,Y为单质 D、甲醇完全燃烧的化学方程式:12. 下图为某些物质的溶解度曲线,下列说法不正确的是( )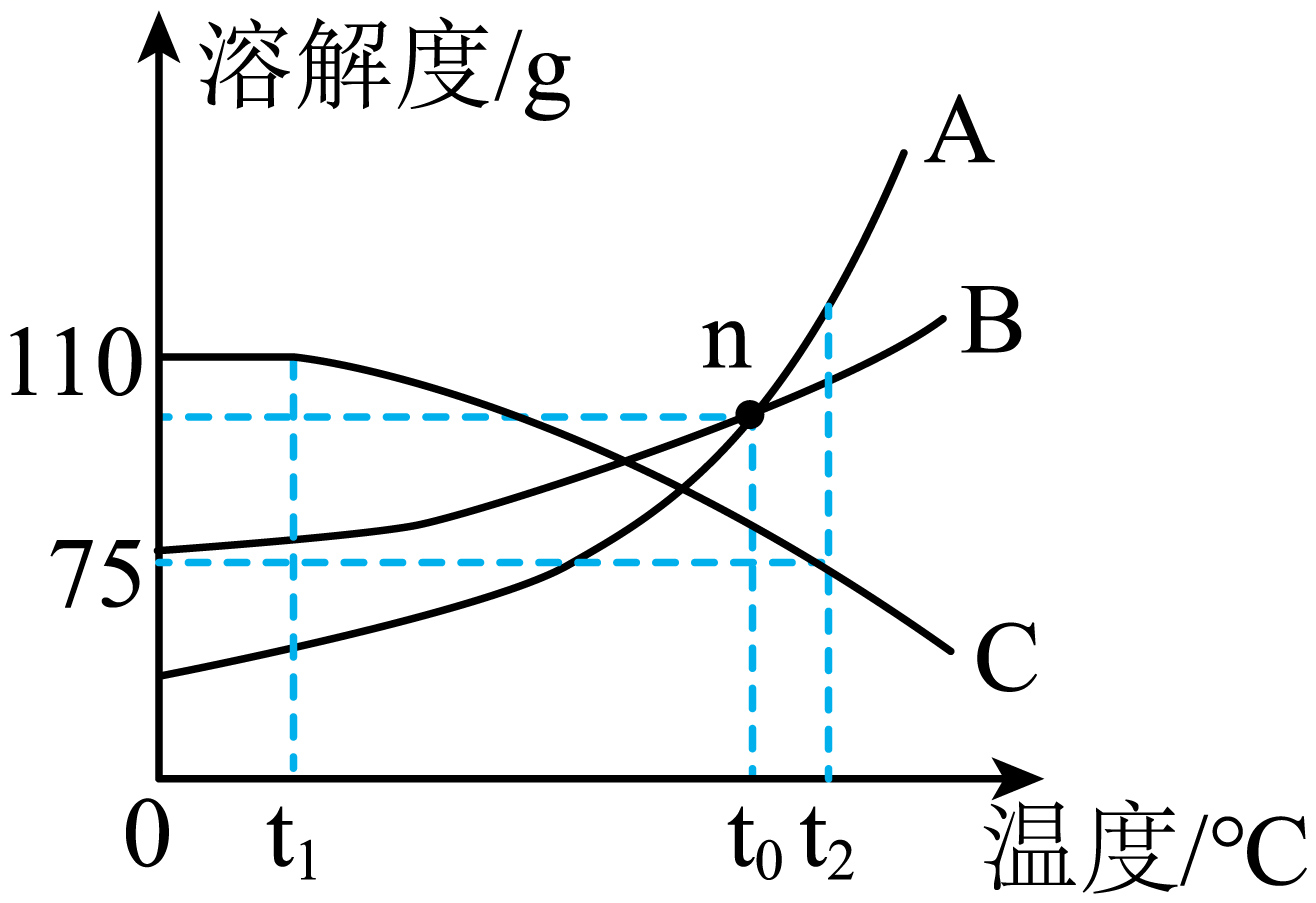 A、n点表示在t0℃时,溶解度:A=B,均为110g B、B溶液中含有少量的C,可采用降温结晶的方法提纯B C、t2℃时,向50g水中加入37.5g固体C,得到C的饱和溶液 D、分别将三种物质的饱和溶液从t2℃降温至t1℃,溶质质量分数的大小关系为13. 下列过程、做法与所述的化学知识没有关联的是( )
A、n点表示在t0℃时,溶解度:A=B,均为110g B、B溶液中含有少量的C,可采用降温结晶的方法提纯B C、t2℃时,向50g水中加入37.5g固体C,得到C的饱和溶液 D、分别将三种物质的饱和溶液从t2℃降温至t1℃,溶质质量分数的大小关系为13. 下列过程、做法与所述的化学知识没有关联的是( )选项
过程、做法
化学知识
A
炒菜锅着火,锅盖盖灭
隔绝空气或氧气
B
用食醋除水垢
水垢能与食醋中的醋酸反应
C
铝制品在空气中耐腐蚀
铝易与氧气反应形成致密氧化层覆盖表面,阻止进一步氧化
D
用汽油除去油污
汽油能乳化油污
A、A B、B C、C D、D14. 实验中物质的鉴别和除杂是重要的实验技能,下列实验方案不正确的是( )选项
实验目的
实验方案
A
除去二氧化碳中混有的一氧化碳
通过灼热的氧化铜
B
鉴别尿素和氯化铵
取样,加熟石灰研磨,闻气味
C
除去二氧化锰粉末中混有的氯化钾
加水溶解、过滤、蒸发结晶
D
鉴别铁粉和炭粉
取样,加入盐酸,观察是否产生气泡
A、A B、B C、C D、D15. 下列图像能正确反映对应关系的是( )A、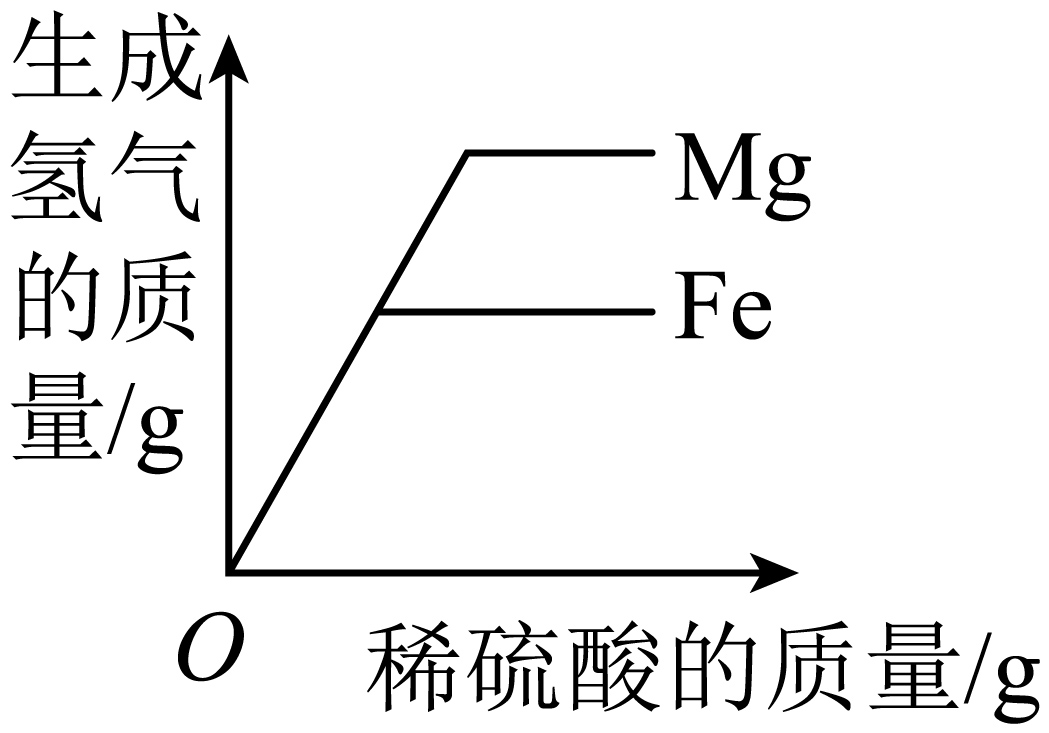 向等质量的铁粉和镁粉中分别加入等浓度过量的稀硫酸
B、
向等质量的铁粉和镁粉中分别加入等浓度过量的稀硫酸
B、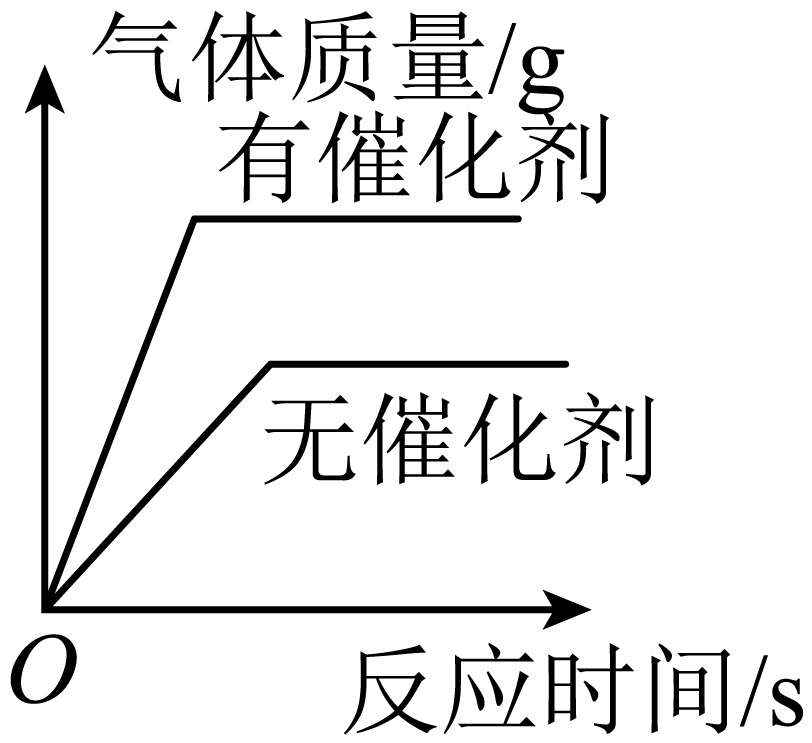 用等质量、等浓度的过氧化氢溶液制氧气
C、
用等质量、等浓度的过氧化氢溶液制氧气
C、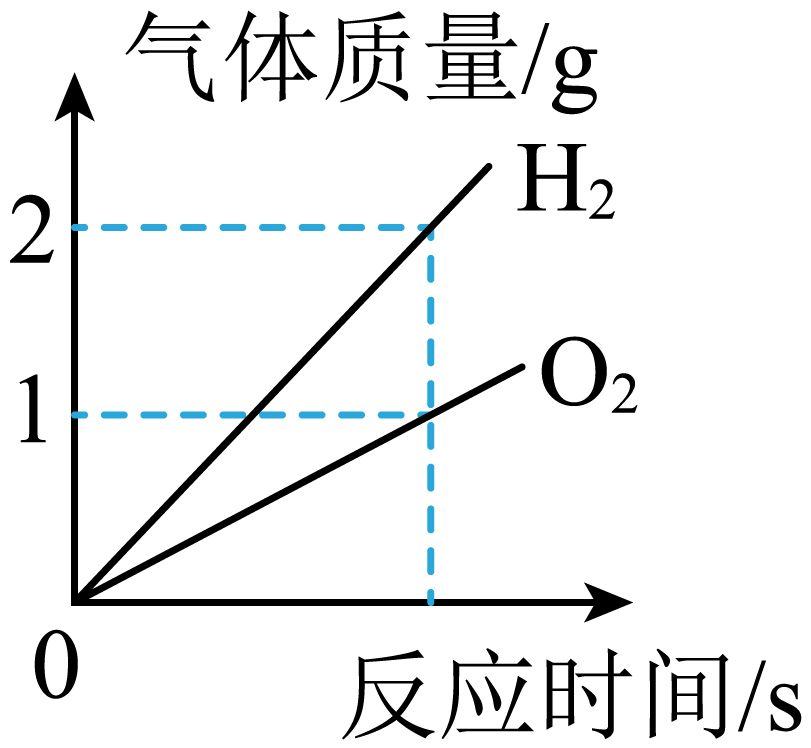 电解水一段时间
D、
电解水一段时间
D、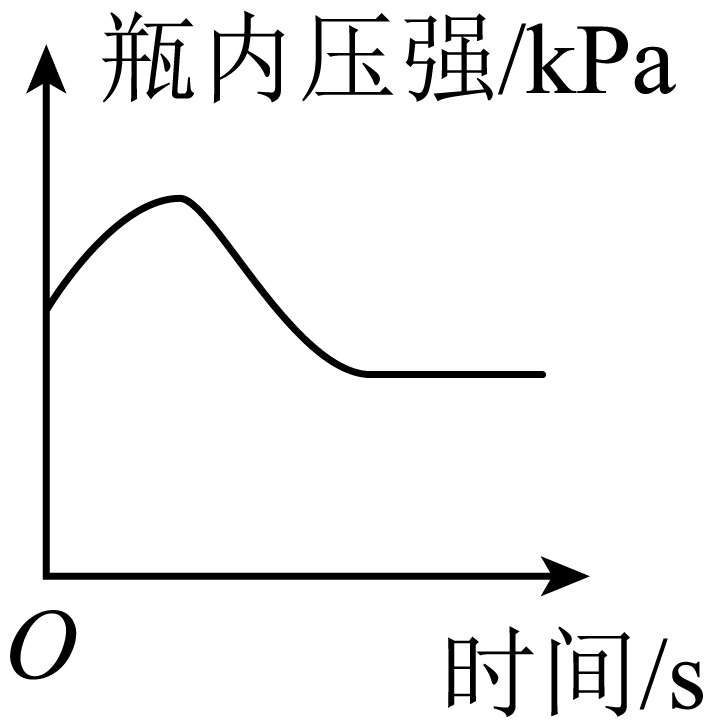 用木炭燃烧的方法测量空气中氧气的含量
用木炭燃烧的方法测量空气中氧气的含量
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
-
16. 生活中处处有化学,根据所学的化学知识可以解释生活中的许多问题。
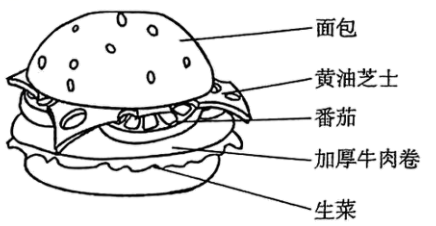 (1)、午餐时,除了以上汉堡中含有的营养素外,仍需补充的营养素是____(填字母)。A、无机盐 B、油脂 C、糖类 D、维生素 E、蛋白质 F、水(2)、我们在食用面包时,因为面包内含有丰富的淀粉,在人体中进行一系列的化学变化能最终为人体提供能量,请写出葡萄糖在体内氧化,为细胞提供能量的化学方程式:。(3)、生菜是叶类蔬菜,常需要施肥,为防止生菜叶片边缘发黄,需要施加(选填“氮肥”“钾肥”或“磷肥”)。(4)、“沙里淘金”是因为黄金在自然界中以(选填“单质”或“化合物”)形式存在。(5)、小时候常吃的“××雪饼”中,常有一包很大的“双吸剂”,其主要成分是铁粉,铁粉能起到防腐的原因是其会吸收空气中的和。17. 阅读下列科普短文,回答有关问题。
(1)、午餐时,除了以上汉堡中含有的营养素外,仍需补充的营养素是____(填字母)。A、无机盐 B、油脂 C、糖类 D、维生素 E、蛋白质 F、水(2)、我们在食用面包时,因为面包内含有丰富的淀粉,在人体中进行一系列的化学变化能最终为人体提供能量,请写出葡萄糖在体内氧化,为细胞提供能量的化学方程式:。(3)、生菜是叶类蔬菜,常需要施肥,为防止生菜叶片边缘发黄,需要施加(选填“氮肥”“钾肥”或“磷肥”)。(4)、“沙里淘金”是因为黄金在自然界中以(选填“单质”或“化合物”)形式存在。(5)、小时候常吃的“××雪饼”中,常有一包很大的“双吸剂”,其主要成分是铁粉,铁粉能起到防腐的原因是其会吸收空气中的和。17. 阅读下列科普短文,回答有关问题。锡是“五金”(金、银、铜、铁、锡)之一,具有质地柔软、熔点低和无毒等优良特性。自然界中的锡主要以氧化物(如锡石,主要成分为SnO2)和硫化物(如硫锡石,主要成分为SnS)的形式存在。宋代宋应星所著的《天工开物》中记载锡的冶炼:“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化……点铅勾锡……”

常温下,锡露置于空气中能保持金属光泽,但易被酸腐蚀。锡与氯气反应生成的四氯化锡(SnCl4)可用于制作FTO导电玻璃,用来制作液晶显示屏。以锡为原料加工而成的金属工艺品以色如银,亮如镜,声如馨,色泽历久常新的特点而深受人们的喜爱。锡还广泛用于电子信息、化工冶金及航天工业等。
(1)、自然界中的锡主要以形式存在(填“单质”或“化合物”)。(2)、炼锡时“鼓入足量空气”的目的是使炭来提高炉温,同时“点铅勾锡”,即加铅能使锡较易熔化流出,其原因是。(3)、下列说法正确的是____(填序号)。A、锡常温下不易被空气氧化 B、锡制品能够盛放含有柠檬酸的饮料 C、硫锡石炼锡过程中可能会产生酸性气体,污染环境(4)、FTO导电玻璃生产过程中,以SnCl4和水反应生成HCl和一种氧化物,其化学方程式为。18. 【基础实验与跨学科实践】下图是实验室的常见装置,请回答以下问题:
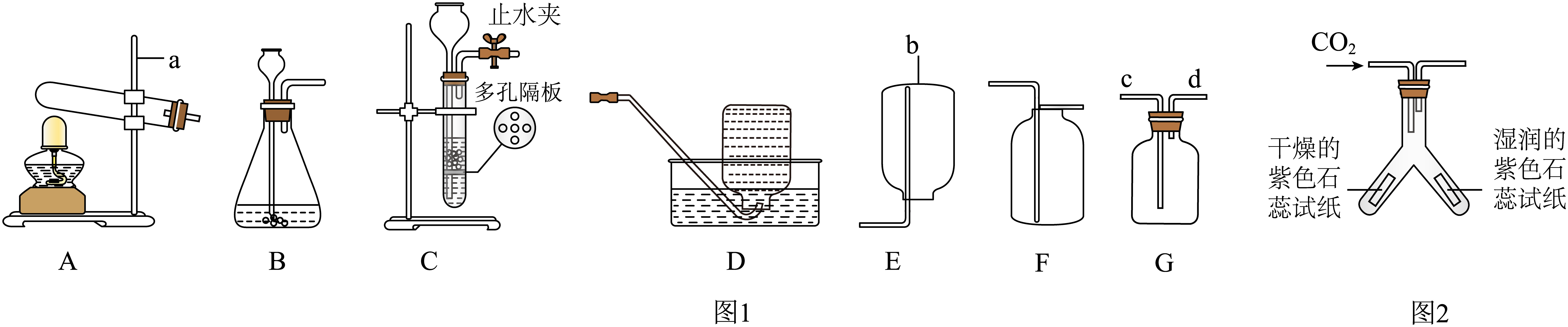 (1)、上图中仪器 b的名称是。(2)、用过氧化氢溶液制取并收集一瓶较纯净的O2 , 应选择上图中的装置(填字母)。化学方程式为。若发生装置不变,仍想得到一瓶较干燥的氧气,需在F装置前添加装有浓H2SO4的装置(填字母)。(3)、现欲用G装置来除去一氧化碳中混有的少量二氧化碳,应在G装置中加入 , 其中发生反应的化学方程式主要为 , 气体应从(选填“c”或“d”)端通入。(4)、图2中,能证明二氧化碳能与水反应的现象是。19. 【科学探究】
(1)、上图中仪器 b的名称是。(2)、用过氧化氢溶液制取并收集一瓶较纯净的O2 , 应选择上图中的装置(填字母)。化学方程式为。若发生装置不变,仍想得到一瓶较干燥的氧气,需在F装置前添加装有浓H2SO4的装置(填字母)。(3)、现欲用G装置来除去一氧化碳中混有的少量二氧化碳,应在G装置中加入 , 其中发生反应的化学方程式主要为 , 气体应从(选填“c”或“d”)端通入。(4)、图2中,能证明二氧化碳能与水反应的现象是。19. 【科学探究】锰钢(含Fe、Mn、C等)是具有优良金属性能的合金,在生产生活中有广泛的应用。
查阅文献得知:①金属锰是难溶于水的灰白色固体。
②金属锰在水溶液中反应通常显价,使溶液呈肉色。
③锰钢板中锰元素的含量一般在11%至14%之间。
(1)、锰钢常用作高铁轨道,写一条锰钢具有的性质:。兴趣小组同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究。
(2)、根据金属活动性顺序(),对Mn的金属活动性提出了三种猜想:猜想I:;
猜想Ⅱ:;
猜想Ⅲ:。
(3)、进行实验:实验序号
操作
现象
结论
1
将三种打磨好,粗细质量相同的金属片,分别放入相同的稀硫酸中
放入铁片溶液呈绿色,放入锰片溶液为肉色,放入铜片溶液为无色
猜想错误
2
将打磨好的锰片放入硫酸亚铁溶液中
猜想I正确
(4)、【分析评价】有同学认为实验1除了颜色的变化还应该有其他实验现象,理由是(任选一个,用化学方程式解释)。
(5)、【补充实验】为更好地探究过量的硫酸与等质量的铁和锰反应实验(如下图所示),气球膨胀速度较快的是(选填“Mn”或“Fe”),产生气体质量较大的是(选填“Mn”或“Fe”)。

实验编号
盐酸的浓度
(均取20mL)
金属
(均取2g)
金属的形状
收集50mL氢气所需时间/s
①
10%
铝
粉状
70
②
10%
铁
片状
120
③
10%
铝
片状
112
④
20%
铁
片状
110
(6)、交流:金属与酸的反应快慢还受哪些因素的影响呢?(请根据上表解答)①金属与酸反应的接触面积;②。
(7)、你认为金属与酸反应,可能还受哪些因素的影响:(说出一项即可)。20. 某化学学习小组的同学在学习了酸、碱、盐以后,对下列问题有了更深层次的理解。(1)、实验小组探究稀盐酸与氢氧化钠溶液反应过程中溶液pH的变化如图所示。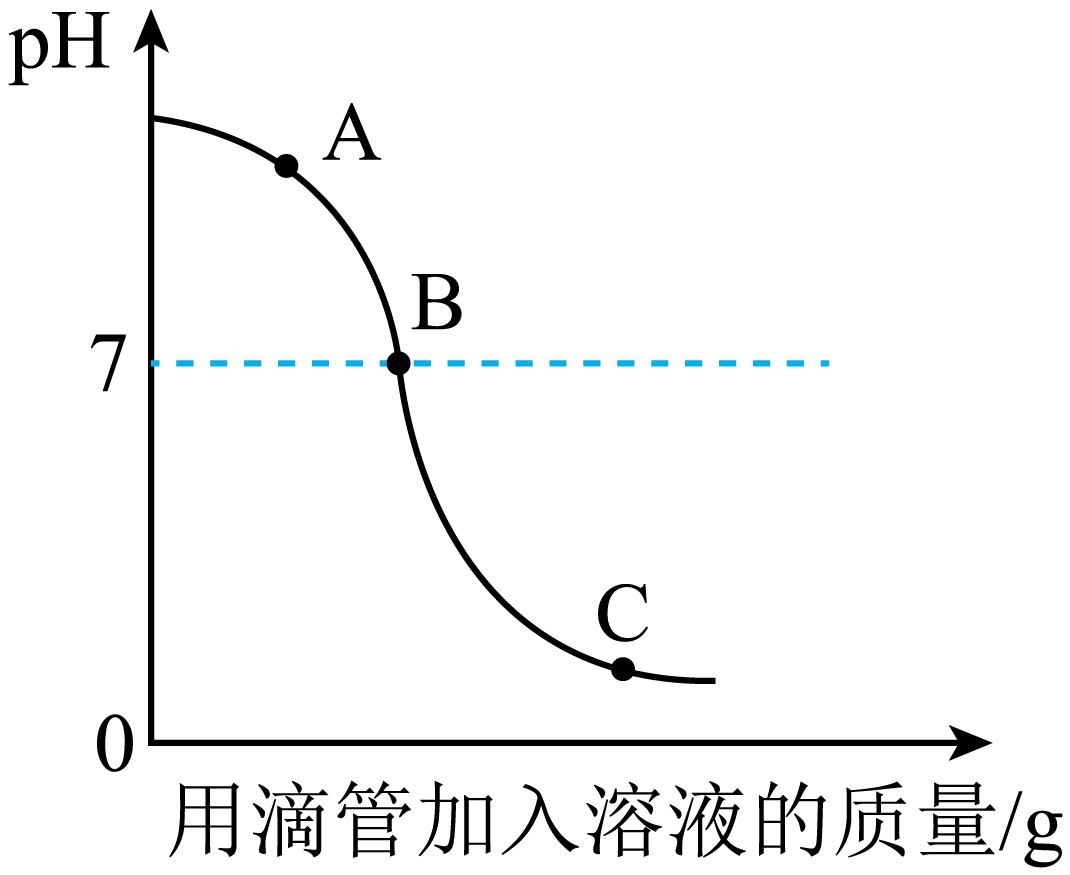
①请写出A点溶液中所含的溶质的化学式:。
②请写出该反应的实质:。
(2)、某同学设计下图所示的实验,通过质量的增减来确定碳酸钠溶液的变质程度。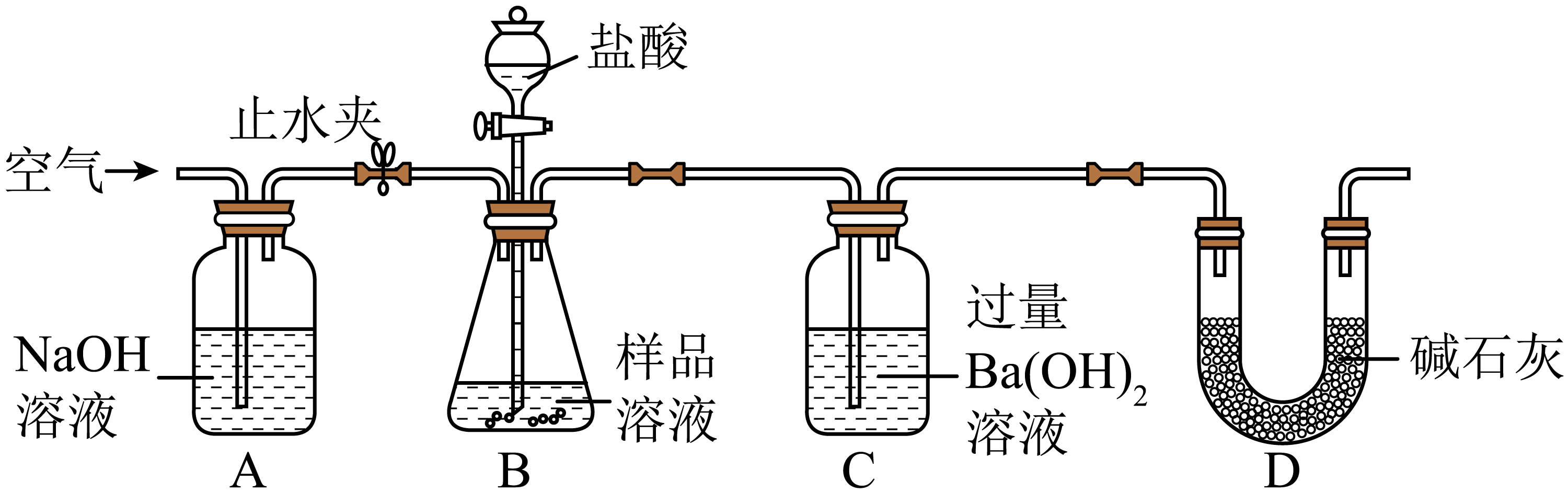
①实验开始前通入空气并打开A、B之间的止水夹,目的是。
②通入空气一段时间后称量C装置,连接装置后关闭止水夹,打开B装置中的分液漏斗活塞至不再有气泡产生,关闭分液漏斗活塞。产生气泡的原因是(用化学方程式表示),采用分液漏斗的优点是。
③再将A、B之间的止水夹打开,目的是。
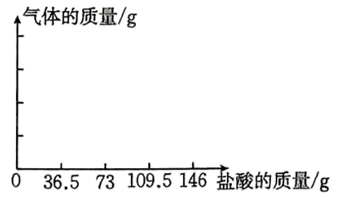
(3)、在实验过程中C装置内发生反应的化学方程式为;若称取样品溶液的质量为m1g,反应后得到BaCO3的质量为m2g,则该样品中碳酸钠的质量分数为(用含m1、m2的代数式表示)。21. 为测定所用盐酸的溶质质量分数,某实验小组取50g碳酸钙粉末于锥形瓶(瓶身100g)中,现将146g稀盐酸分4次逐渐加入装有碳酸钙粉末的锥形瓶,充分反应后,稀盐酸、锥形瓶与药品的总质量如图所示: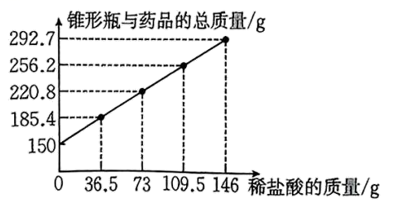 (1)、最终生成气体的质量为g。(2)、加入第次稀盐酸时恰好完全反应。(3)、请求出该盐酸的溶质质量分数。(4)、请画出产生气体的质量与加入盐酸的质量的变化曲线图。
(1)、最终生成气体的质量为g。(2)、加入第次稀盐酸时恰好完全反应。(3)、请求出该盐酸的溶质质量分数。(4)、请画出产生气体的质量与加入盐酸的质量的变化曲线图。