广东省广州市育才实验学校2022年中考模拟化学试题
试卷更新日期:2024-04-11 类型:中考模拟
一、单选题
-
1. 中华传统文化博大精深,下列古诗中不涉及化学变化的是( )A、梅须逊雪三分白,雪却输梅一段香 B、爆竹声中一岁除,春风送暖入屠苏 C、春蚕到死丝方尽,蜡炬成灰泪始干 D、千锤万凿出深山,烈火焚烧若等闲2. 战“疫”有化学,消毒来担当。在抗击“新冠”病毒中,常用二氧化氯(ClO2)、酒精、臭氧、次氯酸钠(NaClO)等消毒剂对公共场所进行消毒。下列说法正确的是( )A、ClO2中氧元素的质量分数比氯元素的高 B、2个臭氧分子可表示为3O2 C、NaClO中钠离子的符号为Na+1 D、装消毒液用的塑料瓶属于有机合成材料3. 2022年6月3日是传统节日端午节,广东咸肉粽口感鲜香,配料中五花肉富含的营养素是( )A、油脂 B、维生素 C、糖类 D、无机盐4. 如图为元素周期表第四周期的局部和部分原子的结构示意图。下列有关说法错误的是( )
 A、上述四种原子的核外电子排布都有4个电子层 B、锗元素的相对原子质量x大于69.72 C、稼原子在化学反应中容易失去电子,形成Ga3- D、硒离子的核外电子数为365. 对危险化学品要在包装标签上印有警示性标志。下列药品包装图标正确的是( )A、
A、上述四种原子的核外电子排布都有4个电子层 B、锗元素的相对原子质量x大于69.72 C、稼原子在化学反应中容易失去电子,形成Ga3- D、硒离子的核外电子数为365. 对危险化学品要在包装标签上印有警示性标志。下列药品包装图标正确的是( )A、 氯化钠
B、
氯化钠
B、 红磷
C、
红磷
C、 硫酸
D、
硫酸
D、 酒精
6. 空气是多种气体的混合物,下列生产生活中用到的气体来自空气的是( )A、用于飞艇的氦气 B、制硝酸用到的二氧化氮 C、用于做汽水的二氧化碳 D、做饭用到的天然气7. 中国科学家李兰娟院士的研究团队发现:达芦那韦(化学式C27H37N3O7S)能显著抑制新冠肺炎病毒复制。下列有关达芦那韦的说法正确的是( )A、从分类上看:达芦那韦属于无机化合物 B、从微观上看:每个达芦那韦分子中含有75个原子核 C、从宏观上看:达芦那韦是由碳、氢、氮、氧四种元素组成 D、从质量上着:达芦那韦中碳、氢、氧三种元素的质量比为27:37:78. 某兴趣小组做了以下实验,根据实验过程分析下列说法不正确的是( )
酒精
6. 空气是多种气体的混合物,下列生产生活中用到的气体来自空气的是( )A、用于飞艇的氦气 B、制硝酸用到的二氧化氮 C、用于做汽水的二氧化碳 D、做饭用到的天然气7. 中国科学家李兰娟院士的研究团队发现:达芦那韦(化学式C27H37N3O7S)能显著抑制新冠肺炎病毒复制。下列有关达芦那韦的说法正确的是( )A、从分类上看:达芦那韦属于无机化合物 B、从微观上看:每个达芦那韦分子中含有75个原子核 C、从宏观上看:达芦那韦是由碳、氢、氮、氧四种元素组成 D、从质量上着:达芦那韦中碳、氢、氧三种元素的质量比为27:37:78. 某兴趣小组做了以下实验,根据实验过程分析下列说法不正确的是( )
温度/℃
10
20
30
40
50
溶解度/g
20.9
31.6
X
63.9
85.5
A、溶液①溶质质量分数为20% B、溶液②中溶质与溶剂的质量比为1:2 C、30℃时硝酸钾溶解度:31.6<X<63.9 D、溶液③中再溶解35.5gKNO3为可成为饱和溶液9. 我国化学家研究出一种新型催化剂,在太阳光照射下实现了水的高效分解。该反应过程的微观示意图如下,下列说法错误的是( ) A、
A、 表示的物质属于氧化物
B、反应I的化学方程式为
C、反应Ⅱ中两种生成物的质量比为16:9
D、该成果对氢能源的推广应用有重要的实践意义
10. 下列物质混合后能够反应,且有明显现象的是( )A、向酚酞溶液中通入二氧化碳 B、稀硫酸与氢氧化钾混合 C、向氧化铜粉末中滴入氢氧化钠溶液 D、氯化镁与碳酸钠溶液混合11. 除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是:( )A、Zn粉(Fe):用ZnCl2溶液浸泡,过滤 B、碳粉(MnO2):滴入H2O2溶液,过滤 C、NaCl溶液(Na2SO4):加入适量MgCl2溶液过滤 D、CO2 (H2O):通过盛有浓硫酸的洗气瓶12. 下列所示的四个图像能正确反映对应变化关系的是( )
表示的物质属于氧化物
B、反应I的化学方程式为
C、反应Ⅱ中两种生成物的质量比为16:9
D、该成果对氢能源的推广应用有重要的实践意义
10. 下列物质混合后能够反应,且有明显现象的是( )A、向酚酞溶液中通入二氧化碳 B、稀硫酸与氢氧化钾混合 C、向氧化铜粉末中滴入氢氧化钠溶液 D、氯化镁与碳酸钠溶液混合11. 除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是:( )A、Zn粉(Fe):用ZnCl2溶液浸泡,过滤 B、碳粉(MnO2):滴入H2O2溶液,过滤 C、NaCl溶液(Na2SO4):加入适量MgCl2溶液过滤 D、CO2 (H2O):通过盛有浓硫酸的洗气瓶12. 下列所示的四个图像能正确反映对应变化关系的是( )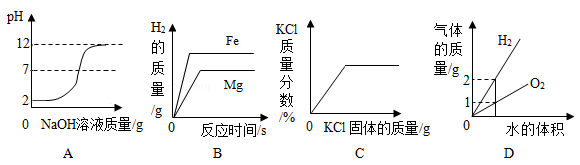 A、向pH=12的氢氯化钠溶液中加入pH=2的稀盐酸 B、将等质量的镁片和铁片投入到足量稀硫酸中 C、一定温度下不断向一定量水中加入氯化钾固体 D、电解水生成氢气和氧气质量13. 芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的。硅及其氧化物能发生如下反应:
A、向pH=12的氢氯化钠溶液中加入pH=2的稀盐酸 B、将等质量的镁片和铁片投入到足量稀硫酸中 C、一定温度下不断向一定量水中加入氯化钾固体 D、电解水生成氢气和氧气质量13. 芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的。硅及其氧化物能发生如下反应:①
②
③
④
下列说法不正确的是( )
A、反应③属于置换反应 B、上述反应中共生成两种可燃性气体 C、Na2SiO3中Si为+6价 D、Si和SiO2在一定条件下可以相互转化14. 下列实验操作对应的现象和结论正确的是( )实验操作
现象
结论
A
某待测液中加氯化钙溶液
有白色沉淀生成
该溶液为AgNO3溶液
B
将CO通入氧化铁粉末中
粉末由黑色变为红色
CO有还原性
C
将2根铜丝分别放入硫酸铝溶液和硝酸银溶液中,观察现象
硫酸铝溶液没有明显现象,硝酸银溶液逐渐变蓝,其中铜丝表面有银色物质析出
金属活动性顺序:Al>Cu>Ag
D
将铜片和黄铜片相互刻画
铜片上留下划痕,黄铜片无明显现象
合金硬度比组成它的纯金属硬度小
A、A B、B C、C D、D二、科普阅读题
-
15. 阅读下列短文并回答问题。
新能源汽车已经走进了我们的生活。与传统汽车使用化石燃料不同,新能源汽车的能量来源更加多元化。
I.电动汽车
电池能为电动汽车提供动力,几类电池的部分性能指标如图1所示。其中能量密度表示单位体积的电池所具有的能量。

Ⅱ.氢内燃车
氢内燃车以氢气为燃料,不排放任何污染物。氢气可通过电解水(原理如图2)等多种方式获得。据测算,1kg氢气完全燃烧可释放14.3×104kJ的热量,1kg汽油完全燃烧可释放4.6×104kJ的热量。

Ⅲ.乙醇汽车
乙醇汽东车乙醇为燃料。乙醇是可再生能源,可以通过发酵甘蔗、玉米等农作物,或发酵粮食收割后剩余的秸秆大量提取。
我国新能源汽车发展迅速,未来可期。
(1)、传统汽车采用化石燃料为能源。化石燃料包括煤、石油和。(2)、锂电池优于镍氢电池的性能指标是。(3)、1kg氢气完全燃烧,消耗氧气的质量为kg。(4)、图2中,A口产生的气体的化学式为。(5)、下列说法不正确的是____(填序号)。A、提供相同能量时,铝空电池的体积最大 B、氢内燃车与汽油车相比的优势在于相同质量氢气完全燃烧放出的热量比汽油多 C、图2中薄膜材料的相对分子质量可达几百万 D、农业大国盛产甘蔗和玉米,有利于推广乙醇汽车三、简答题
-
16. 石灰石是重要的化工原料,某实验小组为研究石灰石的分解,取三块形状大小相近的石灰石,一块不加热,另两块分别在酒精灯和酒精喷灯的火焰上加热 2min(假设杂质加热时不发生变化)。探究过程如图所示,下表为实验现象。

实验组别
实验条件
试管 A 中的现象
试管 B 中的现象
甲
未加热
固体无变化
无明显现象
乙
酒精灯加热
固体部分溶解
呈浅红色
丙
酒精喷灯加热
固体部分溶解
呈红色
(1)、实验乙、丙中,试管 B 溶液呈红色的原因是(用化学方程式表示)。(2)、乙组实验加热石灰石时,在火焰上方倒扣一个用澄清石灰水润湿的烧杯,石灰水变浑浊,出现浑浊的化学方程式为。此实验能否推断石灰石煅烧产生二氧化碳(填“能”或“不能”)(3)、丙组实验完成后,向试管 B 中逐滴滴入稀盐酸,至红色恰好褪去,轻轻晃动试管,溶液自下而上又变为红色。在下图中画出红色恰好褪去和重新变红时溶液中存在的微观粒子种类(粒子数目不作要求:水分子不必画出)。 (4)、为检验丙组实验中的石灰石只有部分分解,设计实验:取研细后的粉末少许于试管中,(补充完整操作和现象)。(5)、通过甲、乙、丙三组对比实验,得出影响石灰石分解的因素是。
(4)、为检验丙组实验中的石灰石只有部分分解,设计实验:取研细后的粉末少许于试管中,(补充完整操作和现象)。(5)、通过甲、乙、丙三组对比实验,得出影响石灰石分解的因素是。四、流程题
-
17. 轻质氧化镁(MgO)在橡胶工业上有重要用途。兴趣小组同学在实验室用工业炉渣废料(主要成分是MgO、CaO,含少量杂质SiO2)来制取轻质氧化镁。实验流程如下:
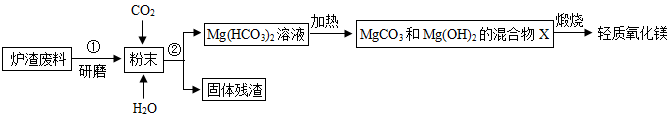
【查阅资料】Mg(OH)2、MgCO3受热易分解,分解温度不同,各生成对应的两种氧化物。请根据流程图回答下列问题:
(1)、步骤①研磨的目的是。(2)、写出粉末中MgO发生反应的化学方程式。(3)、小组同学用热分析仪对固体混合物X进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图。
①BC段的固体成分是。
②写出C点中固体发生反应的化学方程式。
③混合物X中MgCO3和Mg(OH)2的质量比是 , 若混合物X用aMgCO3·bMg(OH)2表示,a:b=。
五、填空题
-
18. 肺部CT检查是新冠肺炎的重要诊断方法,CT检查室墙体内部有一块厚铅板以防辐射,其利用了铅.(Pb)不易被X射线和Y射线等穿透的性质。(1)、写出下列物质类别中铅为+2价时对应物质的化学式。
Pb
单质
氧化物
碱
硝酸盐
(2)、根据铅的性质,下列说法正确的是____。(填标号)A、铅广泛用于制作铅笔 B、铅能与氢氧化钠溶液反应产生氢气 C、高温下,可用焦炭将铅的氧化物还原为铅 D、硝酸铅溶液中的硝酸银可加入铅粉除去(3)、已知硫酸铅(PbSO4)难溶于水,设计三种制备硫酸铅的方案(要求含铅原料分别属于属于不同类的化合物)。完成下表:方案
预期反应的化学方程式
依据的反应规律
①
。
盐+盐→新盐+新盐
②
。
(略)
③
。
(略)
六、实验题
-
19. 实验室常用化学方法制取氧气,某实验小组设计了相关的实验。(1)、比较氯酸钾和高锰酸钾制氧气速率。
①写出加热高锰酸钾制取氧气的化学方程式。
②实验方案:取相同质量的氯酸钾和高锰酸钾(需要催化剂的加入适量催化剂),用排水法收集氧气,比较相同时间内产生氧气体积的多少。
请从下图中选择合适的仪器(每种仪器限用一次)进行完整的探究实验,不需要用到的是(填标号)。
 (2)、已知MnO2、CuO都能做过氧化氢分解的催化剂,比较两者对过氧化氢分解的催化效果,所用实验装置如图所示。
(2)、已知MnO2、CuO都能做过氧化氢分解的催化剂,比较两者对过氧化氢分解的催化效果,所用实验装置如图所示。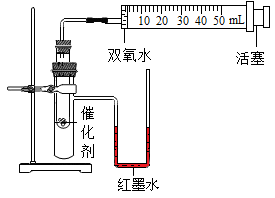
实验序号
过氧化氢溶液
催化剂
实验1
5mL4%
粉末状MnO2 0.2g
实验2
5mL4%
粉末状CuO 0.2g
①实验2中制取氧气的化学方程式为。
②实验需要测量并记录的数据有:氧气体积和。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右侧液面上升,原因是。(填字母)
a.过氧化氢分解产生氧气,使装置内压强变大
b.过氧化氢分解放热,使装置内气体膨胀,压强变大
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是。
20. 某校科技节有如下挑战项目:通过实验鉴别一包白色粉末的具体成分,已知其中含有NH4Cl、Ba(NO3)2、(NH4)2SO4、Ca(OH)2中的一种或几种。某同学进行了如下实验:a.取少量粉末于研钵中研磨,扇闻气味,没有刺激性气味。
b.取少量粉末于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
c.取步骤b所得上层清液于试管中,滴入几滴酚酞溶液,溶液不变色。
d.取步骤b所得上层清液于试管中,滴入BaCl2溶液,无明显现象。
(1)、实验b中有固体剩余的原因是发生了反应(用化学方程式表示)(2)、分析上述实验过程,关于该粉末的组成可以得到的结论是。(3)、根据上述实验操作和现象,设计实验方案进一步确定粉末的组成,完成下表。【已知:NH4Cl、(NH4)2SO4受热易分解。】
实验操作
预期现象与结论
若 , 则粉末的具体成分是。
若 , 则粉末的具体成分是。
-
-
-
-