河南省新乡市2023-2024学年高一上学期1月期末测试化学试题
试卷更新日期:2024-04-11 类型:期末考试
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
-
1. 2023年10月31日,神舟十六号载人飞船返回舱在东风着陆场成功着陆,神舟十六号载人飞行任务取得圆满成功。下列有关说法中错误的是( )A、飞船使用的推进剂属于纯净物 B、飞船的主体使用的是铁合金,铁合金的熔点比纯铁的高 C、飞船返回舱侧壁金属壳体用的铝合金材料,属于金属材料 D、神舟飞船芯片的主要成分是Si,Si可用于制造半导体材料2. 我国科学家研究发现,通过电催化结合生物合成的方式,可将二氧化碳()高效还原合成高浓度乙酸(),进一步利用微生物可以合成葡萄糖()和脂肪酸。下列说法错误的是( )A、是酸性氧化物 B、和CO互为同素异形体 C、葡萄糖的摩尔质量为 D、乙酸溶液可导电,乙酸属于电解质3. 下列各组离子能在溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、4. 下列操作中,符合实验安全规范的是( )A、闻氯气气味时,直接把鼻子凑到集气瓶口上闻 B、用试管夹夹住试管加热时,大拇指按住试管夹的短柄处 C、做钠与水反应的实验时,将未用完的钠放回原试剂瓶中 D、配制一定浓度的NaOH溶液时,将刚溶解的NaOH溶液立即转移至容量瓶中5. 实现下列物质间的转化,一定需要加入氧化剂的是( )A、 B、 C、 D、6. 性质决定用途。下列物质与性质、用途相匹配的是( )
选项
A
B
C
D
物质
NaClO
FeO
Fe
性质
易溶于水
淡黄色固体
红棕色
导热性好
用途
作游泳池的消毒剂
作潜水艇供氧剂
作红色颜料
铁锅炒菜
A、A B、B C、C D、D7. 下列溶液颜色的变化,与氧化还原反应无关的是( )A、使滴有酚酞的NaOH溶液变色 B、使酸性溶液褪色 C、漂粉精使品红溶液褪色 D、淀粉—KI溶液遇到溶液后变成蓝色8. 门捷列夫曾预测镓、钪、锗元素的存在及性质,莫塞莱也曾预测一种“类锰”元素。放射性元素锝(),其单质是从核燃料裂变产物中提取的,它的一种核素在临床医学诊断中应用很广。下列说法正确的是( )A、元素是第四周期元素 B、用D核轰击钼()靶也能得到 , 此过程属于化学变化 C、、、三种核素,物理性质与化学性质几乎相同 D、的质子数与中子数之差为129. “低钠饮料”是指钠含量低于120mg/100mL的饮料,“极低钠饮料”是指钠含量不高于40mg/100mL的饮料。下表是某一电解质水“营养成分表”(表中微粒浓度为平均值)中的一部分。下列有关说法正确的是( )离子
浓度
50mg/100mL
36mg/100mL
20mg/100mL
5mg/100mL
35mg/100mL
……
……
A、该电解质水带正电,不适合饮用 B、该电解质水中, C、用激光笔照射该电解质水,能看到一条光亮的通路 D、剧烈运动后,补充纯净水比补充电解质水要好10. 利用如图装置进行实验,不能达到实验目的的是( )
选项
气体X
溶液Y
实验目的
A
(HCl)
饱和溶液
除去的HCl
B
HCl
溶液
证明Cl的非金属性强于C的
C
淀粉—KI溶液
证明的氧化性强于的
D
()
浓硫酸
干燥
A、A B、B C、C D、D11. 我国科学家设计出仅需11步反应的人工合成淀粉路线,部分转化过程如图所示。已知HCHO的沸点为 , 为阿伏加德罗常数的值。下列说法正确的是( ) A、中含有的质子数为 B、“碳固定”时,每生成 , 转移的电子数为 C、等质量的与中含有的氧原子数之比为 D、标准状况下,等物质的量的HCHO与所占的体积均为22.4L12. 在酸性条件下,具有氧化性。图示过程可实现转化为。下列分析正确的是( )
A、中含有的质子数为 B、“碳固定”时,每生成 , 转移的电子数为 C、等质量的与中含有的氧原子数之比为 D、标准状况下,等物质的量的HCHO与所占的体积均为22.4L12. 在酸性条件下,具有氧化性。图示过程可实现转化为。下列分析正确的是( ) A、NO、为中间产物 B、反应③中为氧化剂 C、每转化需要 D、反应①的离子方程式为13. 宏观辨识与微观探析是化学学科核心素养之一。已知酸性强弱: , 下列离子方程式书写正确的是( )A、用溶液蚀刻覆铜板: B、向漂白液中通入过量的: C、向中加入稀盐酸: D、溶液与过量溶液反应:14. X、Y、Z、W、E为原子序数依次增大的短周期主族元素,X、Y、Z、E在元素周期表中的相对位置如图,X为空气中含量最高的元素,W是同周期中原子半径最大的元素。下列说法正确的是( )
A、NO、为中间产物 B、反应③中为氧化剂 C、每转化需要 D、反应①的离子方程式为13. 宏观辨识与微观探析是化学学科核心素养之一。已知酸性强弱: , 下列离子方程式书写正确的是( )A、用溶液蚀刻覆铜板: B、向漂白液中通入过量的: C、向中加入稀盐酸: D、溶液与过量溶液反应:14. X、Y、Z、W、E为原子序数依次增大的短周期主族元素,X、Y、Z、E在元素周期表中的相对位置如图,X为空气中含量最高的元素,W是同周期中原子半径最大的元素。下列说法正确的是( )X
Y
Z
E
A、最高正价:Z>Y>X B、简单氢化物的酸性:Z>E C、W的单质在Y的单质中燃烧生成 D、向Y的最简单氢化物中通入Z的单质,可以置换出Y的单质二、非选择题:本题共4小题,共58分。
-
15. 阅读下面一段材料,根据所学知识,回答下列问题:
将用砂纸打磨过的在空气中燃烧,生成和 , 氮化镁溶于水得到固体和 , 将固体溶于 , 得到无色溶液,将无色溶液经过一系列操作得到 , 将在气流中加热得到。
(1)、镁在元素周期表中的位置是。(2)、常温下,上述有标号的物质中,能导电的是(填标号,下同),属于电解质的有。(3)、写出氮化镁固体溶于水发生反应的化学方程式: , 该反应为(填“氧化还原”或“非氧化还原”)反应。(4)、实验1:将一块金属钠投入溶液中,写出发生反应的离子方程式:。实验2:将已经打磨过的、大小相同的镁条与铝片分别同时投入足量的稀硫酸中,相同时间内,观察到的现象为 , 可得出的结论是。
16. 次氯酸溶液是常用的消毒剂,可利用一氧化二氯( , 可通过与潮湿的反应制得)与水反应得到,实验装置如图所示(夹持装置已略)。的部分性质如下表:
物理性质
常温下,具有强烈刺激性气味的黄棕色气体:熔点:;沸点:
化学性质
极易溶于水并与水反应生成HClO,以上分解为和;强氧化性,与有机物、还原剂接触或浓度过高时会发生爆炸
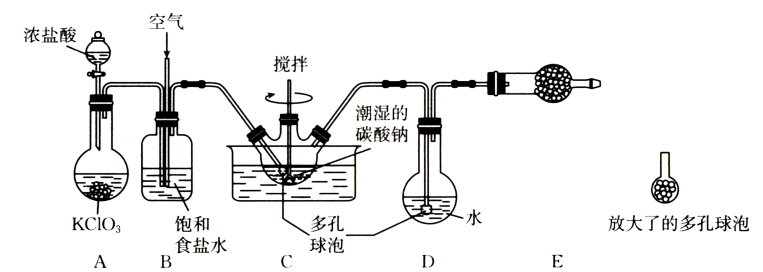 (1)、盛装浓盐酸的仪器名称为 , 装置A中发生反应的离子方程式为。(2)、装置B中饱和食盐水的作用是 , 装置C中多孔球泡和搅拌棒的作用是。(3)、装置C的水槽中水温最好控制在(填标号),原因是。
(1)、盛装浓盐酸的仪器名称为 , 装置A中发生反应的离子方程式为。(2)、装置B中饱和食盐水的作用是 , 装置C中多孔球泡和搅拌棒的作用是。(3)、装置C的水槽中水温最好控制在(填标号),原因是。A. B. C.
(4)、装置C中潮湿的与发生反应:(请配平该方程式)。(5)、装置D中所得的溶液应保存在棕色试剂瓶中并避免光照,长时间不避光保存,该溶液会变质。检验该溶液是否完全变质的操作及现象是。17. W、X、Y、Z、Q、R是核电荷数依次增大的六种短周期主族元素。W的一种核素可用于考古,X原子的最外层电子数是其内层电子数的3倍,Y在短周期元素中金属性最强,Z是地壳中含量最多的金属元素,Q与X同主族。请回答下列问题:
(1)、W的元素名称为 , R的元素符号为。(2)、X、Y、Z、Q的简单离子半径由大到小的顺序为(用离子符号表示)。(3)、W、X、Q的最简单氢化物中,沸点最高的是(用化学式表示),原因是。(4)、将R的单质通入溶液中能够证明R的非金属性强于Q的,请写出该反应的化学方程式:。(5)、向溶液中滴加少量稀 , 发生反应的离子方程式为。(6)、Z的氧化物能与R的最高价氧化物对应的水化物反应,该反应的离子方程式为。18. 某工厂以矿石(主要成分为 , 还含、CuO、等不溶性杂质)为原料制备绿矾(),其生产工艺如下: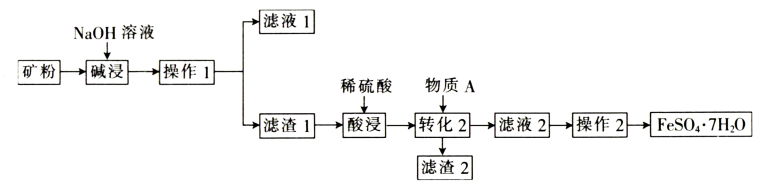
请回答下列问题:
(1)、碱浸时,发生的反应主要有(写离子方程式)和。(2)、将矿石变成矿粉的目的是。(3)、酸浸后的溶液中存在 , 检验该离子的操作及现象为。(4)、滤渣2的主要成分是(填化学式)。(5)、配制溶液时,通常会在溶液中加入少量的铁粉,请用离子方程式说明原因:。(6)、防治缺铁性贫血的有效方法是补充铁剂,常见的补铁剂有硫酸亚铁、葡萄糖酸亚铁、富马酸亚铁等,通常搭配维生素C一起服用,体现了维生素C的(填“氧化性”或“还原性”)。(7)、测定所得样品的纯度:取8.5g制得的样品,将其配制成100mL溶液,取25.00mL配制好的溶液置于锥形瓶中,加入溶液,恰好完全反应(不考虑杂质参与反应,已知发生的反应为)。①若配制样品溶液的过程中,容量瓶中有少量蒸馏水残留,则对所配溶液浓度的影响是(填“偏低”“偏高”或“无影响”)。
②样品的纯度约为(保留三位有效数字)。