海南省部分学校2023-2024学年高三上学期期末联考化学试题
试卷更新日期:2024-04-11 类型:期末考试
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 衣食住行皆化学。下列说法正确的是( )A、太阳能发电时将化学能转化为电能 B、利用改良酸性土壤 C、采用可降解的聚乳酸塑料可减少“白色污染” D、生产水泥的原料主要有石英砂、纯碱和石灰石2. 用图示的方法能够直观形象地将化学知识进行呈现。下列图示正确的是( )A、分子的空间填充模型:
 B、基态氨原子的轨道表示式:
B、基态氨原子的轨道表示式: C、基态镁原子最外层电子的电子云轮廓图:
C、基态镁原子最外层电子的电子云轮廓图: D、的形成过程:
D、的形成过程: 3. 下列有关实验仪器与实验操作的叙述正确的是( )A、蒸馏完毕后,应先停止通冷凝水,再停止加热 B、滴定接近终点时,滴定管尖嘴不能触碰锥形瓶内壁 C、粗盐提纯过程中,需要用到的实验仪器有坩埚、漏斗、玻璃棒等 D、用NaOH固体配制一定物质的量浓度溶液时,溶解后冷却至室温再转移到容量瓶中4. 下列有关物质的性质与用途具有对应关系的是( )A、易溶于水,可用于制硝酸 B、CO具有还原性,可用来冶炼铁矿石 C、受热易分解,可用作食用碱 D、具有漂白性,可用作食品的抗氧化剂5. 近日,东北林业大学某课题组利用木质素生产的单芳烃a,b、c的结构如图所示。
3. 下列有关实验仪器与实验操作的叙述正确的是( )A、蒸馏完毕后,应先停止通冷凝水,再停止加热 B、滴定接近终点时,滴定管尖嘴不能触碰锥形瓶内壁 C、粗盐提纯过程中,需要用到的实验仪器有坩埚、漏斗、玻璃棒等 D、用NaOH固体配制一定物质的量浓度溶液时,溶解后冷却至室温再转移到容量瓶中4. 下列有关物质的性质与用途具有对应关系的是( )A、易溶于水,可用于制硝酸 B、CO具有还原性,可用来冶炼铁矿石 C、受热易分解,可用作食用碱 D、具有漂白性,可用作食品的抗氧化剂5. 近日,东北林业大学某课题组利用木质素生产的单芳烃a,b、c的结构如图所示。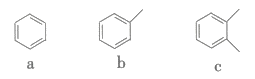
下列叙述正确的是( )
A、a能与溴水发生取代反应 B、在浓硫酸存在下,b能与浓硝酸反应制TNT C、c的一溴代物有2种 D、a的密度比水小,c的密度比水大6. 近期,美国航天局(NASA)通过韦伯太空望远镜发现在一颗巨大系外行星(K2-18b)的大气层中存在生命迹象气体——二甲硫醚()。已知:二甲硫醚的沸点为38℃,熔点为-98℃。下列有关叙述正确的是( )A、标准状况下,11.2L二甲硫醚中含4mol键 B、二甲硫醚分子中电负性最小的元素是硫元素 C、6.2g二甲硫醚分子中含杂化的原子数为 D、乙二醇与二甲硫醚的相对分子质量相等但乙二醇的沸点高于38℃7. 利用计算机技术测得乙炔在催化作用下生成的反应历程及相对能量变化如图所示。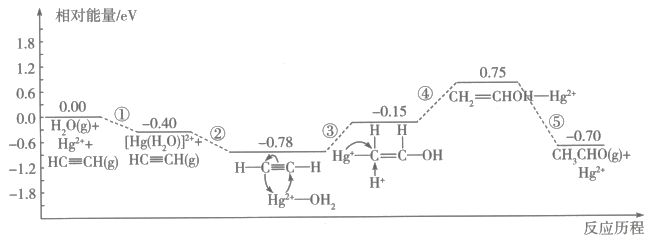
下列说法错误的是( )
A、1mol与1mol的总能量比1mol的能量低 B、分子中,键角小于 C、压缩反应体系体积,压强增大,可以提高乙炔的平衡转化率 D、历程①中有键生成,历程③中有键断裂8. 硫脲(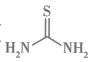 )可用作橡胶的硫化促进剂、金属矿物的浮选剂。测定工业样品中硫脲的质量分数的方法:称取g样品,加水溶解配成250mL溶液,取25mL溶液于锥形瓶中,加入稀硫酸酸化,用酸性标准溶液滴定,滴定至终点时消耗标准溶液mL[已知滴定时发生反应: , 假设杂质不参与反应]。下列叙述正确的是( ) A、硫脲中硫元素的化合价为+2 B、滴定时碳、氮元素发生氧化反应 C、样品中硫脲的质量分数可表示为 D、若滴定管中滴定前有气泡,滴定后无气泡,会使测定结果偏小
)可用作橡胶的硫化促进剂、金属矿物的浮选剂。测定工业样品中硫脲的质量分数的方法:称取g样品,加水溶解配成250mL溶液,取25mL溶液于锥形瓶中,加入稀硫酸酸化,用酸性标准溶液滴定,滴定至终点时消耗标准溶液mL[已知滴定时发生反应: , 假设杂质不参与反应]。下列叙述正确的是( ) A、硫脲中硫元素的化合价为+2 B、滴定时碳、氮元素发生氧化反应 C、样品中硫脲的质量分数可表示为 D、若滴定管中滴定前有气泡,滴定后无气泡,会使测定结果偏小二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
-
9. 二氧化碳固定是实现“碳达峰、碳中和”的重要途径。工业上利用制备高附加值化工品的化学反应是。在一定温度下,向10L恒容密闭容器中充入6mol和6mol发生上述反应,测得的物质的量与时间的关系如图所示。
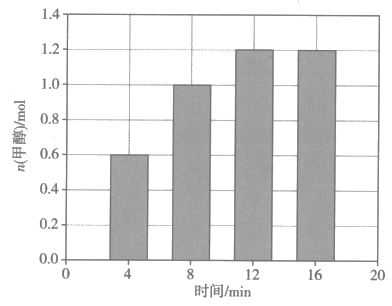
下列叙述正确的是( )
A、混合气体密度不变时,该反应达到平衡状态 B、该反应开始后,化学反应速率先慢后快,最后达到平衡状态 C、在8min时,的正反应速率大于的逆反应速率 D、0~4min内的平均反应速率为10. 氟硼酸铵()易溶于水,溶液呈酸性,可用作铝、铜和铝合金焊接助熔剂。与HF反应后再用中和得到。下列叙述正确的是( )A、HF、都是由极性键构成的极性分子 B、1mol中含有配位键的数目为 C、与的VSEPR模型相同 D、推测可与HF反应生成11. 根据下列实验操作及现象得出的结论正确的是( )选项
实验操作及现象
结论
A
常温下,在铝铁合金表面滴加98%的硫酸,没有明显现象
铝、铁不和浓硫酸反应
B
在酸性溶液中滴加对甲基苯酚,溶液褪色
酚羟基能被酸性溶液氧化
C
在中加入柠檬酸,固体溶解,有气泡产生
柠檬酸的酸性比的强
D
在溶液中滴加酸化的双氧水,溶液变色
还原性:
A、A B、B C、C D、D12. Y是一种降血脂药物,合成路线片段如图所示:
下列叙述正确的是( )
A、X中所有碳原子可能共平面 B、X能发生消去反应 C、Y中含有2个手性碳原子 D、1molY最多能与5mol发生加成反应13. 近日,中国科学院大连化学物理研究所研究员肖建平团队在合金催化剂上电催化一氧化氮还原反应合成氨研究方面取得新进展,模拟装置如图所示。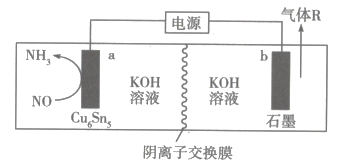
下列叙述正确的是( )
A、b极与电源负极连接,发生还原反应 B、工作时通过阴离子交换膜由b极向a极迁移 C、a极的电极反应式为 D、同温同压下,生成、气体R的体积相等14. 25℃时,向一定浓度二元弱酸溶液[]中滴加NaOH溶液,滴加过程中,溶液中、、的分布系数与pH的关系如图所示。已知分布系数(其中X分别代表、、)。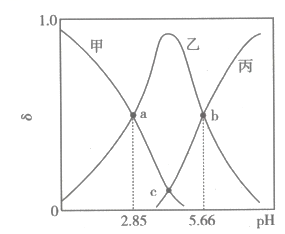
下列叙述错误的是( )
A、时, B、c点时溶液中的物质的量恰好为0.1mol C、的化学平衡常数 D、b点溶液中水的电离受到促进三、非选择题:本题共5小题,共60分。
-
15. 纳米级硒化锰(MnSe)是一种半导体材料,难溶于水。以锰渣(主要成分是 , 含少量、CuO)为原料制备硒化锰的流程如图所示:
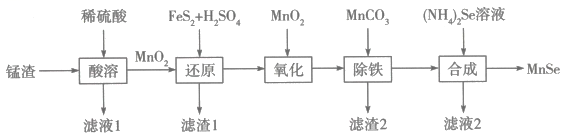
回答下列问题:
(1)、为了提高“酸溶”速率,宜采取的措施有(填两条)。(2)、滤渣1的主要成分之一是单质,“还原”得到的滤液中溶质为和。写出“还原”反应的离子方程式:。(3)、“氧化”中还原剂、氧化剂的物质的量之比为。(4)、滤渣2的主要成分是(填化学式)。常温下,。离子浓度时认为该离子已沉淀完全。“除铁”调节pH的最小值为。(5)、“合成”中分离MnSe的操作名称是。16. 燃煤脱硫是科研工作者的重要研究课题,石灰法是其中之一,相关反应如下:相关反应
平衡常数()
ⅰ
ⅱ
ⅲ
请回答下列问题:
(1)、、、之间的关系为(用含、的代数式表示);图中能表示随变化的直线为(填“Ⅰ”或“Ⅱ”)。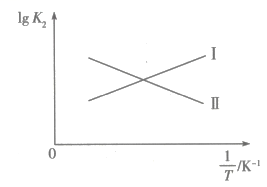 (2)、在某密闭容器中按一定比例充入、 , 并加入足量的 , 总压强保持8MPa不变的条件下仅发生上述反应ⅲ,测得在两种温度下的平衡转化率与混合气体的投料比之间的关系如图所示。
(2)、在某密闭容器中按一定比例充入、 , 并加入足量的 , 总压强保持8MPa不变的条件下仅发生上述反应ⅲ,测得在两种温度下的平衡转化率与混合气体的投料比之间的关系如图所示。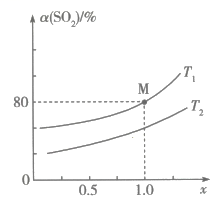
①温度 , 理由是。
②在温度下,该反应的平衡常数(用分数表示,是用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。
③其他条件不变,若向M点反应体系中充入一定量的(不参与反应),则的平衡转化率(填“增大”“减小”或“不变”),原因是。
17. 碳酸钠俗称纯碱,是一种重要的化工原料,在生活、生产和实验研究中均有广泛应用。某学习小组探究溶液与盐溶液反应的产物,进行如下实验。(1)、配制100mL的溶液。①配制溶液过程中用托盘天平称量固体的质量为g。
②定容时,加蒸馏水不慎超过刻度线,处理的方法是。
(2)、通过下列实验探究溶液与盐溶液反应,记录实验现象如下表:装置
实验
试剂a
现象
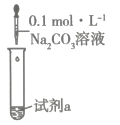
甲
4mL溶液
产生白色沉淀
乙
4mL溶液
产生白色沉淀及大量气体
丙
4mL溶液
产生白色沉淀及大量气体
为了探究白色沉淀的成分,设计了热分解实验,其装置如图所示:
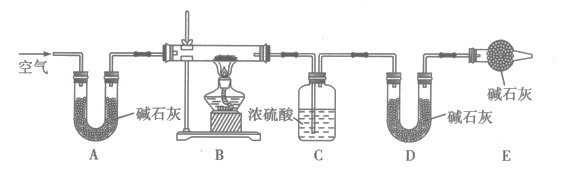
将实验乙、丙所得沉淀分别置于装置B中使样品完全分解,实验结束后,数据记录如下:
样品
加热前样品质量/g
加热后样品质量/g
装置C增重/g
装置D增重/g
实验乙样品
10.4
6.8
3.6
0
实验丙样品
22.4
16.2
1.8
4.4
①实验甲产生白色沉淀反应的离子方程式为。
②装置E的作用是。
③通过热分解实验可判断实验乙所得白色沉淀的成分为(填化学式),实验乙反应的离子方程式为。
④实验丙所得白色沉淀的化学式可表示为 , 则。
18. 茅苍术醇是一种有效的抗癌药物,其一种合成路线如图所示: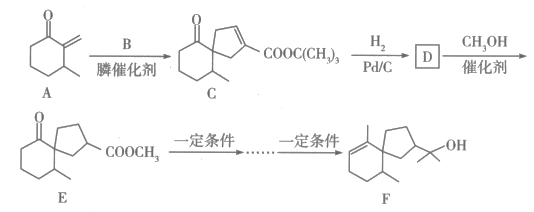
已知:①
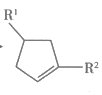 (、可以是烃基或含氧基团);
(、可以是烃基或含氧基团);②
请回答下列问题:
(1)、C中含氧官能团的名称为;F的分子式为(2)、B在酸性条件下发生水解反应生成和。①按系统命名法,的名称为。
②写出实验室由和反应生成B的化学方程式:(注明反应条件)。
③与在膦催化剂作用下生成一种五元环状有机物,该有机物的结构简式为。
(3)、写出下列反应的反应类型:C→D、D→E。(4)、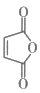 是合成哒嗪化合物的中间体,以1,3-丁二烯()为原料,补全合成
是合成哒嗪化合物的中间体,以1,3-丁二烯()为原料,补全合成 的路线:
的路线: (无机试剂任选,反应条件无需写出,补写部分不超过四步)。 19. 镍及其合金是常用的催化剂,在化学反应中广泛应用。(1)、基态镍原子的价电子排布式为。(2)、镍形成的团簇分子能提高还原为CO的活性。中碳原子的杂化方式为。(3)、在Ni和合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。
(无机试剂任选,反应条件无需写出,补写部分不超过四步)。 19. 镍及其合金是常用的催化剂,在化学反应中广泛应用。(1)、基态镍原子的价电子排布式为。(2)、镍形成的团簇分子能提高还原为CO的活性。中碳原子的杂化方式为。(3)、在Ni和合金催化剂表面,5-羟甲基糠醛按需选择性催化加氢制呋喃二醇,反应如图所示。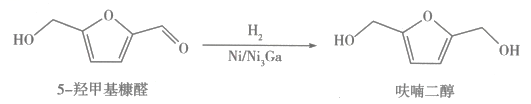
①常用银氨溶液检验5-羟甲基糠醛和呋喃二醇。制备银氨溶液的操作如下:向盛有溶液的洁净试管中滴加稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是。相对于的稀氨水,所得到的银氨溶液的pH(填“升高”“降低”或“不变”),其原因是。
②呋喃二醇的沸点高于5-羟甲基糠醛,其主要原因是。
(4)、羰基镍[]常作催化剂,它的熔点为-25℃,沸点为43℃。羰基镍的晶体类型是 , 其中心原子镍的配位数为。(5)、Ni和Nb组成的合金的晶胞结构如图所示。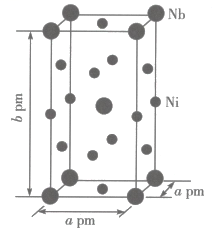
设表示阿伏加德罗常数的值,该晶体的密度为(列出计算式)。