贵州省黔东南州2023-2024学年高一上学期期末考试化学试题
试卷更新日期:2024-04-11 类型:期末考试
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 味精能增加食品的鲜味,是一种常用的增味剂,其主要成分M的结构如图所示,下列说法正确的是( )
 A、氧是第二周期第IVA族元素 B、中子数为8的碳原子: C、Na原子的结构示意图:
A、氧是第二周期第IVA族元素 B、中子数为8的碳原子: C、Na原子的结构示意图: D、核电荷数:Na>O>N>C>H
2. 工业上制备NaOH一般不采用与反应的方法,而主要采用电解饱和食盐水的方法,下列说法正确的是( )A、当光束通过饱和食盐水时,可以看到一条光亮的“通路” B、往NaOH溶液中滴入几滴酚酞溶液,可观察到氢氧化钠溶液变蓝 C、与生成NaOH的反应属于氧化还原反应 D、用铂丝蘸取NaOH溶液,在外焰上灼烧,可直接观察到火焰呈黄色3. 铁元素可以形成三种氧化物,分别是氧化亚铁、三氧化二铁和四氧化三铁,下列说法正确的是( )A、氧化亚铁是一种黑色粉末,且氧化亚铁属于合金 B、四氧化三铁常用作油漆的红色颜料 C、三氧化二铁属于碱性氧化物 D、铁在纯氧中燃烧的产物为三氧化二铁4. 有科学家提出,使用氯气对自来水消毒时,氯气会与水中、的有机物发生反应,生成的有机氯可能对人体有害,下列说法正确的是( )A、常温下,氯气与水发生的反应为 B、可用硝酸酸化的硝酸银来检验久置后的氯水中是否含有 C、能使湿润的有色布条褪色,则氯气具有漂白性 D、实验室制备氯气发生反应的化学方程式为5. 不锈钢是最常见的一种合金钢,它的合金元素主要是铬(Cr)和镍(Ni),下列说法正确的是( )A、不锈钢的主要成分为铁 B、的质子数为52 C、不锈钢属于纯净物 D、的核外电子数与中子数相差216. 下列表中
D、核电荷数:Na>O>N>C>H
2. 工业上制备NaOH一般不采用与反应的方法,而主要采用电解饱和食盐水的方法,下列说法正确的是( )A、当光束通过饱和食盐水时,可以看到一条光亮的“通路” B、往NaOH溶液中滴入几滴酚酞溶液,可观察到氢氧化钠溶液变蓝 C、与生成NaOH的反应属于氧化还原反应 D、用铂丝蘸取NaOH溶液,在外焰上灼烧,可直接观察到火焰呈黄色3. 铁元素可以形成三种氧化物,分别是氧化亚铁、三氧化二铁和四氧化三铁,下列说法正确的是( )A、氧化亚铁是一种黑色粉末,且氧化亚铁属于合金 B、四氧化三铁常用作油漆的红色颜料 C、三氧化二铁属于碱性氧化物 D、铁在纯氧中燃烧的产物为三氧化二铁4. 有科学家提出,使用氯气对自来水消毒时,氯气会与水中、的有机物发生反应,生成的有机氯可能对人体有害,下列说法正确的是( )A、常温下,氯气与水发生的反应为 B、可用硝酸酸化的硝酸银来检验久置后的氯水中是否含有 C、能使湿润的有色布条褪色,则氯气具有漂白性 D、实验室制备氯气发生反应的化学方程式为5. 不锈钢是最常见的一种合金钢,它的合金元素主要是铬(Cr)和镍(Ni),下列说法正确的是( )A、不锈钢的主要成分为铁 B、的质子数为52 C、不锈钢属于纯净物 D、的核外电子数与中子数相差216. 下列表中 各组物质之间通过一步反应不能实现如图所示转化的是( )
各组物质之间通过一步反应不能实现如图所示转化的是( )
选项
X
Y
Z
A
B
C
D
A、A B、B C、C D、D7. 家庭厨卫管道的固体疏通剂的主要成分有NaOH和铝粉,下列说法正确的是( )A、0.5molNaOH的质量为40g B、地壳中元素的含量:Al>O C、铝在空气中不易被氧化,是因为其金属活动性较差 D、Al与NaOH溶液反应的化学方程式为8. 侯氏制碱法涉及的反应有 , 下列说法错误的是( )A、的空间结构:直线形 B、的结构式: C、NaCl的电子式:
C、NaCl的电子式: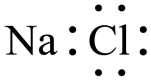 D、属于离子化合物
9. 下列说法正确的是( )A、Na通常保存在煤油中,则Li也通常保存在煤油中 B、过量的铜粉与反应生成 , 则过量的铁粉与反应生成 C、加热条件下,Na与反应生成 , 则Li与反应生成 D、纯净的在中安静地燃烧,则铁丝在纯净的中也安静地燃烧10. 漂白液、漂粉精既可用作漂白棉、麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂,下列说法正确的是( )A、漂粉精的主要成分仅为 B、漂白液在浓盐酸中能大量存在 C、漂粉精暴露在空气中易变质的原因为 D、漂白液可用于漂白棉、麻、纸张的原因为漂白液具有还原性11. 工业废水中含有的重铬酸根离子有毒,工业废水必须处理达标后才能排放,工业上常用作处理剂,发生反应的离子方程式为 , 下列说法正确的是( )A、溶液不能用来刻蚀电路板中的Cu B、该反应中氧化产物与还原产物的物质的量之比为 C、可用过量的锌粉除去中含有的少量 D、该反应中,每消耗 , 同时转移的电子的物质的量为0.6mol12. 红热的铁粉与水蒸气发生的反应为 , 设为阿伏加德罗常数的值,下列说法正确的是( )A、通常状况下,1.8g水分子中,所含的电子总数为 B、该反应中,每消耗1.68gFe,同时转移的电子数为 C、标准状况下,分子中,所含的质子数为 D、等物质的量的和中,所含的氢原子总数均为:13. 下列化学方程式书写正确的是( )A、少量的通入溶液中: B、少量的NaOH溶液滴加到溶液中: C、少量的KOH溶液滴加到溶液中: D、少量的稀盐酸滴加到溶液中:14. 四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构且W原子的最外层电子数是其内层电子数的3倍,X的原子半径是短周期主族元素中最大的,W与Y同族。下列说法错误的是( )A、最高价氧化物对应水化物的酸性:Z>Y B、最简单氢化物的稳定性:Z>Y C、简单离子半径:Y>Z>W>X D、最简单氢化物的沸点:Z>Y>W
D、属于离子化合物
9. 下列说法正确的是( )A、Na通常保存在煤油中,则Li也通常保存在煤油中 B、过量的铜粉与反应生成 , 则过量的铁粉与反应生成 C、加热条件下,Na与反应生成 , 则Li与反应生成 D、纯净的在中安静地燃烧,则铁丝在纯净的中也安静地燃烧10. 漂白液、漂粉精既可用作漂白棉、麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂,下列说法正确的是( )A、漂粉精的主要成分仅为 B、漂白液在浓盐酸中能大量存在 C、漂粉精暴露在空气中易变质的原因为 D、漂白液可用于漂白棉、麻、纸张的原因为漂白液具有还原性11. 工业废水中含有的重铬酸根离子有毒,工业废水必须处理达标后才能排放,工业上常用作处理剂,发生反应的离子方程式为 , 下列说法正确的是( )A、溶液不能用来刻蚀电路板中的Cu B、该反应中氧化产物与还原产物的物质的量之比为 C、可用过量的锌粉除去中含有的少量 D、该反应中,每消耗 , 同时转移的电子的物质的量为0.6mol12. 红热的铁粉与水蒸气发生的反应为 , 设为阿伏加德罗常数的值,下列说法正确的是( )A、通常状况下,1.8g水分子中,所含的电子总数为 B、该反应中,每消耗1.68gFe,同时转移的电子数为 C、标准状况下,分子中,所含的质子数为 D、等物质的量的和中,所含的氢原子总数均为:13. 下列化学方程式书写正确的是( )A、少量的通入溶液中: B、少量的NaOH溶液滴加到溶液中: C、少量的KOH溶液滴加到溶液中: D、少量的稀盐酸滴加到溶液中:14. 四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构且W原子的最外层电子数是其内层电子数的3倍,X的原子半径是短周期主族元素中最大的,W与Y同族。下列说法错误的是( )A、最高价氧化物对应水化物的酸性:Z>Y B、最简单氢化物的稳定性:Z>Y C、简单离子半径:Y>Z>W>X D、最简单氢化物的沸点:Z>Y>W二、非选择题:本题共4小题,共58分。
-
15. 镁及其合金是用途很广泛的金属材料。大量的镁是从海水中提取的,从海水中提取镁的主要步骤如图所示。

回答下列问题:
(1)、在水中的电离方程式为。(2)、氯化钠属于(填“离子”或“共价”)化合物,其形成过程可表示为。(3)、与盐酸反应的离子方程式为。(4)、在、NaCl、NaOH的混合溶液中:①验证该混合溶液中含有的方法及现象为。
②NaOH中存在的化学键为。
③将少量的氧化铝投入该混合溶液中,发生反应的化学方程式为。
(5)、电解熔融氯化镁时,每生成1.2gMg,同时转移的电子数为。16. 验证次氯酸光照分解的产物可以设计成数字化实验(同时开始采集数据),此实验可以测定光照过程中氯水的pH、氯水中氯离子的浓度、广口瓶中氧气的体积分数的变化。三者变化趋势如图所示,回答下列问题:(1)、如图所示:
①新制氯水中所含微粒的种类有种。
②往a点对应的溶液中滴入淀粉碘化钾溶液,可能观察到的现象为。
③0~150s的过程中,氯水的pH逐渐减小的原因为(用离子方程式表示)。
(2)、如图所示:
①b点对应的溶液中,所含氯离子的浓度为。
②c点对应的溶液中,加入少量的溶液,发生反应的离子方程式为。
(3)、如图所示:
①写出一种的用途:。
②相同原子个数的与的质量之比为。
③标准状况下,与g所含的电子总数相同。
17. A~R 9种元素在元素周期表中的位置如图。周期
族
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
A
E
F
3
C
D
G
H
4
B
R
回答下列问题:
(1)、E的原子结构示意图为。(2)、常温下,的状态为(填“液”、“固”或“气”)态。(3)、写出单质A与在加热条件下发生反应的化学方程式:。(4)、化合物与NaOH溶液反应的离子方程式为。(5)、H元素形成的单质的用途有(填一种即可)。(6)、最高价氧化物对应水化物的碱性:C(填“>”、“<”或“=”)A,判断的理由为。(7)、化合物所含分子中的电子总数为 , 与其具有相同电子数的化合物分子为(填标号)。a. b. c. d.
18. 向仅含有、、的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
提示:①不考虑、与水的反应;
②不考虑气体的逸出;
③不考虑水电离出的和。
④产物只有、和。
回答下列问题:
(1)、 , 曲线I对应的离子方程式为。(2)、b点溶液中,共含有种离子,分别为(填离子符号)。(3)、 , 曲线II对应的离子方程式为。(4)、c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为。