陕西省汉中市汉台区2023-2024学年高三上学期1月期末化学试题
试卷更新日期:2024-04-11 类型:期末考试
一、选择题(本大题共14小题,每小题3分,计42分.每小题只有一个选项是符合题意的)
-
1. 下列有关传统文化的解读错误的是( )
选项
传统文化摘要
解读
A
此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁,后乃煎炼而成——《开宝本草》
“煎炼”涉及重结晶操作
B
世间丝、麻、裘、褐皆具素质——《天工开物》
文中“裘”的主要成分是纤维素
C
落红不是无情物,化作春泥更护花——《己亥杂诗》
蕴含着自然界中的碳、氮循环
D
日照澄洲江雾开,淘金女伴满江隈——《浪淘沙》
此现象与胶体性质有关
A、A B、B C、C D、D2. 下列物质的应用与氧化还原反应有关的是( )A、煅烧石灰石制生石灰 B、铁粉用作食品袋内的脱氧剂 C、小苏打用作面点的膨松剂 D、“冰丝带”场馆用二氧化碳跨临界技术直冷制冰3. “嫦娥五号”采回的月壤中含有的是一种清洁、安全的核聚变发电燃料.下列说法正确的是( )A、核聚变属于化学变化 B、的中子数为3 C、发电代替火电有利于实现碳达峰 D、之间通过共价键形成单质分子4. 拟在实验室完成一系列实验:①粗盐提纯;②利用提纯后的NaCl模拟“侯氏制碱法”制备纯碱;③用盐酸标准液滴定纯碱溶液以测定Na2CO3含量。在实验过程中,下列仪器不可能用到的是A、 B、
B、 C、
C、 D、
D、 5. 酒精、过氧化氢、“84”消毒液和碘酒是生活中常见的杀菌消毒剂.下列说法正确的是( )A、过氧化氢和“84”消毒液混用会减弱消毒效果 B、酒精浓度越高,消毒能力越强 C、碘酒和加碘食盐均能使淀粉溶液变蓝 D、乙醇是常见的有机溶剂,可萃取溴水中的溴6. 下列有关氨气的制取、收集并验证其部分性质的装置和原理不能达到实验目的的是( )
5. 酒精、过氧化氢、“84”消毒液和碘酒是生活中常见的杀菌消毒剂.下列说法正确的是( )A、过氧化氢和“84”消毒液混用会减弱消毒效果 B、酒精浓度越高,消毒能力越强 C、碘酒和加碘食盐均能使淀粉溶液变蓝 D、乙醇是常见的有机溶剂,可萃取溴水中的溴6. 下列有关氨气的制取、收集并验证其部分性质的装置和原理不能达到实验目的的是( )



制取少量氨气
收集氨气
验证氨气溶于水呈碱性
验证氨气极易溶于水
A
B
C
D
A、A B、B C、C D、D7. 下列离子方程式正确的是( )A、用热溶液洗涤试管内壁的硫黄:3S+6OH-=2S2-+SO32-+3H2O B、利用稀硝酸洗去试管壁上的银镜: C、向溶液中滴加足量溶液: D、向溶液中通入少量8. 实验室用如图所示装置研究不同价态硫元素之间的转化,下列说法正确的是( ) A、①中未生成蓝色固体,证明浓硫酸没有被还原 B、②处棉花褪色,证明具有漂白性 C、③中淡黄色粉末变白,证明具有氧化性 D、④中产生淡黄色沉淀,证明被氧化9. 设为阿伏加德罗常数的值,下列说法正确的是( )A、肼中含有的共价键总数为 B、与足量的完全反应转移电子数为 C、标准状况下,的原子数为 D、乙烯和丙烯的混合气体中所含原子数为10. 短周期主族元素的原子半径依次增大,化合物与水剧烈反应,生成一种强碱和一种可燃性气体单质,与同族,原子的电子总数是最外层电子数的3倍.下列说法正确的是( )A、简单离子的半径: B、的最高正化合价为 C、中离子的最外层电子数为2 D、简单气态氢化物的稳定性:11. 多巴胺是一种神经传导物质,会传递兴奋及开心的信息.其部分合成路线如下,下列说法正确的是( )
A、①中未生成蓝色固体,证明浓硫酸没有被还原 B、②处棉花褪色,证明具有漂白性 C、③中淡黄色粉末变白,证明具有氧化性 D、④中产生淡黄色沉淀,证明被氧化9. 设为阿伏加德罗常数的值,下列说法正确的是( )A、肼中含有的共价键总数为 B、与足量的完全反应转移电子数为 C、标准状况下,的原子数为 D、乙烯和丙烯的混合气体中所含原子数为10. 短周期主族元素的原子半径依次增大,化合物与水剧烈反应,生成一种强碱和一种可燃性气体单质,与同族,原子的电子总数是最外层电子数的3倍.下列说法正确的是( )A、简单离子的半径: B、的最高正化合价为 C、中离子的最外层电子数为2 D、简单气态氢化物的稳定性:11. 多巴胺是一种神经传导物质,会传递兴奋及开心的信息.其部分合成路线如下,下列说法正确的是( ) A、甲在苯环上的二溴代物有2种 B、乙的分子式为 C、多巴胺分子中所有碳原子可能处在同一平面上 D、甲、乙、多巴胺均属于芳香烃12. 下列实验操作对应的现象、结论均正确的是( )
A、甲在苯环上的二溴代物有2种 B、乙的分子式为 C、多巴胺分子中所有碳原子可能处在同一平面上 D、甲、乙、多巴胺均属于芳香烃12. 下列实验操作对应的现象、结论均正确的是( )选项
实验操作
现象
结论
A
向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液
有气体生成,产生血红色沉淀
稀硝酸将氧化为
B
将碘水倒入分液漏斗,加适量 , 振荡后静置
溶液分层,上层呈紫色
更易溶于
C
在试管中加入淀粉和溶液,加热,再加入少量新制悬浊液
无明显现象
淀粉未发生水解
D
将溶液滴入溶液中至不再有沉淀产生,再滴加溶液
先有白色沉淀生成,后变为浅蓝色沉淀
A、A B、B C、C D、D13. 利用光伏电池与膜电解法制备溶液的装置如图所示.下列说法正确的是( ) A、该光伏电池可将化学能转化为电能 B、该离子交换膜为阴离子交换膜,由左池向右池迁移 C、电解池中阳极发生还原反应,电极反应式为 D、电路中有电子通过时,阴极室溶液质量变化为14. 某元素的氢氧化物在水中的溶解反应为:、时,与的关系如图所示,为或浓度的值,下列说法错误的是( )
A、该光伏电池可将化学能转化为电能 B、该离子交换膜为阴离子交换膜,由左池向右池迁移 C、电解池中阳极发生还原反应,电极反应式为 D、电路中有电子通过时,阴极室溶液质量变化为14. 某元素的氢氧化物在水中的溶解反应为:、时,与的关系如图所示,为或浓度的值,下列说法错误的是( ) A、曲线②代表与的关系 B、向的溶液中加水稀释,反应的平衡逆向移动,增大 C、时,的约为 . D、时,溶液中的
A、曲线②代表与的关系 B、向的溶液中加水稀释,反应的平衡逆向移动,增大 C、时,的约为 . D、时,溶液中的二、非选择题(包括必考题和选考题两部分,共58分.第15~17题为必考题,每道试题考生都必须作答.第18~19题为选考题,考生根据要求作答)
-
15. 研究小组以(绿色固体)、等物质为原料制备无水(紫色固体,易升华),制备装置如图所示(夹持装置略).

已知:有剧毒,与水反应生成两种酸性气体.
回答下列问题:
(1)、仪器的名称为 .(2)、本实验持续通入的目的是赶走体系中原有的空气、 .(3)、反应管的温度升到时反应生成和(光气),其化学方程式为 . B装置中生成的盐是(填化学式).(4)、反应管右端有在加热炉外,其作用是 .(5)、反应结束后,应(填字母).a.先停止加热,再停止通入 b.先停止通入 , 再停止加热
(6)、测定样品中的含量.称取样品溶于水配制成溶液,取所得溶液于锥形瓶中,加入的溶液,充分反应后,加入指示剂,用的标准溶液滴定至终点时,消耗标准溶液的体积为(已知:、).
该样品中的质量分数为(计算结果精确到).如果滴定管用蒸馏水洗涤后未用标准溶液润洗,则测定结果(填“偏高”、“偏低”或“无影响”).
16. 碳酸锰是制造电信器材的软磁铁氧体和制备其它锰盐的原料,用于医药、电焊条辅助原料等.工业上利用木炭还原焙烧软锰矿煤粉制备碳酸锰的流程如图所示:
已知:①软锰矿煤粉的主要成分是 , 还含有少量和及其氧化物等;
②还原焙烧时被还原成;
③可能用到的数据如下:
氢氧化物
开始沉淀时
1.5
6.5
4.2
8.3
沉淀完全时
3.7
9.7
7.4
9.8
回答下列问题:
(1)、在实验室进行步骤A操作时,需要用到的主要仪器为酒精灯、三脚架、泥三角和其中发生的反应方程式为 .(2)、能提高步骤B中反应速率的措施有(写一条),步骤C中滤渣的主要成分为木炭和(填化学式).(3)、步骤D中加入的作用是 .(4)、步骤中调节值的范围是 , “溶液”宜用(填字母)代替.A. B. C. D.
(5)、步骤不能用溶液代替溶液的原因是 .17. 羰基硫作为一种粮食熏蒸剂,能防止某些害虫和真菌的危害,广泛应用于农药工业.利用工厂废气中的和反应可以合成 , 回答下列问题:(1)、已知:①②
③
反应 .
(2)、在恒容、绝热的密闭容器中,充入与进行反应 . 下列事实不能说明反应达到平衡状态的是____(填字母).A、和的浓度保持不变 B、消耗的速率与生成的速率之比为 C、的值不再改变 D、混合气体的平均相对分子质量不再改变(3)、在充有催化剂的恒容密闭容器中进行反应.设起始充入的 , 相同时间内测得的转化率与和温度的关系如图所示:
①(填“>”“<”或“=”,下同) .
(4)、温度高于时,转化率减小的可能原因为____(填字母).A、反应的变大 B、催化剂活性降低 C、平衡逆向移动 D、反应速率加快(5)、时,在恒容密闭容器中充入等物质的量和发生反应,实验测得反应前容器内压强为后达到平衡时的分压为 . 该反应的平衡常数(用含的代数式表示).(6)、已知时,反应的平衡常数 .①时,在密闭容器中充入等物质的量的和发生上述反应,则平衡时的体积分数为 .
②在两个密闭容器中都加入四种气体,起始时气体体积分数 , 分别在和时反应,容器中和的体积分数随时间的变化关系如图所示:

和时,随时间变化关系的曲线分别是、 , 判断的理由是 .
18. 光电材料在能源、军事等领域有重要应用,分为无机光电材料(如、等)和有机光电材料(如图1所示化合物).回答下列问题:(1)、基态原子的价层电子轨道表示式为;的第一电离能由大到小的顺序为 .(2)、图1所示化合物中含有的化学键类型有(填字母),原子的杂化方式为 .
图1
A.共价键 B.离子键 C.配位键 D.氢键
(3)、在水溶液中,以为电子供体,在光催化剂上可还原为 , 部分氧化物的沸点如表所示:氧化物
沸点
100
①表中氧化物之间沸点差异的原因为 .
②的VSEPR模型为 .
③和分子中,键角更大的是(填化学式).
(4)、和晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2所示)内部的碳原子用代替,晶胞顶角与面心位置的碳原子被或代替.若阿伏加德罗常数的值为晶体的密度为晶体的密度为 , 则晶体与晶体的晶胞参数之比为 .
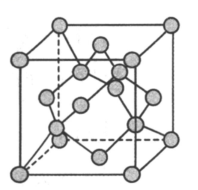
图2
19. 以下为某药物的合成路线:
回答下列问题:
(1)、B的结构简式为 .(2)、D中官能团的名称为 .(3)、的名称为 , 的反应类型为 .(4)、的化学方程式为 . 的反应条件为 .(5)、的另一产物为 .(6)、符合下列条件的的同分异构体有种(不考虑立体异构).①能发生银镜反应;
②与溶液不发生显色反应,但水解产物之一能发生;
③核磁共振氢谱有四组峰,且峰面积之比为 .
其中一种同分异构体的结构简式为 .