甘肃省兰州市名校2023-2024学年高一上学期期末考试化学试题
试卷更新日期:2024-04-11 类型:期末考试
一、选择题(本题共15小题,每小题只有一个选项符合题意,每小题3分,共45分)
-
1. 中国传统文化中蕴含着许多化学知识,下列说法错误的是( )A、“火树银花合,星桥铁锁开”,诗词中所涉及的焰色试验属于化学变化 B、“烟笼寒水月笼沙,夜泊秦淮近酒家”,雾属于气溶胶 C、《淮南万毕术》中记载,“曾青得铁则化为铜”,这种湿法炼铜属于置换反应 D、“古人以剂钢为刃,柔铁为茎干,不尔则多断折”里的“剂钢”的硬度比纯铁的大2. 下列化学用语正确的是( )A、HClO的结构式:H-Cl-O B、分子结构模型:
 C、核外有a个电子,b个中子,M的原子符号为
D、熔融状态下的电离方程式:
3. 日本将福岛核污水排海引起了全世界强烈谴责,核污水中含有放射性氚、碘-131、铯-134、铯-137、碳-14等伤害性物质。下列叙述正确的是( )A、铯-134和铯-137核外电子数之差为3 B、碘-131核素所含中子数与质子数之差为25 C、氕、氘、氚三种核素都含有中子 D、碳-14和碳-12互为同素异形体4. 下列各组物质的转化关系不能均由一步反应实现的是( )A、 B、 C、 D、5. 下列有关元素周期表的说法中正确的是( )A、可在元素周期表中金属与非金属分界线处寻找耐高温、耐腐蚀的合金材料 B、第IIIB族元素种类最多,第IVA族元素形成化合物种类最多 C、第三周期非金属元素含氧酸的酸性从左到右依次增强 D、元素周期表中,VIIIB族包括第8、9、10三个纵列6. 下列离子方程式正确的是( )A、磁性氧化铁溶于稀硫酸: B、金属钠加入硫酸铜溶液中: C、溶液与少量溶液混合: D、将溶液与过量氨水混合:7. 用代表阿伏加德罗常数的数值。下列说法正确的是( )A、与反应转移电子数为 B、常温常压下,和混合气体中含有的原子总数为 C、500mL2mol/LHCl溶液中含有的HCl分子数为 D、中极性共价键数目为8. 下列说法中不正确的有( )
C、核外有a个电子,b个中子,M的原子符号为
D、熔融状态下的电离方程式:
3. 日本将福岛核污水排海引起了全世界强烈谴责,核污水中含有放射性氚、碘-131、铯-134、铯-137、碳-14等伤害性物质。下列叙述正确的是( )A、铯-134和铯-137核外电子数之差为3 B、碘-131核素所含中子数与质子数之差为25 C、氕、氘、氚三种核素都含有中子 D、碳-14和碳-12互为同素异形体4. 下列各组物质的转化关系不能均由一步反应实现的是( )A、 B、 C、 D、5. 下列有关元素周期表的说法中正确的是( )A、可在元素周期表中金属与非金属分界线处寻找耐高温、耐腐蚀的合金材料 B、第IIIB族元素种类最多,第IVA族元素形成化合物种类最多 C、第三周期非金属元素含氧酸的酸性从左到右依次增强 D、元素周期表中,VIIIB族包括第8、9、10三个纵列6. 下列离子方程式正确的是( )A、磁性氧化铁溶于稀硫酸: B、金属钠加入硫酸铜溶液中: C、溶液与少量溶液混合: D、将溶液与过量氨水混合:7. 用代表阿伏加德罗常数的数值。下列说法正确的是( )A、与反应转移电子数为 B、常温常压下,和混合气体中含有的原子总数为 C、500mL2mol/LHCl溶液中含有的HCl分子数为 D、中极性共价键数目为8. 下列说法中不正确的有( )①纳米材料的颗粒直径范围为1~100nm,所以纳米材料能产生丁达尔效应
②碳酸钠能与酸反应,因而可用它作膨松剂
③两种物质的物质的量相同,则它们在标准状况下的体积也相同
④强电解质的导电能力一定比弱电解质强
⑤根据O元素的非金属性强于S元素,可以判断的沸点高于
⑥镁铝合金密度小,强度高,可用于制造飞机和宇宙飞船
⑦金属铝遇到冷的浓硝酸发生钝化现象属于物理变化
A、4个 B、5个 C、6个 D、全部9. 城市污水中含有一定量的、 , 向污水中加入菌体和溶液,在菌体的作用下依次发生过程I、过程II,从而实现、的脱除,过程如图。下列说法正确的是( ) A、“过程I”中为催化剂 B、的氧化性强于 C、“过程I”中和物质的量之比为1:1,则氧化剂与还原剂物质的量之比为1:4 D、“过程II”中发生反应的离子方程式为:10. 用下列装置或操作进行相应实验,能达到实验目的的是( )
A、“过程I”中为催化剂 B、的氧化性强于 C、“过程I”中和物质的量之比为1:1,则氧化剂与还原剂物质的量之比为1:4 D、“过程II”中发生反应的离子方程式为:10. 用下列装置或操作进行相应实验,能达到实验目的的是( )选项
A
B
C
D
目的
等质量固体与足量盐酸反应,乙产生气泡快,反应后甲气球大
比较、的稳定性
探究氧化性:
用铁丝蘸取碳酸钾溶液进行焰色试验
装置或操作



 A、A B、B C、C D、D11. 氯元素的化合价与部分物质类别的对应关系如图所示,据图判断下列说法错误的是( )。
A、A B、B C、C D、D11. 氯元素的化合价与部分物质类别的对应关系如图所示,据图判断下列说法错误的是( )。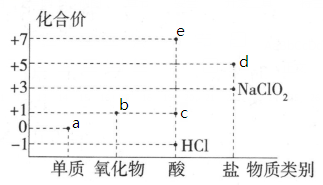 A、c在光照条件下很容易分解 B、b不是酸性氧化物,因为它没有对应的含氧酸 C、图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质 D、将a通入溶液中,已知生成、和d的混合物,若与之比为 , 则氧化剂与还原剂的物质的量之比为12. 将和的固体混合物溶于水得到500mL溶液,所得溶液用100mL1.5mol/L稀硫酸恰好完全中和。下列说法正确的是( )A、混合物与水反应在标准状况生成2.24L气体 B、混合物中有 C、混合物与水反应后所得溶液的物质的量浓度为0.6mol/L D、混合物中有13. 将两个盛有足量等质量、等质量分数的稀硫酸的烧杯放在天平两端,调平,同时向两烧杯中分别加入等质量、形状相似的铝和镁,如图所示。则从开始反应到不再产生气体为止,指针偏转的情况是 ( )
A、c在光照条件下很容易分解 B、b不是酸性氧化物,因为它没有对应的含氧酸 C、图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质 D、将a通入溶液中,已知生成、和d的混合物,若与之比为 , 则氧化剂与还原剂的物质的量之比为12. 将和的固体混合物溶于水得到500mL溶液,所得溶液用100mL1.5mol/L稀硫酸恰好完全中和。下列说法正确的是( )A、混合物与水反应在标准状况生成2.24L气体 B、混合物中有 C、混合物与水反应后所得溶液的物质的量浓度为0.6mol/L D、混合物中有13. 将两个盛有足量等质量、等质量分数的稀硫酸的烧杯放在天平两端,调平,同时向两烧杯中分别加入等质量、形状相似的铝和镁,如图所示。则从开始反应到不再产生气体为止,指针偏转的情况是 ( ) A、先偏左后偏右 B、先偏右后偏左 C、一直偏右 D、一直偏左14. 某无色溶液中可能含有物质的量浓度均相同的以下离子中的若干种:、 , 为了确定该溶液的组成,进行如下实验:
A、先偏左后偏右 B、先偏右后偏左 C、一直偏右 D、一直偏左14. 某无色溶液中可能含有物质的量浓度均相同的以下离子中的若干种:、 , 为了确定该溶液的组成,进行如下实验:①取上述溶液,加入过量溶液,反应后将沉淀过滤。洗涤、干燥,得白色沉淀。
②向沉淀中加入过量的盐酸,白色沉淀部分溶解并有气体生成,反应后过滤、洗涤、干燥,得白色沉淀。
下列说法错误的是( )
A、②中产生的气体一定是 B、溶液中一定不存在和 C、 D、该溶液的组成15. 已知R、S、T、W为原子序数依次增大的前四周期元素,R、S为同周期相邻元素,R原子的核外电子数等于T原子的最外层电子数,R、T原子的核外电子数之和为S原子的核外电子数的3倍。W的单质为红色固体。下列说法正确的是( )A、氢化物的稳定性:S>T>R B、R的氧化物对应的水化物为强酸 C、原子半径:W>T>S>R D、W与T形成原子数目比为1:2的化合物水溶液可以导电二、非选择题(共55分)
-
16. 按要求完成下列填空。(1)、I.下列物质:①②③NaOH④⑤⑥⑦⑧
含有共价键的离子化合物是(填序号,下同)。(2)、属于共价化合物是。(3)、只含有非极性键的物质是。(4)、写出①的结构式 , 写出⑥的电子式。(5)、II.下列变化:①蔗糖溶于水②升华③烧碱熔化④NaCl溶解⑤溶解⑥硫酸氢钾溶于水只有离子键被破坏的是。
(6)、只有共价键被破坏的是。(7)、只破坏分子间作用力的是。17. 根据①~⑩号元素所在周期表中的位置,回答下列问题: (1)、⑨形成的简单离子结构示意图为。(2)、用电子式表示⑤和⑩形成原子数目比为1:2的化合物的形成过程。(3)、②③④三种元素分别形成简单离子的离子半径由大到小的顺序是(填离子符号)。(4)、①和⑧构成的化合物能和水剧烈反应产生氢气,该反应的化学方程式为。(5)、⑥的单质与④的最高价氧化物对应水化物反应的离子方程式为。(6)、②和⑦相比非金属性较强的是(填元素符号),下列能证明这一事实的有(填序号)。
(1)、⑨形成的简单离子结构示意图为。(2)、用电子式表示⑤和⑩形成原子数目比为1:2的化合物的形成过程。(3)、②③④三种元素分别形成简单离子的离子半径由大到小的顺序是(填离子符号)。(4)、①和⑧构成的化合物能和水剧烈反应产生氢气,该反应的化学方程式为。(5)、⑥的单质与④的最高价氧化物对应水化物反应的离子方程式为。(6)、②和⑦相比非金属性较强的是(填元素符号),下列能证明这一事实的有(填序号)。A.⑦的简单氢化物稳定性强于②的简单氢化物
B.⑦的简单氢化物酸性强于②的简单氢化物
C.⑦单质与氢气反应比②单质与氢气反应更加剧烈
D.⑦单质的熔点比②单质的低
(7)、运用元素周期律推测陌生元素的性质,下列推断错误的是____(填序号)A、铊(Tl)单质既能与盐酸作用产生氢气,又能与NaOH溶液反应放出氢气 B、砹(At)单质为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸 C、锂(Li)单质在氧气中剧烈燃烧,产物是 D、硫酸锶()是难溶于水的白色固体18. 利用如图所示装置进行铁跟水蒸气反应的实验,并对反应产物进行探究。 (1)、I.试管中发生反应的化学方程式为。(2)、实验中使用肥皂液的作用是。(3)、Ⅱ.欲确定反应一段时间后试管中黑色物质X的成分,部分同学设计了如下方案:
(1)、I.试管中发生反应的化学方程式为。(2)、实验中使用肥皂液的作用是。(3)、Ⅱ.欲确定反应一段时间后试管中黑色物质X的成分,部分同学设计了如下方案:甲同学将少量X与足量硫酸铜溶液反应,固体部分溶解,有红色物质析出,过滤,除去滤渣中红色物质,向剩余滤渣中加入盐酸,滴加几滴KSCN溶液,溶液出现红色。通过分析现象,甲同学得出X的组成是Fe和。
若在X中直接加入盐酸和KSCN溶液,溶液不出现红色,原因是。
(4)、乙同学的实验方案如下:
①加入时,发生反应的离子方程式为。
②灼烧沉淀时必须用到下列实验仪器的是(填名称)。

③通过以上数据,可得出2.88g黑色物质X中的物质的量为。
(5)、丙同学将试管内固体看做铁的氧化物(),取出6.08g溶于足量盐酸中,向所得溶液中通入(标准状况),恰好将Fe元素完全氧化为 , 则x=。19. 下图是实验室制备氯气并进行一系列相关实验的装置。 (1)、和浓HCl制备氯气的化学反应方程式为:。(2)、装置B中饱和食盐水的作用是;装置B也可以监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象。(3)、装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入:。
(1)、和浓HCl制备氯气的化学反应方程式为:。(2)、装置B中饱和食盐水的作用是;装置B也可以监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象。(3)、装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入:。a
b
c
d
I
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
Ⅱ
碱石灰
硅胶
浓硫酸
无水氯化钙
Ⅲ
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(4)、打开活塞将装置D中少量溶液加入装置E中,振荡。观察到的现象是 , 该现象(填“能”或“不能”)说明溴的氧化性强于碘,原因是。