甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中化学试题
试卷更新日期:2024-04-11 类型:期中考试
一、每小题只有一个选项符合题意
-
1. 下列过程中,化学反应速率的增大对人类有益的是( )A、金属的腐蚀 B、食物的腐败 C、塑料的老化 D、氨的合成2. 下列各组变化中,反应物总能量小于生成物总能量的是( )A、生石灰溶于水 B、锌粒和稀硫酸反应 C、二氧化碳与碳反应 D、化石燃料燃烧3. 25℃、1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+109.8kJ·mol-1 , 该反应能自发进行的原因是( )A、该反应是吸热反应 B、该反应是放热反应 C、该反应是熵减小的反应 D、该反应的熵增大效应大于能量效应4. 下列说法正确的是( )A、催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率 B、化学反应速率为0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L C、根据化学反应速率的大小可以判断化学反应进行的快慢 D、对于化学反应来说,反应速率越大,反应现象越明显5. 对于密闭容器中进行的反应N2(g)+3H2(g) 2NH3(g),达到平衡时,若温度保持不变,增加N2的浓度,则( )A、正、逆反应速率同时增大 B、逆反应速率先减小 C、化学平衡逆向移动 D、化学平衡正向移动6. 在一定条件下的溶液中,反应:FeCl3+3KSCNFe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡逆向移动的是( )A、加入少量KSCN固体 B、加入少量FeCl3固体 C、加入少量KCl固体 D、加入少量氢氧化钠固体7. 在测定中和反应反应热的实验中,下列说法正确的是(已知弱酸电离时吸热) ( )A、使用玻璃搅拌器是为了加快反应速率,减小实验误差 B、为了准确测定反应混合溶液的温度,实验中温度计水银球应与内筒底部接触 C、用溶液分别与的盐酸、醋酸溶液反应,若所取的溶液体积相等,则测得的中和反应反应热的绝对值相同 D、在测定中和反应反应热的实验中,将溶液缓缓倒入装有盐酸的内筒中8. 已知:晶体硅中含有键。工业上高纯硅可通过下列反应制取: , 根据表中所列化学键的键能数据,可判断出该反应的反应热为( )
化学键
键能/
360
436
431
176
A、 B、 C、 D、9. 已知下列热化学方程式:2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2 kJ·mol-1;
Hg(l)+O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3中ΔH3的值是( )
A、-260.4 kJ·mol-1 B、-254.6 kJ·mol-1 C、-438.9 kJ·mol-1 D、-441.8 kJ·mol-110. 已知下列反应的平衡常数:①②则反应③的平衡常数是( )A、 B、 C、 D、11. 下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )A、溴水中有下列平衡Br2+H2OHBr+HBrO,当加入AgNO3溶液后溶液颜色变浅 B、对2HI(g)H2(g)+I2(g)的平衡,保持其他条件不变,压缩体积可使平衡体系颜色变深 C、合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施 D、用饱和食盐水除去氯气中的氯化氢12. 下列反应中符合下图图象的是( ) A、N2(g)+3H2(g)2NH3(g);△H=-Q1kJ·mol-1(Q1>0) B、2SO3(g)2SO2(g)+O2(g);△H=+Q2kJ·mol-1(Q2>0) C、4NH3(g)+5O2(g)4NO(g)+6H2O(g);△H=-Q3kJ·mol-1(Q3>0) D、H2(g)+CO(g)C(s)+H2O(g);△H=+Q4kJ·mol-1(Q4>0)
A、N2(g)+3H2(g)2NH3(g);△H=-Q1kJ·mol-1(Q1>0) B、2SO3(g)2SO2(g)+O2(g);△H=+Q2kJ·mol-1(Q2>0) C、4NH3(g)+5O2(g)4NO(g)+6H2O(g);△H=-Q3kJ·mol-1(Q3>0) D、H2(g)+CO(g)C(s)+H2O(g);△H=+Q4kJ·mol-1(Q4>0)二、非选择题(每空2分,共52分)
-
13. 汽车尾气中主要污染物是NOx和CO,它们是现代化城市中的重要大气污染物。(1)、汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是 , 图1中对应反应的热化学方程式为。
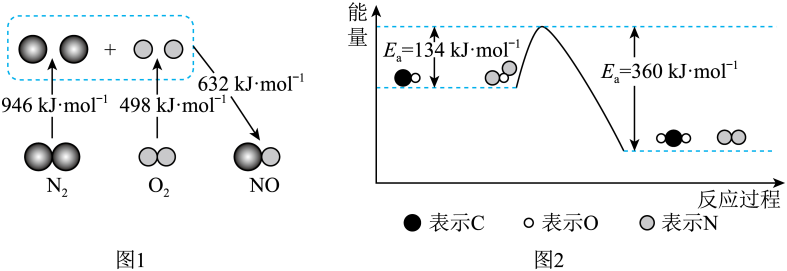 (2)、N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下:CO(g)+N2O(g)N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。
(2)、N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下:CO(g)+N2O(g)N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。①图2中反应是(填“放热”或“吸热”)反应,该反应的活化能为 , 该反应的△H=。
②加入Pt2O+作为该反应的催化剂,则Ea(填“增大”“减小”或“不变”,下同),△H。
(3)、利用NH3还原法可将NOx , 还原为N2进行脱除。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-2070 kJ∙mol-1 , 若有0.5molNO被还原,放出的热量为。14. 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: (1)、从反应开始到10s时,用Z表示的反应速率为 , X的物质的量浓度减少了 , Y的转化率为。(2)、该反应的化学方程式为。(3)、10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是____。
(1)、从反应开始到10s时,用Z表示的反应速率为 , X的物质的量浓度减少了 , Y的转化率为。(2)、该反应的化学方程式为。(3)、10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是____。 A、t1时刻,增大了X的浓度 B、t1时刻,升高了体系温度 C、t1时刻,缩小了容器体积 D、t1时刻,使用了催化剂15. 在化学反应A(g)+B(g)2C(g)+D(g) ΔH=Q kJ·mol-1过程中的能量变化如图所示,回答下列问题。
A、t1时刻,增大了X的浓度 B、t1时刻,升高了体系温度 C、t1时刻,缩小了容器体积 D、t1时刻,使用了催化剂15. 在化学反应A(g)+B(g)2C(g)+D(g) ΔH=Q kJ·mol-1过程中的能量变化如图所示,回答下列问题。 (1)、Q0 (填“>”“<”或“=”)。(2)、熵变ΔS0(填“>”“<”或“=”)。(3)、该反应自发进行(填“能”或“不能”)。(4)、升高温度,平衡常数K(填“增大”“减小”或“不变”),平衡向方向移动,平衡向该方向移动的理由是。16. 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)、Q0 (填“>”“<”或“=”)。(2)、熵变ΔS0(填“>”“<”或“=”)。(3)、该反应自发进行(填“能”或“不能”)。(4)、升高温度,平衡常数K(填“增大”“减小”或“不变”),平衡向方向移动,平衡向该方向移动的理由是。16. 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。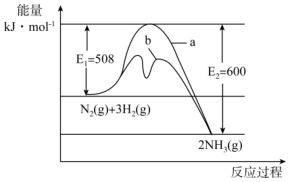 (1)、 根据图提供的信息,写出该反应的热化学方程式 , 在图中曲线(填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是。(2)、在恒容容器中,下列描述中能说明上述反应已达平衡的是____。A、 B、单位时间内生成的同时生成 C、混合气体的密度不再改变 D、容器内压强不随时间的变化而变化(3)、一定温度下,向2L密闭容器中充入和 , 保持体积不变,0.5min后达到平衡,测得容器中有 , 则平均反应速率 , 该温度下的平衡常数。(小数点后保留3位有效数字)(4)、保持温度和体积不变,向上述平衡体系中再加入、、后该反应的速率大小关系为(填“大于”、“小于”或“等于”)。
(1)、 根据图提供的信息,写出该反应的热化学方程式 , 在图中曲线(填“a”或“b”)表示加入铁触媒的能量变化曲线,判断理由是。(2)、在恒容容器中,下列描述中能说明上述反应已达平衡的是____。A、 B、单位时间内生成的同时生成 C、混合气体的密度不再改变 D、容器内压强不随时间的变化而变化(3)、一定温度下,向2L密闭容器中充入和 , 保持体积不变,0.5min后达到平衡,测得容器中有 , 则平均反应速率 , 该温度下的平衡常数。(小数点后保留3位有效数字)(4)、保持温度和体积不变,向上述平衡体系中再加入、、后该反应的速率大小关系为(填“大于”、“小于”或“等于”)。