2023年湖北省中考化学真题分类汇编 十、金属与金属矿物
试卷更新日期:2024-04-11 类型:二轮复习
一、选择题
-
1. “垃圾分类我先行”,我们要养成垃圾分类的好习惯。矿泉水瓶、易拉罐属于( )A、可回收物 B、有害垃圾 C、厨余垃圾 D、其它垃圾2. 下列探究实验能达到探究目的的是( )A、
 探究“同种溶质在不同溶剂里的溶解性”
B、
探究“同种溶质在不同溶剂里的溶解性”
B、 探究“分子在不断运动”
C、
探究“分子在不断运动”
C、 探究“CO2与NaOH是否发生化学反应”
D、
探究“CO2与NaOH是否发生化学反应”
D、 探究“铁锈蚀的条件”
3. 化学兴趣小组的同学把质量为m克的铝粉加入到一定质量的氯化锌和氯化铜的混合溶液中,充分反应后过滤,得到滤液和滤渣,向滤渣中滴加稀盐酸,有气泡产生。下列判断中正确的是( )A、滤渣中可能含有Al,滤液中一定含有AlCl3 B、滤渣中一定含有Zn,滤液可能为蓝色 C、若滤渣中只含Cu、Zn,则滤液中一定只含有AlCl3 D、根据质量守恒定律,所得滤渣的质量一定等于m克
探究“铁锈蚀的条件”
3. 化学兴趣小组的同学把质量为m克的铝粉加入到一定质量的氯化锌和氯化铜的混合溶液中,充分反应后过滤,得到滤液和滤渣,向滤渣中滴加稀盐酸,有气泡产生。下列判断中正确的是( )A、滤渣中可能含有Al,滤液中一定含有AlCl3 B、滤渣中一定含有Zn,滤液可能为蓝色 C、若滤渣中只含Cu、Zn,则滤液中一定只含有AlCl3 D、根据质量守恒定律,所得滤渣的质量一定等于m克二、综合题
-
4. 人类的生存、发展离不开化学。请回答下列问题:(1)、江汉平原素有“鱼米之乡”的美誉。鱼肉富含的营养素有 , 该营养素是机体生长及修复受损组织的主要原料;大米中的淀粉在消化道最终被消化成葡萄糖(C6H12O6),葡萄糖在酶的催化作用下缓慢氧化生成二氧化碳和水,请写出葡萄糖缓慢氧化的化学方程式:。(2)、水是生命之源,家庭常用净水器中的超滤净水器的滤芯以超滤膜为主,以活性炭为辅来实现对自来水的净化,可以有效过滤水中的泥沙、铁锈、细菌和异味,该净水过程主要发生了(填“物理”或“化学”)变化。在日常生活中常采用的方法降低水的硬度。(3)、中国空间站已经全面建成。空间站中的氧气主要来自水的电解,并使用高压密闭罐储存,氧气可以压缩储存的原因是:(从微观角度解释)。空间站的备用氧气,通常利用分解高氯酸锂(LiClO4)来制取,在高氯酸锂(LiClO4)中锂元素的化合价为+1价,则氯元素的化合价为价。载人飞船返回舱外层的主要材料是酚醛塑料,该材料受热不会熔化,具有热固性。酚醛塑料属于(填“金属材料”或“合成材料”)。(4)、我国的钢铁年产量很高,但因锈蚀造成的损失也很惊人,铁制品锈蚀的过程实际上是铁与空气中的氧气和水等物质发生化学反应的过程。请写出一条防止铁制品生锈的具体方法:。5. 金属在生活、生产中有着广泛的应用,金属材料已成为社会发展的重要物质基础。(1)、我国“天问一号”火星探测器成功降落火星,实现了中国航天史无前例的突破。在探测器运行系统中使用了铜丝作电线,是因为铜具有良好的 性和延展性。(2)、第届冬奥会纪念币的材质为黄铜合金,强度高,耐腐蚀。若将少量黄铜合金投入到足量稀盐酸中, 填“有”或“没有”固体剩余。(3)、“嫦娥五号”使用的记忆合金再次让全世界关注新合金材料。是一种能够储存氢能源的合金,它吸氢后生成合金和 , 而和稀盐酸反应能产生氢气。和反应的化学方程式是 。6. 探秘古钱币。(1)、古币金属知多少。我国古代的钱币有多种,如金币、银币、铜币、铁币等。小民同学家里收藏有一枚古币,可以被磁铁吸引,该古币是(填币种)。(2)、金属性质共探究。小郑同学做了下列实验:
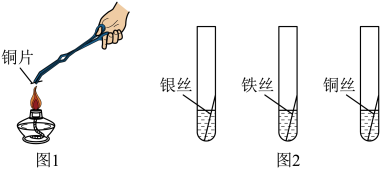
①如图1,铜片表面有黑色物质生成,该反应的化学方程式是。
②如图2,三支试管里的液体均为稀盐酸,铁丝表面有气泡冒出,银丝和铜丝无明显变化。由此可得出有关金属活动性的结论是。
③《天工开物》记载“铁质贱甚”,写出一个由铁得到铜的化学方程式。
(3)、货币流通有原因。铁硬度比铜大,密度比铜小,金和银做成的钱币比铜币腐蚀速度要慢得多,似乎更适合铸造钱币,但是中国历史上铜币的使用量远大于其它材质的货币。综上所述,古代铸造钱币选择金属考虑的两个因素是:①;②。7. 兴趣小组的同学利用某废镍材料(含有金属Ni及少量Fe、Cu)回收镍,设计流程如下图所示(部分产物略去)。
请根据上述流程回答下列问题:
(1)、过滤时,玻璃棒的作用是;(2)、写出“酸浸”时发生反应的化学方程式(任写一个)。(3)、过氧化氢具有氧化性,“氧化”时发生反应的化学方程式为 ,则X的化学式是。(4)、Ni、Fe、Cu的金属活动性由强到弱的顺序为。(5)、已知Fe3+和Ni2+开始沉淀和完全沉淀时的pH如表。“除铁”过程中加入NaOH溶液的目的是通过调节溶液的pH使Fe3+完全沉淀而Ni2+不沉淀,则pH的范围是____(填字母序号)。开始沉淀时的pH
完全沉淀时的pH
Fe3+
2.7
3.2
Ni2+
7.2
8.7
A、2.7≤pH<3.2 B、3.2≤pH<7.2 C、7.2≤pH<8.78. 硫酸锌可制备各种含锌材料,在防腐、医学上有很多应用。菱锌矿的主要成分是ZnCO3 , 还含有少量的二氧化硅和氧化铁。以菱锌和为原料制备ZnSO4·7H2O的工艺流程如下图所示。(二氧化硅难溶于水,也不与稀硫酸反应)
回答下列问题:
(1)、菱锌矿属于(填“纯净物”或“混合物”)。(2)、“酸浸”中观察到的现象是。(3)、滤液1中含有的阳离子是。(填离子符号)(4)、“转化”中加入足量锌粉,反应的化学方程式有:和(写一个即可)。(5)、下列说法正确的是____(填标号)。A、“粉碎”是为了使菱锌矿在“酸浸”中与稀硫酸充分反应 B、在“转化”中加入锌粉,若无气泡冒出,说明锌粉已足量 C、滤渣甲、滤渣乙均能与稀硫酸反应产生气体 D、滤液2的质量一定比滤液1的质量大