江苏省镇江市2023年中考化学试卷
试卷更新日期:2024-04-08 类型:中考真卷
一、单项选择题:共20小题,每小题2分,共40分。每小题只有一个选项最符合题意。
-
1. 下列属于纯净物的是( )A、液氧 B、空气 C、海水 D、生铁2. 下列现象主要是由化学变化引起的是( )A、海水晒盐 B、酒精挥发 C、甲烷燃烧 D、冰雪消融3. 下列物质的用途主要与其化学性质有关的是( )A、用贝壳生产生石灰 B、用干冰进行人工降雨 C、用钢制作电线电缆 D、用伍德合金制作保险丝4. 自然界中的物质大多数是化合物,下列化合物属于氧化物的是( )A、KOH B、C2H6O C、Na2CO3 D、P2O55. 下列归类正确的是( )
选项
归类
内容
A
清洁能源
煤炭、石油、太阳能
B
糖类物质
蔗糖、淀粉、纤维素
C
酸性物质
胃液、食醋、肥皂水
D
合成材料
塑料、涤纶、玻璃钢
A、A B、B C、C D、D6. 测定粗盐纯度,需经过下列操作,其中操作不规范的是( )A、 称量
B、
称量
B、 溶解
C、
溶解
C、 过滤
D、
过滤
D、 蒸发结晶
7. 下列实验方法正确的是( )A、用加碘食盐区分淀粉和葡萄糖 B、用灼烧的方法区分蚕丝和羊毛 C、加热除去NaCl固体中混有的NH4HCO3 D、用盐酸除去NaNO3溶液中混有的Na2CO38. 下列排序正确的是( )A、地壳中的元素含量由高到低:O、Fe、Si B、溶液的pH由大到小:柠檬汁、食盐水、石灰水 C、利用金属的年代由先到后:Fe、Cu、Al D、硫元素的质量分数由大到小:Na2S、Na2SO3、Na2SO49. 下列指定反应的化学方程式正确的是( )A、实验室用KClO3制备:2KClO3=2KCl+3O2↑ B、乙炔(C2H2)燃烧形成氧炔焰:2C2H2+5O2=4CO2+2H2O C、用石灰石浆吸收烟气中的二氧化硫:CaCO3+SO2+O2═CaSO4+CO2 D、用氨水中和废水中的硫酸得到氮肥:2NH3•H2O+H2SO4═(NH4)2SO4+2H2O10. 金属R与Hg(NO3)2溶液反应的化学方程式为R+Hg(NO3)2═R(NO3)2+Hg,下列说法中不正确的是( )A、R可能是铝 B、该反应为置换反应 C、R的金属活动性比Hg强 D、在金属活动性顺序表中,R不一定排在氢前面11. 如图表示甲转化为丙的微观过程。下列有关说法不正确的是( )
蒸发结晶
7. 下列实验方法正确的是( )A、用加碘食盐区分淀粉和葡萄糖 B、用灼烧的方法区分蚕丝和羊毛 C、加热除去NaCl固体中混有的NH4HCO3 D、用盐酸除去NaNO3溶液中混有的Na2CO38. 下列排序正确的是( )A、地壳中的元素含量由高到低:O、Fe、Si B、溶液的pH由大到小:柠檬汁、食盐水、石灰水 C、利用金属的年代由先到后:Fe、Cu、Al D、硫元素的质量分数由大到小:Na2S、Na2SO3、Na2SO49. 下列指定反应的化学方程式正确的是( )A、实验室用KClO3制备:2KClO3=2KCl+3O2↑ B、乙炔(C2H2)燃烧形成氧炔焰:2C2H2+5O2=4CO2+2H2O C、用石灰石浆吸收烟气中的二氧化硫:CaCO3+SO2+O2═CaSO4+CO2 D、用氨水中和废水中的硫酸得到氮肥:2NH3•H2O+H2SO4═(NH4)2SO4+2H2O10. 金属R与Hg(NO3)2溶液反应的化学方程式为R+Hg(NO3)2═R(NO3)2+Hg,下列说法中不正确的是( )A、R可能是铝 B、该反应为置换反应 C、R的金属活动性比Hg强 D、在金属活动性顺序表中,R不一定排在氢前面11. 如图表示甲转化为丙的微观过程。下列有关说法不正确的是( ) A、转化②为化合反应 B、转化①中甲与O2的分子个数比为3:2 C、丙的稀溶液可用于除铁锈 D、整个转化过程中硫元素的化合价升高12. 用如图装置研究FeC2O4•2H2O受热分解的产物。下列说法不正确的是( )
A、转化②为化合反应 B、转化①中甲与O2的分子个数比为3:2 C、丙的稀溶液可用于除铁锈 D、整个转化过程中硫元素的化合价升高12. 用如图装置研究FeC2O4•2H2O受热分解的产物。下列说法不正确的是( )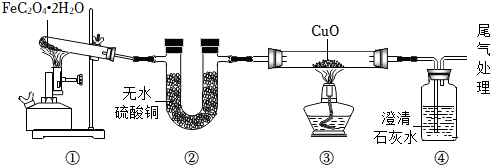 A、装置②用于检验分解产物中是否有H2O B、装置③中黑色粉末变红,试明分解产物中有CO C、装置④中澄清石灰水变浑浊,说明分解产物中有CO2 D、实验结束后,经检验装置①中剩余固体为FeO和少量Fe,含有Fe的原因可能是分解过程中发生了CO还原FeO的反应13. 下列物质的转化在给定条件下均能实现的是( )
A、装置②用于检验分解产物中是否有H2O B、装置③中黑色粉末变红,试明分解产物中有CO C、装置④中澄清石灰水变浑浊,说明分解产物中有CO2 D、实验结束后,经检验装置①中剩余固体为FeO和少量Fe,含有Fe的原因可能是分解过程中发生了CO还原FeO的反应13. 下列物质的转化在给定条件下均能实现的是( )
A、Fe FeCl3Fe(OH)3 B、CuOCuSO4溶液 Cu(OH)2 C、NaCl溶液 NaHCO3NaOH D、BaCl2溶液 BaCO3Ba(NO3)2溶液14. 下列实验操作能达到实验目的的是( )选项
物质
目的
主要实验操作
A
H2、CH4
鉴别
点燃,在火焰上方罩一个干冷的烧杯,观察现象
B
NaOH溶液中混有Na2CO3
除杂
加入适量的CaCl2溶液,振荡、静置、过滤
C
Na2CO3溶液中是否含有Na2SO4
检验
取样,滴加BaCl2溶液,观察现象
D
KNO3和Ba(NO3)2的混合溶液
分离
先加入过量的K2CO3溶液,搅拌、静置、过滤、洗涤,再分别向滤液、滤渣中加入适量的稀硝酸,搅拌
A、A B、B C、C D、D15. 如图为CO2在自然界中的转化和资源化利用。下列说法不正确的是( )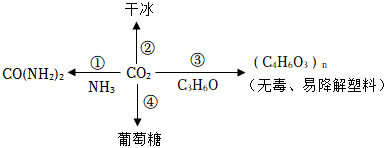 A、转化①中反应物全部转化为尿素 B、转化②中CO2分子间的间隔变小 C、转化③有利于减少“白色污染” D、自然界中转化④是无机化合物向有机化合物的转化16. 将一定量的澄清石灰水与Na2CO3溶液充分混合,过滤得到白色固体和无色滤液,将滤液分为三等份,分别进行下列实验。
A、转化①中反应物全部转化为尿素 B、转化②中CO2分子间的间隔变小 C、转化③有利于减少“白色污染” D、自然界中转化④是无机化合物向有机化合物的转化16. 将一定量的澄清石灰水与Na2CO3溶液充分混合,过滤得到白色固体和无色滤液,将滤液分为三等份,分别进行下列实验。实验①:向第一份溶液中滴加酚酞溶液。
实验②:向第二份溶液中滴加少量稀盐酸。
实验③:向第三份溶液中滴加BaCl2溶液,振荡、静置。
下列说法不正确的是( )
A、产生白色固体的反应为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH B、实验①中溶液变红,不能说明滤液中是否含有Na2CO3 C、实验②中无气泡产生,说明滤液中不含有Na2CO3 D、实验③中出现白色浑浊,说明滤液中不含有Ca(OH)217. 如图为MgCl2、KCl和MgSO4的溶解度曲线。下列说法正确的是( ) A、T2℃时,溶解度:S(MgCl2)>S(KCl)>S(MgSO4) B、T2℃时,将MgSO4、MgCl2固体各30.0g分别溶于50.0g水,则形成MgSO4饱和溶液和MgCl2不饱和溶液,前者溶液的溶质质量分数大于后者 C、T3℃时,将KCl、MgSO4的饱和溶液分别降温到T2℃,两种溶液中均有晶体析出 D、T1℃时,将等质量的KCl、MgSO4饱和溶液分别升温到T3℃,要使两种溶液均达到饱和,加入的对应溶质质量相等18. 下列各组溶液,不用其他试剂就不能鉴别出来的是( )A、CuCl2、NaOH、MgCl2、HCl B、BaCl2、HCl、K2CO3、HNO3 C、Ba(OH)2、Na2CO3、K2SO4、HNO3 D、MgSO4、NaOH、Ba(NO3)2、HCl19. 常温下,向100.0gMgCl2、MgSO4的混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与滴加Ba(OH)2溶液的体积关系如图所示,下列说法不正确的是( )
A、T2℃时,溶解度:S(MgCl2)>S(KCl)>S(MgSO4) B、T2℃时,将MgSO4、MgCl2固体各30.0g分别溶于50.0g水,则形成MgSO4饱和溶液和MgCl2不饱和溶液,前者溶液的溶质质量分数大于后者 C、T3℃时,将KCl、MgSO4的饱和溶液分别降温到T2℃,两种溶液中均有晶体析出 D、T1℃时,将等质量的KCl、MgSO4饱和溶液分别升温到T3℃,要使两种溶液均达到饱和,加入的对应溶质质量相等18. 下列各组溶液,不用其他试剂就不能鉴别出来的是( )A、CuCl2、NaOH、MgCl2、HCl B、BaCl2、HCl、K2CO3、HNO3 C、Ba(OH)2、Na2CO3、K2SO4、HNO3 D、MgSO4、NaOH、Ba(NO3)2、HCl19. 常温下,向100.0gMgCl2、MgSO4的混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与滴加Ba(OH)2溶液的体积关系如图所示,下列说法不正确的是( ) A、a点对应溶液中有两种溶质 B、b点对应溶液的pH>7 C、m1:m2=291:407 D、原混合溶液中MgSO4的质量分数大于MgCl2的质量分数20. 已知,4KO2+2CO2═2K2CO3+3O2 , 4KO2+2H2SO4═2K2SO4+2H2O+3O2↑,现有28.4gKO2与一定量的CO2反应后,固体质量变为27.8g,向反应后的固体中加入过量的200.0g稀硫酸,将产生的气体通入过量的石灰水中,得到15.0gCaCO3。下列说法不正确的是( )A、KO2应密封保存 B、与CO2反应生成O2的质量为7.2g C、与CO2反后的固体中KO2和K2CO3的质量比为71:207 D、与稀硫酸反应后所得溶液中K2SO4的质量分数约为15.3%
A、a点对应溶液中有两种溶质 B、b点对应溶液的pH>7 C、m1:m2=291:407 D、原混合溶液中MgSO4的质量分数大于MgCl2的质量分数20. 已知,4KO2+2CO2═2K2CO3+3O2 , 4KO2+2H2SO4═2K2SO4+2H2O+3O2↑,现有28.4gKO2与一定量的CO2反应后,固体质量变为27.8g,向反应后的固体中加入过量的200.0g稀硫酸,将产生的气体通入过量的石灰水中,得到15.0gCaCO3。下列说法不正确的是( )A、KO2应密封保存 B、与CO2反应生成O2的质量为7.2g C、与CO2反后的固体中KO2和K2CO3的质量比为71:207 D、与稀硫酸反应后所得溶液中K2SO4的质量分数约为15.3%二、非选择题共60分
-
21. 用化学符号表示。(1)、金刚石:。(2)、空气中含量最多的气体:。(3)、2个氯离子:。(4)、幼儿缺少元素易得佝偻病。22. 选择下列适当的物质填空(填序号)。
A.氧气 B.熟石灰 C.聚乙烯 D.硝酸铵 E.食盐 F.硫酸铜 G.维生素 H.苛性钠
(1)、可改良酸性土壤的是。(2)、用于游泳池消毒的是。(3)、可用于医疗急救的是。(4)、厨房中作调味品的是。(5)、溶于水温度降低的是。(6)、蔬菜、水果中富含。23. 如图为化学能转化为电能的实验装置。(1)、实验后铜片质量(选填“增大”或“减小”)。(2)、用化学方程式解释其变化的原因:。 24. 氢气是理想的“绿色能源”,近年来我国制氢量位居世界第一。(1)、水光解制氢。水在半导体光催化剂作用下制备氢气的原理如图1所示。光解水时,光能转化为能。
24. 氢气是理想的“绿色能源”,近年来我国制氢量位居世界第一。(1)、水光解制氢。水在半导体光催化剂作用下制备氢气的原理如图1所示。光解水时,光能转化为能。 (2)、甲烷水化制氢。以甲烷为原料制备氢气的一种流程如图2。
(2)、甲烷水化制氢。以甲烷为原料制备氢气的一种流程如图2。①16.0g甲烷理论上可制备氢气的质量为g。
②“分离“时发生反应的化学方程式为。
(3)、贮氢与释氢。已知:HCOOK+H2O=KHCO3+H2↑;HCOOH=CO2↑+H2↑。通过如图3流程可实现氢气的贮存和释放。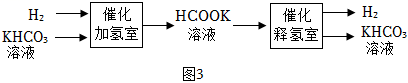
①催化加氢室发生反应的化学方程式为。
②采用HCOOK溶液释氢优于HCOOH释氢,原因有产生H2的速率快和。
③在氢气的贮存和释放中可循环使用的物质是。
25. 实验室利用废镍催化剂(主要成分为Ni,还含少量Fe及铁的氧化物)制备NiCO3的实验流程如图。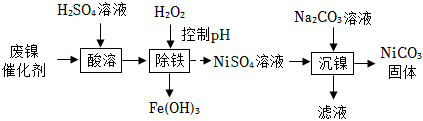 (1)、为加快“酸溶”的反应速率,可采取的措施有(写一种)。(2)、“除铁”和“沉镍”中分离的操作名称为。(3)、检验NiCO3固体已洗净的方法是:取最后一次洗涤后的滤液,先滴加过量的稀盐酸,再滴加(填化学式)溶液,无明显现象。(4)、碱性条件下NiSO4会转化为Ni(OH)2沉淀。“沉镍”时不能将NiSO4溶液滴入Na2CO3溶液中,其原因是。26. 如图所示,向新制NaCuO2中滴加适量H2O,产生蓝色沉淀且出现气泡,导管口带火星的木条复燃,反应结束后,滴入紫色石蕊溶液,溶液变蓝。
(1)、为加快“酸溶”的反应速率,可采取的措施有(写一种)。(2)、“除铁”和“沉镍”中分离的操作名称为。(3)、检验NiCO3固体已洗净的方法是:取最后一次洗涤后的滤液,先滴加过量的稀盐酸,再滴加(填化学式)溶液,无明显现象。(4)、碱性条件下NiSO4会转化为Ni(OH)2沉淀。“沉镍”时不能将NiSO4溶液滴入Na2CO3溶液中,其原因是。26. 如图所示,向新制NaCuO2中滴加适量H2O,产生蓝色沉淀且出现气泡,导管口带火星的木条复燃,反应结束后,滴入紫色石蕊溶液,溶液变蓝。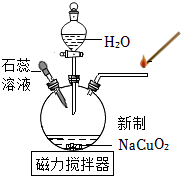 (1)、NaCuO2中铜元素的化合价为。(2)、NaCuO2与H2O反应的化学方程式为。27. 结合如图回答问题。
(1)、NaCuO2中铜元素的化合价为。(2)、NaCuO2与H2O反应的化学方程式为。27. 结合如图回答问题。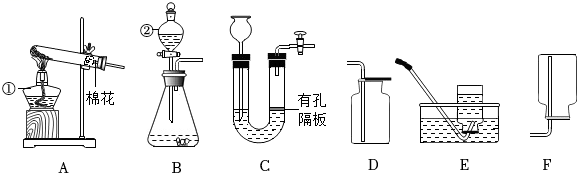 (1)、写出仪器名称:① , ②。(2)、用高锰酸钾制取O2 , 选用的发生装置是(填序号)。反应的化学方程式为。选用装置D收集O2的理由是。(3)、实验室用Zn与稀硫酸反应制取H2 , 反应的化学方程式为 , 发生装置C相对于装置B的优点是。(4)、用图1装置制取CO2并探究其性质。图2表示装置H中溶液的pH与实验时间的变化关系曲线。
(1)、写出仪器名称:① , ②。(2)、用高锰酸钾制取O2 , 选用的发生装置是(填序号)。反应的化学方程式为。选用装置D收集O2的理由是。(3)、实验室用Zn与稀硫酸反应制取H2 , 反应的化学方程式为 , 发生装置C相对于装置B的优点是。(4)、用图1装置制取CO2并探究其性质。图2表示装置H中溶液的pH与实验时间的变化关系曲线。
已知:此实验条件下Na2CO3溶液的pH≈11.6,NaHCO3溶液的pH≈8.3。
①装置G的作用是。
②实验50s时装置H溶液中的溶质是。
③实验150s时显示器中曲线pH<7的原因是。
28. 水是人类不可或缺的物质,水有硬水和软水之分,硬水中含有较多的Mg(HCO3)2。(1)、生活中常用来区分硬水和软水。(2)、将CO2通入Mg(OH)2悬浊液中可获得Mg(HCO3)2溶液,反应的化学方程式为。(3)、煮沸Mg(HCO3)2溶液,产生白色固体。某同学对白色固体的组成进行下列探究。【猜想】白色固体为:①MgCO3;②Mg(OH)2;③xMgCO3•yMg(OH)2•zH2O。
【实验1】称取3.64g白色固体,加入过量的稀盐酸,出现气泡,则猜想(填序号,下同)不成立。将产生的气体全部通入过量的澄清石灰水中,产生3.0g沉淀,则猜想成立。
(4)、【实验2】另取7.28g白色固体,充分加热生成MgO、CO2和H2O,将产生的气体全部缓缓通过如图所示的装置(选填“甲或“乙”),分别测定生成气体的质量。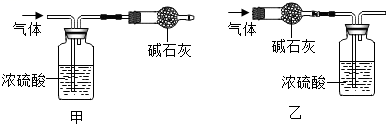
实验测得浓硫酸的质量增加1.44g,碱石灰的质量增加2.64g,则x:y:z=。
(5)、若将xMgCO3•yMg(OH)2•zH2O浸泡在浓NaOH溶液中,密封放置一段时间,固体变为Mg(OH)2。该反应的化学方程式为。29. 现有一包不纯的Na2SO4固体,可能含有Na2CO3、BaCO3、FeCl3、NH4HCO3、NaCl中的一种或几种,现做如下实验。(1)、取适量的固体微热,无氨味,则原固体中一定不含。(2)、另取适量的固体加水溶解,得无色澄清溶液,则原固体中一定不含。(3)、向步骤(2)所得溶液中加入过量的Ba(NO3)2溶液,过滤得白色固体A和无色滤液B。取固体A,加入过量的稀硝酸,部分固体溶解,则原固体中一定含 , 写出部分固体溶解反应的化学方程式:。(4)、取少量滤液B,滴加AgNO3溶液,产生白色沉淀,则原固体中一定含。30. 铁及其化合物在生产生活中有广泛应用。(1)、Ⅰ.铁的有关知识
明代科学著作《天工开物》(图1)记载了我国劳动人民的科技成就。
①“或用木炭,……扇炉风箱,……土(铁矿石)化成铁……”描述了古代练铁的方法。用化学方程式表示用赤铁矿炼铁的原理:。
②对生铁炼钢的描述有:“凡钢铁炼法,……火力到时,生铁先化。”说明生铁的熔点比钢。
③“烧铁器淬胆矾水中,即成铜色也”,句中蕴含的化学反应基本类型是。
(2)、铁器表面通过化学方法可形成致密的Fe3O4保护膜,其组成可用FeO•Fe2O3表示。故宫博物院对某出土铁器保护的过程如表。①检测锈蚀产物
主要成分
Fe3O4
Fe2O3•H2O
FeOOH
FeOCl
说明铁器在含有O2、和盐等环境中容易被腐蚀。
②化学修复出土铁器可通过脱氯、还原、形成保护层来实现,原理如下。
FeOClFeOOHFe3O4
脱氯时发生反应的化学方程式为 , 还原时铁元素的化合价(选填“部分”“全部”或“没有”)降低。
(3)、Ⅱ.催化剂Fe3O4的制备Fe3O4是合成氨催化剂的主要成分。用铁泥(主要成分为Fe2O3、FeO,含少量Fe)制备Fe3O4的主要流程如下。

“还原”时,Fe可将Fe2(SO4)3转化为FeSO4 , 该反应的化学方程式为。
(4)、加入H2O2 , 将部分FeSO4转化为Fe2(SO4)3。“氧化”时温度不宜太高,原因是。(5)、“沉淀”时要控制NaOH的量,原因是。(6)、“转化”时发生反应的化学方程式为。(7)、Ⅲ.失效催化剂的再生合成氨催化过程中因部分Fe3O4与H2反应使催化剂“失效”。在一定温度下可用O2将其“再生”,原理如图2所示。“再生”过程中铁元素的质量分数(选填“变大”“变小”成“不变”)。
 (8)、通入O2加热,将一定质量的失效催化剂进行“再生”,固体质量与温度变化的关系如图3所示。T1~T2℃时,FeO转化为Fe3O4 , T3~T4℃时,Fe3O4转化为Fe2O3。
(8)、通入O2加热,将一定质量的失效催化剂进行“再生”,固体质量与温度变化的关系如图3所示。T1~T2℃时,FeO转化为Fe3O4 , T3~T4℃时,Fe3O4转化为Fe2O3。①M=。
②A点固体中m(FeO):m(Fe3O4)=.