2024年中考化学二轮专题复习-金属与金属矿物
试卷更新日期:2024-04-06 类型:二轮复习
一、选择题
-
1. 我省地铁建设迅猛发展,修建地铁广泛使用金属材料,下列不属于金属材料的是( )A、铜 B、生铁 C、锰钢 D、金刚石2. 下列有关事实的解释中,错误的是( )A、生铁和钢的性能不同﹣﹣含碳量不同 B、硫和磷的元素种类不同﹣﹣质子数不同 C、水和过氧化氢的化学性质不同﹣﹣氧原子个数不同 D、Na和Na+化学性质不同﹣﹣最外层电子数不同3. 采用现代数控技术所生产的0.01mm铝箔,由铝块加工而成的,这体现了铝具有( )A、延展性 B、导电性 C、导热性 D、密度小4. 材料与人类生活密切相关。下列物品的主要成分不属于金属材料的是( )A、易拉罐
 B、青铜器
B、青铜器 C、青花瓷
C、青花瓷 D、硬铝
D、硬铝 5. 王同学想比较两种未知金属M、N和金属铝的活动性大小关系。他将M、N、铝三种金属粉末分别投入6.3%稀盐酸中,观察到金属M、铝粉表面有气泡产生,金属N无明显现象。另取一小块金属M投入硫酸铝溶液中,没有明显现象。据此判断三种金属的活动性顺序由强到弱的是( )A、铝>M>N B、N>M>铝 C、M>铝>N D、铝>N>M6. 兴趣小组同学用相同形状的铁,镁、铝、锌四种金属分别和等浓度等体积的足量稀盐酸用图1所示装置进行实验,反应过程气压变化如图2所示,下列说法错误的是( )
5. 王同学想比较两种未知金属M、N和金属铝的活动性大小关系。他将M、N、铝三种金属粉末分别投入6.3%稀盐酸中,观察到金属M、铝粉表面有气泡产生,金属N无明显现象。另取一小块金属M投入硫酸铝溶液中,没有明显现象。据此判断三种金属的活动性顺序由强到弱的是( )A、铝>M>N B、N>M>铝 C、M>铝>N D、铝>N>M6. 兴趣小组同学用相同形状的铁,镁、铝、锌四种金属分别和等浓度等体积的足量稀盐酸用图1所示装置进行实验,反应过程气压变化如图2所示,下列说法错误的是( )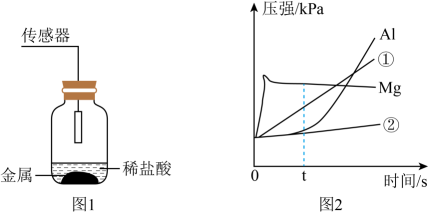 A、时间为t时,放出气体最多的是镁 B、图中曲线①、②对应的物质分别是锌和铁 C、根据铝对应曲线判断,在实验前可能没有完全除去铝表面致密的氧化铝 D、镁对应的气压变化只与生成的气体有关7. 为探究“影响锌与酸反应剧烈程度的因素",关于下列实验设计说法正确的是( )
A、时间为t时,放出气体最多的是镁 B、图中曲线①、②对应的物质分别是锌和铁 C、根据铝对应曲线判断,在实验前可能没有完全除去铝表面致密的氧化铝 D、镁对应的气压变化只与生成的气体有关7. 为探究“影响锌与酸反应剧烈程度的因素",关于下列实验设计说法正确的是( )实验①
实验②
实验③


 A、对比实验①和②,可研究酸的种类对反应剧烈程度的影响 B、对比实验①和②,可研究锌的形状对反应剧烈程度的影响 C、对比实验①和③,可研究温度对反应剧烈程度的影响 D、对比实验②和③,可研究温度对反应剧烈程度的影响8. 学习小组通过下列实验探究CuSO4溶液的性质。
A、对比实验①和②,可研究酸的种类对反应剧烈程度的影响 B、对比实验①和②,可研究锌的形状对反应剧烈程度的影响 C、对比实验①和③,可研究温度对反应剧烈程度的影响 D、对比实验②和③,可研究温度对反应剧烈程度的影响8. 学习小组通过下列实验探究CuSO4溶液的性质。实验Ⅰ把一根砂纸打磨过的Al丝浸入CuSO4溶液中,一段时间后观察到Al丝表面出现红色物质。
实验Ⅱ向CuSO4溶液中滴加少量NaOH溶液,出现沉淀。
下列说法正确的是( )
A、实验Ⅰ中溶液颜色不变 B、实验Ⅰ说明Al的活动性比Cu的强 C、实验Ⅱ中只发生物理变化 D、实验Ⅱ中沉淀为CuO9. 向三个烧杯中分别放入足量、形状大小相同的Mg、Al、Fe固体,同时加入浓度相同的200g稀盐酸,充分反应。反应的有关图像错误的是( )A、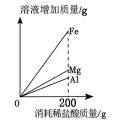 B、
B、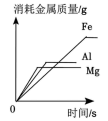 C、
C、 D、
D、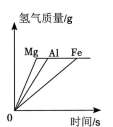 10. 物质的分离提纯是化学学习的重要部分。除去下列物质中含有的杂质,所用试剂和方法均正确的是( )
10. 物质的分离提纯是化学学习的重要部分。除去下列物质中含有的杂质,所用试剂和方法均正确的是( )选项
物质(括号内为杂质)
除杂试剂和方法
A
加入足量的锌粉,过滤
B
加入适量的溶液,过滤
C
加入足量水溶解,过滤,洗涤滤渣、干燥
D
溶液
加入过量溶液,过滤
A、A B、B C、C D、D11. 金属是一类重要的材料。下列有关金属的说法正确的是( )A、目前铜是世界上年产量最大的金属 B、合金的硬度一般比组成其成分的金属硬度低 C、钢铁表面刷油漆可以有效防止生锈 D、铝有很好的抗腐蚀性能是因为化学性质不活泼12. 某小组以图1装置用CO还原CuO制取Cu,不同温度下反应4小时后固体物质的XRD图如图2所示(XRD图谱可用于判断某固体物质是否存在,不同固体出现的衍射峰的衍射角不同)。下列说法正确的是 A、400℃时固体产物只有Cu B、实验中,随着温度的升高,CuO先全部转化为Cu2O,再转化为Cu C、取32gCuO放在图1管中,在一定温度下全部转化为Cu时,消耗CO的质量等于1.2g D、取32gCuO放在图1管中,在一定温度下实验,最终得到固体产物Cu和Cu2O的质量的为27.2g,则生成的CO2质量为13.2g13. 如图所示的两个实验中,CuSO4溶液和FeCl3溶液较少,Na2O和Na2O2稍微过量。则下列关于实验现象或反应原理的描述不正确的是( )
A、400℃时固体产物只有Cu B、实验中,随着温度的升高,CuO先全部转化为Cu2O,再转化为Cu C、取32gCuO放在图1管中,在一定温度下全部转化为Cu时,消耗CO的质量等于1.2g D、取32gCuO放在图1管中,在一定温度下实验,最终得到固体产物Cu和Cu2O的质量的为27.2g,则生成的CO2质量为13.2g13. 如图所示的两个实验中,CuSO4溶液和FeCl3溶液较少,Na2O和Na2O2稍微过量。则下列关于实验现象或反应原理的描述不正确的是( ) A、两支试管中均发生两个化学反应 B、两支试管中均产生有颜色的沉淀 C、两支试管中均有无色气体生成 D、反应后,过滤所得溶液均为无色14. 等质量的镁、铝、铁.锌与足量稀硫酸反应,它们放出氢气的质量和反应时间的关系如图,其中正确的是( )A、
A、两支试管中均发生两个化学反应 B、两支试管中均产生有颜色的沉淀 C、两支试管中均有无色气体生成 D、反应后,过滤所得溶液均为无色14. 等质量的镁、铝、铁.锌与足量稀硫酸反应,它们放出氢气的质量和反应时间的关系如图,其中正确的是( )A、 B、
B、 C、
C、 D、
D、 15. 将一定量的锌粉加入到硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸,有气泡产生,则下列叙述正确的是( )A、滤渣中一定含有铜和锌 B、向滤渣中加入稀盐酸,最后溶液一定变成浅绿色 C、滤液中溶质一定含有硫酸锌和硫酸镁 D、滤液的颜色不可能为浅绿色16. 在64.0g铁粉中先后加稀硫酸和CuSO4溶液,固体质量与所加溶液质量的关系如图所示。下列说法不正确的是( )
15. 将一定量的锌粉加入到硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸,有气泡产生,则下列叙述正确的是( )A、滤渣中一定含有铜和锌 B、向滤渣中加入稀盐酸,最后溶液一定变成浅绿色 C、滤液中溶质一定含有硫酸锌和硫酸镁 D、滤液的颜色不可能为浅绿色16. 在64.0g铁粉中先后加稀硫酸和CuSO4溶液,固体质量与所加溶液质量的关系如图所示。下列说法不正确的是( ) A、在b点固体能完全溶于足量稀硫酸 B、d点对应的溶液含两种溶质 C、M的值为56.0 D、a、c点对应的溶液中FeSO4质量比为1:817. 将等质量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份稀硫酸中,反应完成后生成氢气的质量关系不可能的是( )A、
A、在b点固体能完全溶于足量稀硫酸 B、d点对应的溶液含两种溶质 C、M的值为56.0 D、a、c点对应的溶液中FeSO4质量比为1:817. 将等质量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份稀硫酸中,反应完成后生成氢气的质量关系不可能的是( )A、 B、
B、 C、
C、 D、
D、 18. 2020年8月,考古学家在平阳县西晋古墓中发现盂(如图)。盂是古代一种温酒的金属器具。推断该金属具有的性质是( )
18. 2020年8月,考古学家在平阳县西晋古墓中发现盂(如图)。盂是古代一种温酒的金属器具。推断该金属具有的性质是( ) A、熔点低 B、导热性好 C、密度大 D、易腐蚀19. 自从央行公告第四套人名币 1角硬币从2016年11月1日起只收不付后,“菊花1角”身价飞涨。一个很重要的原因是“菊花1角”使用了铝锌材质,材质特殊,导致其日渐稀少。铝、锌元素的部分信息如下,则下列说法正确的是( )
A、熔点低 B、导热性好 C、密度大 D、易腐蚀19. 自从央行公告第四套人名币 1角硬币从2016年11月1日起只收不付后,“菊花1角”身价飞涨。一个很重要的原因是“菊花1角”使用了铝锌材质,材质特殊,导致其日渐稀少。铝、锌元素的部分信息如下,则下列说法正确的是( ) A、铝比锌的金属活动性更弱 B、相等质量的铝和锌与足量稀硫酸反应,铝产生的氢气多 C、锌原子的最外层电子数比铝多17 D、铝的相对原子质量为26.98%20. 钛和钛的合金被认为是21世纪的重要材料。它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工等。另外,钛合金与人体有很好的“相容性”。根据钛和钛的合金的主要性能,下列用途不切合实际的是( )A、用来做保险丝 B、用于制造航天飞机 C、用来制造人造骨 D、用于制造船舶
A、铝比锌的金属活动性更弱 B、相等质量的铝和锌与足量稀硫酸反应,铝产生的氢气多 C、锌原子的最外层电子数比铝多17 D、铝的相对原子质量为26.98%20. 钛和钛的合金被认为是21世纪的重要材料。它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工等。另外,钛合金与人体有很好的“相容性”。根据钛和钛的合金的主要性能,下列用途不切合实际的是( )A、用来做保险丝 B、用于制造航天飞机 C、用来制造人造骨 D、用于制造船舶二、填空题
-
21. 铁钉在空气中与和等物质相互作用容易生锈;而铜生锈变为Cu2(OH)2CO3则是铜在空气中与上述两种物质再和物质相互作用的结果.22. 我国是茶文化的发源地。唐代陆羽《茶经》中记载:“风炉以铜铁铸之……底一窗以为通飚漏烬之所。风能兴火,火能熟水。”“漉水囊……其格以生铜铸之。”
 (1)、“铜铁”(填“属于”或“不属于”)金属材料。(2)、“飚”(即风)提供燃烧所需的。(3)、“漉水囊”可将茶叶与茶水分离,类似于基本实验操作中的。(4)、茶香四溢,从分子角度解释其原因是。(5)、风炉煮茶,但古人学习习惯用灯盏,其中诗人陆游的笔记中记数“书灯勿用铜盏,想瓷盏最省油,蜀中有夹瓷盏…可省油之半”“一端作小窍,注清冷水于其中,每夕一易之”,夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。其结构示意图如图。
(1)、“铜铁”(填“属于”或“不属于”)金属材料。(2)、“飚”(即风)提供燃烧所需的。(3)、“漉水囊”可将茶叶与茶水分离,类似于基本实验操作中的。(4)、茶香四溢,从分子角度解释其原因是。(5)、风炉煮茶,但古人学习习惯用灯盏,其中诗人陆游的笔记中记数“书灯勿用铜盏,想瓷盏最省油,蜀中有夹瓷盏…可省油之半”“一端作小窍,注清冷水于其中,每夕一易之”,夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。其结构示意图如图。
图中属于可燃物的和是和 , 这是燃烧的个条件之一。(6)、省油灯的原理是:油燃烧 , 上层内盏油温 , 下层盏内水吸热,减少油的 , 以达到省油的目的。23. 《天工开物》中记载了采矿和冶炼金属锡的场景。 (1)、采矿如图:“水锡……其质黑色……愈经淘取”是指水中淘取锡砂(锡矿石)。锡砂主要成分为SnO2 , (填“易”或“难”)溶于水,图中用筛子淘取锡砂的过程与化学上的操作原理相似,SnO2中锡元素的化合价为。(2)、冶炼如图:“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(鼓入空气)熔化。”
(1)、采矿如图:“水锡……其质黑色……愈经淘取”是指水中淘取锡砂(锡矿石)。锡砂主要成分为SnO2 , (填“易”或“难”)溶于水,图中用筛子淘取锡砂的过程与化学上的操作原理相似,SnO2中锡元素的化合价为。(2)、冶炼如图:“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(鼓入空气)熔化。”①高温条件下,木炭能把锡从锡砂中还原出来,反应的化学方程式为 , 属于反应(填基本反应类型)。
②炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡更易熔化,其原因是加铅后形成的锡铅合金。
(3)、使用:古代锡器很少装酸性物质,原因是。24. 金属与金属材料在人类文明进步和社会发展中起着至关重要的作用。回答下列问题: (1)、利用物理方法可以把黄金压成厚度只有的薄片,说明金具有良好的 ____(填字母)。A、金属光泽 B、导电性 C、延展性 D、导热性(2)、在钢铁制品表面刷油漆可防止锈蚀,其原因是 。(3)、某同学设计如图所示实验方案,验证铁、铜、银三种金属的活动性强弱。
(1)、利用物理方法可以把黄金压成厚度只有的薄片,说明金具有良好的 ____(填字母)。A、金属光泽 B、导电性 C、延展性 D、导热性(2)、在钢铁制品表面刷油漆可防止锈蚀,其原因是 。(3)、某同学设计如图所示实验方案,验证铁、铜、银三种金属的活动性强弱。能证明铁的金属活动性比铜强的实验现象是 ;要验证铜的金属活动性比银强,试管C中应加入 (填化学式)溶液。
25. 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。(1)、在空气中 制品更耐腐蚀。(填“铝”或“铁")(2)、人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如。(3)、铁在空气中被锈蚀,实际上是空气中的共同作用的结果;为防止金属锈蚀,常采用的方法。(4)、若要验证铜、铁、铝的活动性顺序,某同学选择了已经打磨过的铁丝,他还需要的是。三、综合题
-
26. 我国有着悠久的钢铁冶炼史,《天工开物》中记载常见铁矿石:“质有土锭,碎砂数种”,以及炒钢法:“凡铁分生、熟,出炉未炒则生,既炒则熟”。(1)、含有氧化铁的铁矿石俗称 .(2)、图1中不断翻炒液态生铁最终获得钢,是为了降低元素的含量。(3)、火星探测器发回的信息表明火星上存在有含铁矿物,如含黄钾铁矾【主要成分的化学式为】的矿石,黄钾铁矾中 .
图1
 图2
图2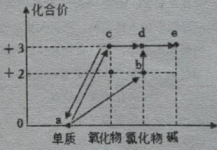 (4)、铁和铁的化合物在生活生产中发挥着重要作用,图2为含铁元素物质转化的价类二维图。
(4)、铁和铁的化合物在生活生产中发挥着重要作用,图2为含铁元素物质转化的价类二维图。①炼铁是反应c→a,化学方程式为。
②a→b反应方程式为 .
27. 某兴趣小组从含有FeSO4、CuSO4的废液中回收金属铜和硫酸亚铁晶体,设计了如图操作方案,回答下列问题: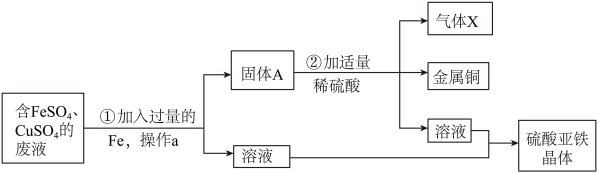 (1)、步骤①中的Fe与空气中的氧气和(写化学式)作用容易生锈,写出一种防止铁制品生锈的措施 。(2)、操作a的名称是 , 所用的玻璃仪器有玻璃棒、和烧杯,玻璃棒的作用是。(3)、写出金属铜的一种用途。步骤①发生反应的化学方程式为 ;(4)、步骤②的现象为:固体部分溶解,(补全现象);(5)、理论上所得到的硫酸亚铁晶体中硫酸亚铁的质量 (填“>”、“<”或“=”)原废液中硫酸亚铁的质量。
(1)、步骤①中的Fe与空气中的氧气和(写化学式)作用容易生锈,写出一种防止铁制品生锈的措施 。(2)、操作a的名称是 , 所用的玻璃仪器有玻璃棒、和烧杯,玻璃棒的作用是。(3)、写出金属铜的一种用途。步骤①发生反应的化学方程式为 ;(4)、步骤②的现象为:固体部分溶解,(补全现象);(5)、理论上所得到的硫酸亚铁晶体中硫酸亚铁的质量 (填“>”、“<”或“=”)原废液中硫酸亚铁的质量。四、实验探究题
-
28. 已知在加热的条件下,H2与菱铁矿(主要成分为FeCO3 , 其它成分不参与反应)反应制成铁粉。化学兴趣小组完成如下实验:
查阅资料:①H2也具有还原性,能与CuO反应生成H2O,白色的无水硫酸铜遇H2O迅速变为蓝色;
②CO2与无水硫酸铜不反应;
③浓H2SO4能吸收水分,作干燥剂。
(1)、同学们探究反应后气体成分:先将反应后气体通入无水硫酸铜,无水硫酸铜变蓝,证明气体中含有 , 再通入足量的澄清石灰水,澄清石灰水变浑浊,反应方程式为。(2)、对(1)的剩余气体成分进行以下三种猜想:猜想一:H2;猜想二:﹔猜想三:CO和H2。

①在实验过程中,观察到甲装置中黑色固体变为红色,乙中无水硫酸铜变蓝,丙中澄清石灰水变浑浊,由此可知,猜想正确。
②丙装置中,排出的废气要进行处理,请你替凌芸同学提出一种科学的处理方法。
(3)、请替化学兴趣小组的同学们写出H2与FeCO3反应的化学方程式:。29. 二氧化碳是空气的重要组成成分,对我们的生产、生活有着重大的影响。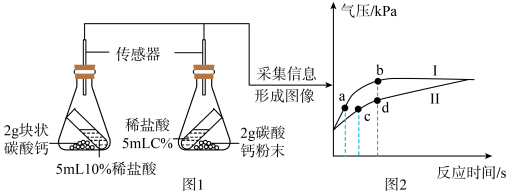 (1)、为比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速率,小组同学进行了如图 1 所示实验,并用压强传感器测得锥形瓶内气压变化情况如图 2所示。
(1)、为比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速率,小组同学进行了如图 1 所示实验,并用压强传感器测得锥形瓶内气压变化情况如图 2所示。①图 1 中 C的数值为.
②曲线(选填“I”或“Ⅱ”)表示的是碳酸钙粉末与稀盐酸的反应。
③对比分析图2中(选填“a”、“b”、“c”或“d”)两点实验数据,可比较锥形瓶内的反应速率。
(2)、小组同学称取 12g大理石样品,将 80g 稀盐酸分 4 次加入样品中(假设杂质不反应,也不溶于水),测得实验数据如下:次数
第1次
第2次
第3次
第4次
加入稀盐酸的质量/g
20
20
20
20
剩余固体质量/g
9
6
3
2
①12g大理石样品中碳酸钙的质量是 g
②计算反应结束时制得二氧化碳的质量是 g。(写出计算过程)。
五、计算题
-
30. 黄铜可用于制造子弹壳,已知组成某弹壳的黄铜中只含有锌和铜,现将20g该弹壳剪碎后放入烧杯中,再向烧杯中加入过量稀硫酸至完全反应。测得反应过程中生成的氢气质量与反应时间关系如图所示。
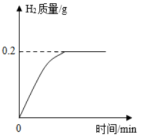
请回答:
(1)、实验过程中将弹壳剪碎的目的是。(2)、判断稀硫酸与黄铜完全反应的现象是 , 完全反应后烧杯中含有的阳离子是(填离子符号)。(3)、兴趣小组的同学为了充分利用资源,将反应后的物质过滤,回收其中的金属物质。过滤中需要用到的下列玻璃仪器有____。A、量筒 B、烧杯 C、长颈漏斗 D、铁架台(4)、计算该弹壳中铜的质量分数。(写出计算过程)