陕西省西安市八校2023-2024学年高一上学期期中联考化学试题
试卷更新日期:2024-04-03 类型:期中考试
一、单选题(本题包括10个小题,每小题2分,共20分。在每小题所给的四个选项中,只有一个选项符合题意,选对得2分,选错或不选得0分)
-
1. 某自热火锅发热包的成分为生石灰、苛性钠、铝粉、活性炭、还原铁粉、纯碱。下列关于发热包成分的物质分类正确的是( )
选项
A
B
C
D
物质
苛性钠、纯碱
铝粉、铁粉
生石灰
活性炭、纯碱
类别
碱
单质
酸性氧化物
含碳化合物
A、A B、B C、C D、D2. 溶液和胶体这两种分散系的根本区别是( )A、是否能通过半透膜 B、分散质粒子直径的大小 C、是否存在丁达尔效应 D、是否均一、透明、稳定3. 下列属于非电解质的是( )A、酒精溶液 B、Cu C、熔融 D、4. 下列反应的离子方程式书写正确的是( )A、大理石与盐酸反应: B、铜与硝酸银溶液反应: C、稀硝酸与氢氧化钾溶液反应: D、二氧化碳与氢氧化钠溶液反应:5. 下列生活中的化学现象与氧化还原知识无关的是( )A、菜刀洗过后如果没擦干,放置一段时间就会出现斑点 B、用盐酸可以除去铁锈 C、用天然气做饭烧菜 D、月饼盒中放置硫酸亚铁粉末包6. 下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )A、2Na+2H2O=2NaOH+H2↑ B、Cl2+H2O=HCl+HClO C、SO2+H2O=H2SO3 D、C+H2OCO↑+H2↑7. 英国化学家汉弗里·戴维在十九世纪初通过电解的方式获得金属钠的单质,下列有关金属钠的性质描述,错误的是( )A、金属钠性质活泼,一般保存在煤油中 B、Na的金属性强,可从硫酸铜溶液中置换出铜 C、金属钠可用刀切割,说明其硬度较小 D、使用后多余的金属钠应放回试剂瓶中8. 下列物质不可由对应的两种单质直接化合制备的是( )A、 B、HCl C、 D、9. 下列说法正确的是( )A、的摩尔质量是 B、标准状况下,水中约含个分子 C、常温常压下,中所含氧原子数约为 D、常温常压下,的体积是10. 抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。下列劳动与所涉及的化学知识不相符的是选项
家务劳动
化学知识
A
用白醋除去水壶中的水垢
白醋可溶解沉淀
B
用小苏打粉作膨松剂焙制糕点
加热容易分解放出
C
用含NaClO的84消毒液拖地
NaClO有还原性
D
用洁厕灵洗马桶
洁厕灵中含有盐酸,可以与尿垢反应
A、A B、B C、C D、D二、单选题(本题包括10个小题,每小题3分,共30分。在每小题所给的四个选项中,只有一个选项符合题意,选对得3分,选错或不选得0分)
-
11. 有两个无标签的试剂瓶,分别盛有Na2CO3、NaHCO3固体,有四位同学为鉴别它们采用了以下不同方法,其中不可行的是( )A、分别将它们配制成溶液,再加入澄清石灰水 B、分别将它们配制成溶液,再加入CaCl2溶液 C、分别将它们配制成溶液,再逐滴滴加稀盐酸 D、分别加热,再用澄清石灰水检验是否有气体产生12. 下列溶液中,能大量共存的离子组是( )A、含大量的溶液:、、、 B、含大量溶液:、、、 C、某强碱性溶液:、、、 D、含大量的溶液:、、、13. 下列对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断均正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
氯气能使湿润的红色布条褪色
氯气具有漂白性
Ⅰ对;Ⅱ对;有
B
可作潜水艇的供氧剂
能和、反应生成
Ⅰ对;Ⅱ对;有关系
C
金属钠在空气中很容易变质
金属钠具有强还原性
Ⅰ错;Ⅱ对;有关系
C
中
 少量杂质可将气体通入饱和溶液除去
少量杂质可将气体通入饱和溶液除去可与反应
Ⅰ对,Ⅱ对,有去
A、A B、B C、C D、D14. 对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是( )A、气体分子数之比为1:1 B、原子个数之比为3:4 C、气体体积之比为5:4 D、含硫原子的个数比为5:415. 电视剧中《三生三世十里桃花》中的仙境美轮美奂,其中所需的烟雾是在放于温热石棉网上的和Zn粉的混合物中滴几滴水后产生的白烟: , 下列说法中正确的是( )A、该反应中仅是还原产物 B、常温下每消耗1.3gZn粉,即可产生 C、该反应中作氧化剂,Zn作还原剂 D、每生成1molZnO共转移5mol电子16. 已知由二氧化碳和氧气组成的混合气体,其平均相对分子质量为38,则该混合气体中二氧化碳和氧气的质量比为( )A、1∶1 B、1∶2 C、11∶8 D、8∶1117. 某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得溶液的导电能力随时间的变化曲线如图所示。下列说法错误的是(不考虑水的电离)( )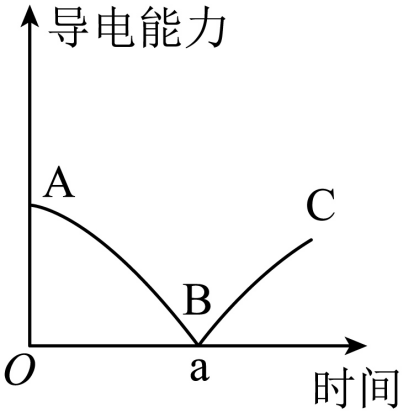 A、A点溶液中的微粒只有Ba2+和OH- B、B点表示Ba(OH)2溶液与稀硫酸恰好完全中和 C、B—C的过程中。溶液的导电能力逐渐增强的原因之一是溶液中能够自由移动的离子数目增多(单位体积内) D、A—C的过程中。仅发生一种属于基本反应类型的反应18. 一定温度下,向饱和的烧碱溶液中加入一定量的金属钠,充分反应后恢复到原温度,下列叙述正确的是( )A、溶液中数目减少,有放出 B、溶液中溶质的质量分数增大,有放出 C、溶液中溶质的质量分数不变,有放出 D、溶液中数目增大,有放出19. 已知:NaClO能与水缓慢反应生成NaOH、HClO。某小组探究“84消毒液”的性质,请你参与他们的探究活动。
A、A点溶液中的微粒只有Ba2+和OH- B、B点表示Ba(OH)2溶液与稀硫酸恰好完全中和 C、B—C的过程中。溶液的导电能力逐渐增强的原因之一是溶液中能够自由移动的离子数目增多(单位体积内) D、A—C的过程中。仅发生一种属于基本反应类型的反应18. 一定温度下,向饱和的烧碱溶液中加入一定量的金属钠,充分反应后恢复到原温度,下列叙述正确的是( )A、溶液中数目减少,有放出 B、溶液中溶质的质量分数增大,有放出 C、溶液中溶质的质量分数不变,有放出 D、溶液中数目增大,有放出19. 已知:NaClO能与水缓慢反应生成NaOH、HClO。某小组探究“84消毒液”的性质,请你参与他们的探究活动。[观察]“84消毒液”是一种透明的液体。
[预测]NaClO中Cl显+1价,可能具有漂白性;它是弱酸盐,能与较强酸反应。
[实验]在相同条件下进行实验,测得“84消毒液”的漂白效率与温度的关系如图所示。
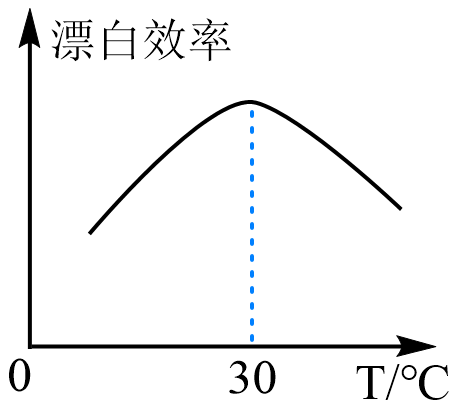
下列判断正确的是( )
A、上述探究活动中只用到了观察法、实验法 B、可用pH试纸测定“84消毒液”的pH值 C、“84消毒液”需密封保存,使用时可用沸水稀释 D、温度大于30℃时,漂白效率降低的原因可能是HClO分解加快20. 某无色溶液可能由Na+、Ba2+、Cu2+、CO、HCO、SO、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:①取少量该溶液加入足量氯水,有气体产生,得到甲溶液;
②取少量甲溶液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀甲;
③取少量原溶液,向其中加入Ba(OH)2溶液,产生白色沉淀乙,加足量稀盐酸,沉淀部分溶解。下列关于原溶液说法正确的是( )
A、肯定存在SO、Cl- B、肯定不存在Ba2+ , 可能存在Cu2+ C、CO、HCO至少存在一种 D、是否存在Na+需要通过焰色试验来确定三、填空题(本题包括2个小题,共24分,请把正确的答案填在答题卡的相应横线上。)
-
21. 回答下列问题:(1)、下列物质能导电的是 , 属于电解质的是 , 属于非电解质的是。
①NaCl晶体,②液态 , ③液态醋酸,④铜,⑤固体,⑥蔗糖(),⑦氨水
(2)、和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:①请配平上述化学方程式:;
②浓盐酸在反应中显示出来的性质是(填编号)
A.还原性 B.酸性 C.氧化性
③氧化剂是 , 氧化产物是;
④每产生 , 则转移的电子的物质的量为mol。
22. 填空:(1)、某金属氯化物 , 含有 , 则该化合物的摩尔质量为;(2)、含有个水分子;(用表示,代表阿伏加德罗常数的值)(3)、(标况)约含mol氢原子;(4)、个含有电子的物质的量为;(5)、含 , R的相对原子质量为。四、实验题(本题包括2个小题,共26分,请把正确的答案填在答题卡的相应横线上。)
-
23. “化学我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”道理。请填空:(1)、工业上可以利用氯气制漂白粉,其化学方程式为:。(2)、研究小组用下图装置制取:

仪器A的名称为;A中反应的离子方程式为;
(3)、下列收集的正确装置是 。A、 B、
B、 C、
C、 D、
D、 (4)、某同学设计了如图实验装置进一步研究氯气的漂白性,已知通入的氯气中还含有空气和水蒸气。回答下列问题:
(4)、某同学设计了如图实验装置进一步研究氯气的漂白性,已知通入的氯气中还含有空气和水蒸气。回答下列问题:
①浓的作用是;
②与研究目的直接相关的实验现象是 , 并解释产生上述现象的原因;
③该实验设计存在事故隐患,应在D处增加一装置,该装置的作用是。
24. 1942年,我国化工专家侯德榜以NaCl、NH3(氨气)、CO2等为原料先制得NaHCO3 , 进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。某同学模拟工艺流程,制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
已知:NH3极易溶于水,溶液呈碱性。

请回答:
(1)、写出甲中发生反应的离子方程式。(2)、乙装置中的试剂是。(3)、实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。(4)、装置丙中析出NaHCO3的原因是a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(5)、请写出从NaHCO3晶体获得纯碱的化学方程式。(6)、检验产品碳酸钠中含有氯化钠,请你把以下实验方案补充完整:操作:取少量试样溶于水中,再滴加。
现象:。