陕西省西安市未央区2023-2024学年高二上学期期中考试化学试题
试卷更新日期:2024-04-03 类型:期中考试
一、选择题(本题共13小题,每小题2分,共26分。在每小题给出的四个选项中,只有一个选项符合题目要求)
-
1. 下列热化学方程式中,正确的是( )A、甲烷的燃烧热 , 则甲烷燃烧热的热化学方程式可表示为: B、在时,完全燃烧生成液态水,放出热量,燃烧的热化学方程式表示为 C、HCl和NaOH反应的中和热 , 则和反应的中和热 D、、下,已知热化学方程式: , 将和置于密闭容器中充分反应生成 , 放热2. 下列离子方程式表示的是盐类的水解且正确的是 ( )A、 B、 C、 D、3. 下列关于化学反应方向的说法正确的是( )A、凡是放热的反应都是自发反应 B、凡是需要加热才发生的反应都是非自发反应 C、凡是熵增的反应都是自发反应 D、反应是否自发,需要综合考虑反应焓变和熵变4. 在反应2HIH2+I2中,有关反应条件改变使反应速率增大的原因分析中,不正确的是 ( )A、加入适宜的催化剂,可降低反应的活化能 B、增大 , 单位体积内活化分子数增大 C、升高温度,单位时间内有效碰撞次数增加 D、增大压强,活化分子的百分数增大5. 在一密闭容器中发生反应:2A(g)+2B(g)C(s)+3D(g)ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是 ( )A、移走少量C B、选择良好的催化剂 C、缩小容积,增大压强 D、容积不变,充入1molN2(N2不参加反应)6. 反应4A(s)+3B(g)2C(g)+D(g),经2 min 后B的浓度减少0.6 mol·L-1。下列说法正确的是 ( )A、用A表示的反应速率是0.4 mol·L-1·min-1 B、在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1 C、分别用B、C、D表示的反应速率,其比值是3∶2∶1 D、在这2 min内B和C两物质浓度是逐渐减小的7. 下列有关化学平衡常数的描述中正确的是 ( )A、化学平衡常数的大小取决于化学反应本身,与其他外界条件无关 B、相同温度下,反应与反应的化学平衡常数相同 C、反应的化学平衡常数随温度升高而增大 D、反应的平衡常数达式为8. 如图是向100 mL pH=1的盐酸中逐渐加入NaOH溶液时,溶液pH的变化图像,根据如图所得结论正确的是( )
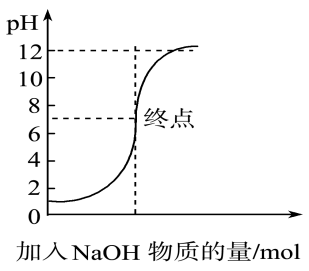 A、原来盐酸的物质的量浓度为0.1 mol·L-1 B、NaOH溶液的物质的量浓度为0.1 mol·L-1 C、原来盐酸的物质的量浓度为1 mol·L-1 D、NaOH溶液的物质的量浓度为0.01 mol·L-19. 反应2NO2(g)N2O4(g) △H=-57 kJ/mor, 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
A、原来盐酸的物质的量浓度为0.1 mol·L-1 B、NaOH溶液的物质的量浓度为0.1 mol·L-1 C、原来盐酸的物质的量浓度为1 mol·L-1 D、NaOH溶液的物质的量浓度为0.01 mol·L-19. 反应2NO2(g)N2O4(g) △H=-57 kJ/mor, 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( ) A、T1>T2 B、X、Y两点的反应速率:X>Y C、X、Z两点气体的颜色:X深,Z浅 D、X、Z两点气体的平均相对分子质量:X>Z10. 如图所示是298K时,A2与B2反应过程中能量变化的曲线图,下列叙述正确的是 ( )
A、T1>T2 B、X、Y两点的反应速率:X>Y C、X、Z两点气体的颜色:X深,Z浅 D、X、Z两点气体的平均相对分子质量:X>Z10. 如图所示是298K时,A2与B2反应过程中能量变化的曲线图,下列叙述正确的是 ( ) A、每生成2 molAB吸收b kJ热量 B、加入催化剂,反应的活化能和反应热都改变 C、该反应的热化学方程式为A2(g)+B2(g)=2AB(g) △H= + (a-b) kJ/mol D、断裂1 mol A-A和1 mol B-B键,放出a kJ能量11. 一定温度下,将2 mol A和2 mol B两种气体混合放入体积为2 L的密闭刚性容器中,发生反应3A(g)+B(g) = xC(g)+2D(g),2 min 末反应达到平衡,生成0.8 mol D,并测得C的物质的量浓度为0.4 mol/L,下列说法正确的是 ( )A、此温度下该反应的平衡常数K等于0.5 B、A的平衡转化率为40% C、x的值为1 D、A和B的平衡转化率相等12. 对于可逆反应: , 下列图象中正确的是( )A、
A、每生成2 molAB吸收b kJ热量 B、加入催化剂,反应的活化能和反应热都改变 C、该反应的热化学方程式为A2(g)+B2(g)=2AB(g) △H= + (a-b) kJ/mol D、断裂1 mol A-A和1 mol B-B键,放出a kJ能量11. 一定温度下,将2 mol A和2 mol B两种气体混合放入体积为2 L的密闭刚性容器中,发生反应3A(g)+B(g) = xC(g)+2D(g),2 min 末反应达到平衡,生成0.8 mol D,并测得C的物质的量浓度为0.4 mol/L,下列说法正确的是 ( )A、此温度下该反应的平衡常数K等于0.5 B、A的平衡转化率为40% C、x的值为1 D、A和B的平衡转化率相等12. 对于可逆反应: , 下列图象中正确的是( )A、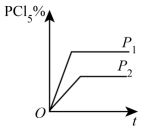 B、
B、 C、
C、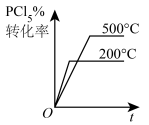 D、
D、 13. 下列反应中,反应速率最大的是( )A、25 ℃时,镁条与0.1 mol·L-1盐酸反应 B、25 ℃时,镁条与0.2 mol·L-1盐酸反应 C、35 ℃时,镁条与0.2 mol·L-1盐酸反应 D、35 ℃时,镁条与0.3 mol·L-1盐酸反应
13. 下列反应中,反应速率最大的是( )A、25 ℃时,镁条与0.1 mol·L-1盐酸反应 B、25 ℃时,镁条与0.2 mol·L-1盐酸反应 C、35 ℃时,镁条与0.2 mol·L-1盐酸反应 D、35 ℃时,镁条与0.3 mol·L-1盐酸反应二、选择题(本题共5小题,每小题3分,共15分。每小题有一个或两个选项符合题目要求,全部选对得3分,选对但不全的得1分,有选错的得0分)
-
14. 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是 ( )
选项
A
B
C
D
强电解质
HNO3
NaCl
BaSO4
盐酸
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
C6H12O6(葡萄糖)
CO2
C2H5OH
H2O
A、A B、B C、C D、D15. 常温下1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息下列说法不正确的是( )共价键
H-H
F-F
H-F
H-Cl
H-I
E(kJ/mol)
436
157
568
432
298
A、表中最稳定的共价键是H-F B、1mol H2(g)与1 mol F2(g)生成2 mol HF(g)放出25 kJ的能量 C、432kJ/mol> E(H-Br)> 298kJ/mol D、1mol H2(g)分解成2 mol H(g)需放出436 kJ的能量16. 在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是 ( ) A、向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) B、25 ℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化 C、T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液呈中性 D、b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-17. 将V1mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
A、向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) B、25 ℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化 C、T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液呈中性 D、b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-17. 将V1mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )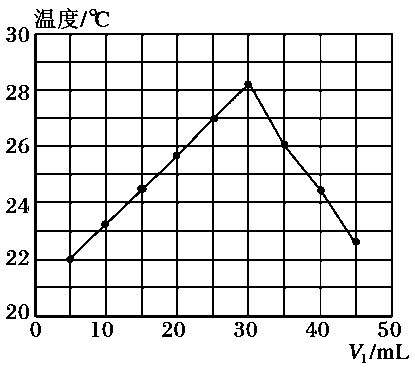 A、做该实验时环境温度为22℃ B、该实验表明有水生成的反应都是放热反应 C、NaOH溶液的浓度约为1.0mol/L D、该实验表明化学能可能转化为热能18. 25 ℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1的体积比混合,若混合溶液中c()=c(Cl-),则溶液的pH ( )A、大于7 B、小于7 C、等于7 D、无法确定
A、做该实验时环境温度为22℃ B、该实验表明有水生成的反应都是放热反应 C、NaOH溶液的浓度约为1.0mol/L D、该实验表明化学能可能转化为热能18. 25 ℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1的体积比混合,若混合溶液中c()=c(Cl-),则溶液的pH ( )A、大于7 B、小于7 C、等于7 D、无法确定三、非选择题(本题共4小题,共59分)
-
19. Ⅰ.以下是关于合成氨的有关问题,请回答:(1)、若在容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在--定条件下发生反应:N2+3H22NH3 △H<0,若5min反应达到平衡,此时测得NH3的物质的量为0.2mol。则0-5min内,用H2表示的化学反应速率为。(2)、平衡后,若提高H2的转化率,可以采取的措施有____。A、加催化剂 B、增大容器体积 C、降低反应体系的温度 D、加入一定量N2(3)、若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)2NH3(g) △H<0,其化学平衡常数K与温度t的关系如表所示:
t℃
200
300
400
K
K1
K2
0.5
请完成下列问题:
①试比较K1、K2的大小,K1K2(填">”、“<”或“=”);
②400℃时,反应2NH3(g)N2(g)+ 3H2(g)的化学平衡常数为。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正 v(N2)逆(填“>” “<”或“=”)。
(4)、Ⅱ.肼(N2H4)是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-544kJ/mol,键能数据如下表:
化学键
N-N
N-H
O=O
O-H
键能/(kJ/mol)
193
391
497
463
则氮氮三键的键能为kJ/mol。
(5)、已知:N2(g)+2O2(g)=2NO2(g) △H= + 68kJ/mol,则肼和二氧化氮反应生成氮气和水蒸气的热化学方程式为。20.(1)、一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是。
(2)、常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为mol·L-1。(3)、在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为同学(填“甲”或“乙”)的说法正确,理由为。(4)、明矾[KAl(SO4)2·12H2O]常用作净水剂,其原理是(用离子方程式表示)。(5)、将FeCl3溶液蒸干并灼烧,最终得到的固体物质是(填写化学式)。21. 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:酸
电离平衡常数
醋酸
碳酸
亚硫酸
(1)、根据上表可知,试比较同浓度Na2CO3、Na2SO3溶液的pH:Na2CO3Na2SO3。(填“>” “<”或 “=”,下同)(2)、向0.1 mol∙L−1的CH3COONa溶液中加入少量下列物质,其水解程度增大的是____。A、NaCl溶液 B、Na2CO3固体 C、NH4Cl溶液 D、CH3COONa固体(3)、已知常温下NH3∙H2O的电离常数 ,则常温下CH3COONH4溶液的pH7。(4)、将pH=4的溶液稀释100倍后溶液的pH范围是 , 图中的纵坐标可以是。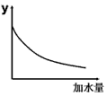
a.溶液的pH b.醋酸的电离平衡常数
c.溶液的导电能力 d.醋酸的电离程度
(5)、NaHSO3是中学化学常见的物质。在水溶液中存在如下两个平衡Ka2
Kh2(水解平衡常数,表示水解程度)
已知25 ℃时,Ka2 > Kh2 , 则0.1 mol∙L−1 NaHSO3溶液呈(填“酸性”“碱性”或“中性”);其中c(Na+)c()(填“>”“<”或“=”);其电荷守恒表达式可写为。
22. 某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
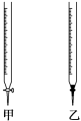 (1)、正确的操作步骤是(填写字母)→→→D→;(2)、 若用标准浓度的H2SO4溶液测定NaOH溶液的浓度,参看图示从下表中选出正确选项( )
(1)、正确的操作步骤是(填写字母)→→→D→;(2)、 若用标准浓度的H2SO4溶液测定NaOH溶液的浓度,参看图示从下表中选出正确选项( )锥形瓶中溶液
滴定管中溶液
选用指示剂
选用滴定管
A
碱
酸
石蕊
乙
B
酸
碱
酚酞
甲
C
碱
酸
甲基橙
甲
D
酸
碱
石蕊
乙
(3)、 操作D中液面应调整到 , 尖嘴部分应;(4)、 滴定终点时的颜色变化是;(5)、若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响(填“偏高”、“偏低”或“无影响”,其他操作均正确);(6)、该烧碱样品的纯度计算式是。