海南省海口市部分中学2023-2024学年高一上学期11月期中考试化学试题
试卷更新日期:2024-04-03 类型:期中考试
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 中华传统文化源远流长,下列说法与氧化还原反应无关的是( )A、《梦溪笔谈》:“熬胆矾铁釜,久之亦化为铜” B、《无题》:“春蚕到死丝方尽,蜡炬成灰泪始干” C、《元日》:“爆竹声中一岁除,春风送暖入屠苏” D、《咏煤炭》:“凿开混沌得乌金……不辞辛苦出山林”2. 下列操作或现象与粒子直径大小无关的是( )
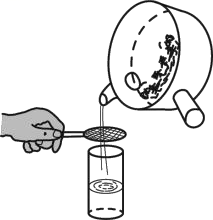


A.熬药后箅渣
B.戴口罩防雾霾
C.NaCl溶液蒸发结晶
D.森林中的丁达尔效应
A、A B、B C、C D、D3. 下列物质的性质与用途(或储存方法)都正确且有逻辑关系的是( )A、碱石灰具有吸水性,所以可用于干燥氯气 B、氯气具有强氧化性,所以可用湿润的氯气漂白红纸条 C、过氧化钠为碱性氧化物,所以可用于呼吸面具中吸收二氧化碳 D、钠有较强的还原性,所以可用于钛、锆、铌等金属的冶炼4. 下列说法正确的一组是( )①、MgO、均属于碱性氧化物
②已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离
③海水、空气、胆矾、盐酸均为混合物
④苏打、碱石灰、醋酸、小苏打均为电解质
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
A、①③⑤ B、②④⑤ C、②⑤ D、①②⑤5. 下列离子组在指定溶液中能大量共存的是( )A、无色透明的溶液中:、、、 B、碱性溶液中:、、、 C、含有大量的溶液中:、、、 D、遇紫色石蕊试液呈红色的溶液中:、、、6. 下列名为“泥三角”的仪器是( )A、 B、
B、 C、
C、 D、
D、 7. 某兴趣小组的同学向盛有一定体积的溶液的烧杯中逐渐通入气体,并测得所得的体系中导电能力随时间变化的曲线如图所示。下列说法正确的是( )
7. 某兴趣小组的同学向盛有一定体积的溶液的烧杯中逐渐通入气体,并测得所得的体系中导电能力随时间变化的曲线如图所示。下列说法正确的是( )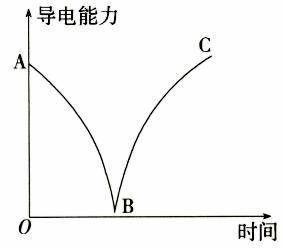 A、AB段溶液的导电能力不断减弱,说明生成的不是电解质 B、B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 C、BC段导电能力不断增强,原因是溶于水生成了电解质 D、AB段反应的离子方程式为:8. 下列物质的保存方法,与其化学性质无关的是( )A、浓盐酸需密闭保存 B、新制氯水密闭存放于棕色瓶中 C、钠保存在煤油中 D、过氧化钠需保持干燥密闭保存
A、AB段溶液的导电能力不断减弱,说明生成的不是电解质 B、B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 C、BC段导电能力不断增强,原因是溶于水生成了电解质 D、AB段反应的离子方程式为:8. 下列物质的保存方法,与其化学性质无关的是( )A、浓盐酸需密闭保存 B、新制氯水密闭存放于棕色瓶中 C、钠保存在煤油中 D、过氧化钠需保持干燥密闭保存二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确的给4分,但只要选错一个就得0分。
-
9. 下列说法正确的是( )A、在化学变化中,离子和原子都不可以再分 B、只含一种元素的物质可能是纯净物也可能是混合物 C、质子数、电子数、中子数分别相同的微粒一定是同一种微粒 D、只含X元素的阳离子和Y元素的阴离子的物质一定是纯净物10. 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平,方框里是
一种反应物):______________。
下列说法正确的是( )
A、的还原性强于 B、是氧化剂,是还原产物 C、酸性高锰酸钾溶液里的反应物为硫酸 D、4个生成时转移10个电子11. 下列有关钠和水反应的说法,错误的是( )A、属于氧化还原反应 B、属于放热反应 C、该反应可用于除去有机物中微量的水 D、不属于离子反应12. 如图所示,在A处通入未经干燥的氯气。当关闭B阀时,C处的红布条看不到明显的现象;当打开B阀后,C处的红布条逐渐褪色。则D瓶中盛放的物质可能是( )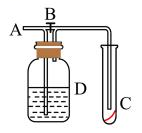 A、饱和NaCl溶液 B、NaOH溶液 C、 D、浓硫酸13. 稀的还原产物可以是NO、、、。在稀和Zn的反应中,Zn生成;若有10分子参加反应时有8电子转移,由此推断稀的还原产物可能为( )A、 B、NO C、 D、14. 下列离子方程式中,正确的是( )A、向澄清石灰水中通入过量: B、硫酸铜溶液中加入钠: C、氯化亚铁溶液中加入氯水: D、溶液中加入少量溶液:
A、饱和NaCl溶液 B、NaOH溶液 C、 D、浓硫酸13. 稀的还原产物可以是NO、、、。在稀和Zn的反应中,Zn生成;若有10分子参加反应时有8电子转移,由此推断稀的还原产物可能为( )A、 B、NO C、 D、14. 下列离子方程式中,正确的是( )A、向澄清石灰水中通入过量: B、硫酸铜溶液中加入钠: C、氯化亚铁溶液中加入氯水: D、溶液中加入少量溶液:三、非选择题:共5题,60分。
-
15. NaCl是一种化工原料,可以制备多种物质,如下图所示。其中,常温常压下X为黄绿色的气态单质。根据图示的转化关系填空:
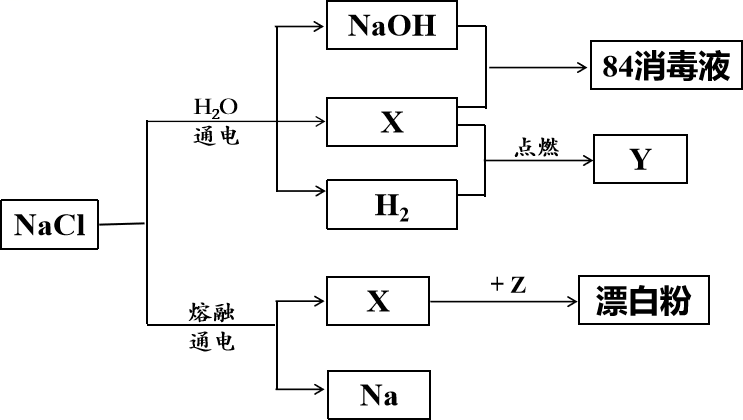 (1)、氯化钠溶液通电后,发生反应的化学方程式为: , 纯净的氢气在X中燃烧的现象为:。(2)、X通入NaOH溶液中可得84消毒液,请写出该反应的离子方程式;曾有报道,因“洁厕灵”(主要成分是盐酸)与“84”消毒液混合使用而发生中毒事件,请结合离子方程式分析其原因:。(3)、工业上通过X与Z反应获取漂白粉,漂白粉的有效成分是 , 若长期露置在空气中,其漂白作用会减弱甚至失效,其原因是(用化学方程式表示)。16. 某学习小组选择恰当的化学试剂和实验用品,用下图所示的装置(C中盛放的是过氧化钠)进行实验,证明过氧化钠可在呼吸面具和潜水艇中做供氧剂。
(1)、氯化钠溶液通电后,发生反应的化学方程式为: , 纯净的氢气在X中燃烧的现象为:。(2)、X通入NaOH溶液中可得84消毒液,请写出该反应的离子方程式;曾有报道,因“洁厕灵”(主要成分是盐酸)与“84”消毒液混合使用而发生中毒事件,请结合离子方程式分析其原因:。(3)、工业上通过X与Z反应获取漂白粉,漂白粉的有效成分是 , 若长期露置在空气中,其漂白作用会减弱甚至失效,其原因是(用化学方程式表示)。16. 某学习小组选择恰当的化学试剂和实验用品,用下图所示的装置(C中盛放的是过氧化钠)进行实验,证明过氧化钠可在呼吸面具和潜水艇中做供氧剂。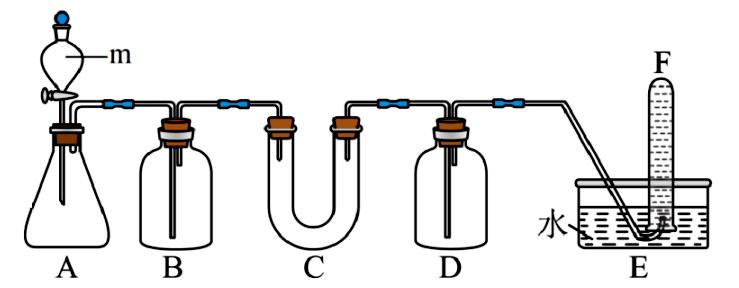 (1)、A是实验室中制取的装置,其中仪器m的名称是;A中发生反应的离子方程式:。(2)、B中盛装的试剂是溶液,其作用是;D中盛装的试剂为。(3)、写出C中发生反应的化学方程式。(4)、能证明“过氧化钠可在呼吸面具和潜水艇中做供氧剂”的实验现象有。
(1)、A是实验室中制取的装置,其中仪器m的名称是;A中发生反应的离子方程式:。(2)、B中盛装的试剂是溶液,其作用是;D中盛装的试剂为。(3)、写出C中发生反应的化学方程式。(4)、能证明“过氧化钠可在呼吸面具和潜水艇中做供氧剂”的实验现象有。A.C装置中的淡黄色固体变为白色
B.D装置中无明显现象
C.F中收集到无色气体,该气体可以使带火星的木条复燃
17. 请阅读下列资料,回答问题。(1)、18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。该反应的化学方程式为 , 某同学拟用该原理按如下装置制备并收集纯净的氯气:在虚线框内选用的发生装置是(填“甲”“乙”或“丙”),试剂X是。 (2)、通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是 , 请在下图2中画出氧气的体积随时间变化的趋势图:
(2)、通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是 , 请在下图2中画出氧气的体积随时间变化的趋势图:

图1 图2
(3)、使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠()溶液可制备新的绿色消毒剂二氧化氯(),反应中还可得到氯化钠。该反应的化学方程式为。18. 工业粗盐中含有、、等杂质离子。某厂将工业粗盐提纯后采用“侯氏制碱法”生产纯碱和化肥 , 其工艺流程如下图所示: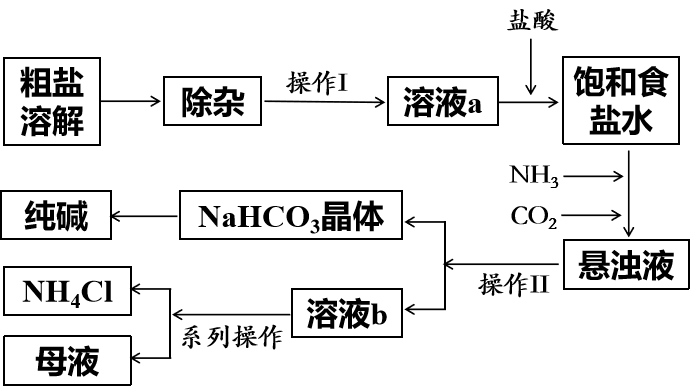
请回答下列问题:
(1)、除杂需要加入过量的除杂试剂。上述流程图中“除杂”步骤中可依次加入过量的NaOH、、(填化学式);操作Ⅰ的名称是。(2)、写出“溶液a”中加入盐酸发生反应的离子方程式;写出由晶体获取纯碱的化学方程式。(3)、“溶液b”中除和外,还含有的离子主要有。(4)、上述工艺流程中可循环利用的物质有。19. 为探究盐酸的化学性质,某化学小组做了如下实验: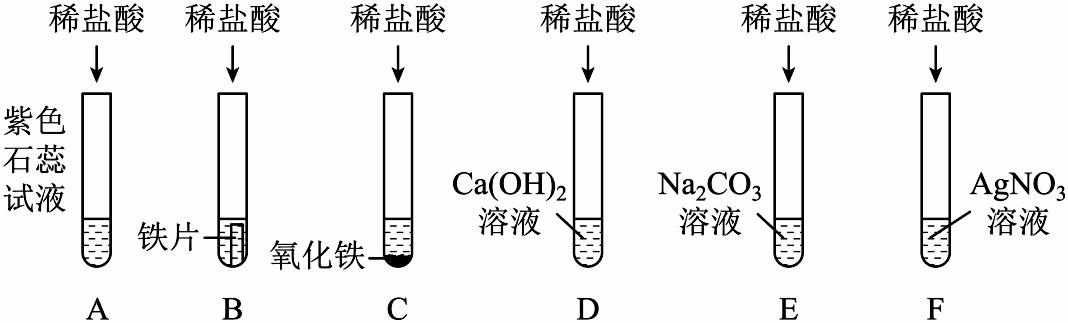 (1)、下列编号为A~F的反应中,无论稀盐酸过量还是少量均无明显现象的是(填字母编号),C中所发生反应的离子方程式为。(2)、G是向稀盐酸中逐滴加入一定量溶液(见图),充分反应。将G中所得溶液、上题D中所得溶液倒入一个洁净的烧杯H中,观察到烧杯中先有气泡产生,且有白色沉淀出现。
(1)、下列编号为A~F的反应中,无论稀盐酸过量还是少量均无明显现象的是(填字母编号),C中所发生反应的离子方程式为。(2)、G是向稀盐酸中逐滴加入一定量溶液(见图),充分反应。将G中所得溶液、上题D中所得溶液倒入一个洁净的烧杯H中,观察到烧杯中先有气泡产生,且有白色沉淀出现。
①倒入烧杯前D试管中的溶质是。
②D、G试管中反应后的溶液的混合于烧杯H时,“白色沉淀出现”的离子方程式。
(3)、将烧杯H中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。【提出问题】滤液中溶质的主要成分是什么?
【假设与猜想】猜想Ⅰ:NaCl;
猜想Ⅱ:NaCl和;
猜想Ⅲ:。
(4)、【实验与结论】实验步骤
实验现象
实验结论
取少量滤液于试管中,滴加适量碳酸钠溶液
无现象
猜想成立
(填“Ⅰ”“Ⅱ”或“Ⅲ”)
取少量滤液于试管中,滴加足量(填试剂)
有气泡冒出