河南省濮阳市2023-2024学年高二上学期11月期中学业质量检测化学试卷
试卷更新日期:2024-04-03 类型:期中考试
一、单选题
-
1. 化学与生产、生活密切相关,下列说法正确的是( )A、直接加热蒸干纯碱的水溶液无法得到纯碱固体 B、冬季空气中的水蒸气凝结成冰霜的过程是自发的,该过程的熵减小 C、草木灰和铵态氮肥混合施用,可促进植物对化肥的吸收和综合利用 D、工业合成氨选用的温度越低越好,压强越大越好2. 在相同条件下,质量相等的两份氢气和足量的氧气充分反应,分别生成液态水(反应①)和水蒸气(反应②)。下列说法正确的是( )A、反应①放出的热量多 B、反应②放出的热量多 C、反应①、②放出的热量一样多 D、无法比较反应①、②放出的热量3. 下列对化学反应速率增大原因的分析错误的是( )A、对于反应 , 增大压强使容器容积减小,单位体积内活化分子数增多 B、合成氨反应中加入适宜的催化剂,使反应物分子中活化分子百分数增大 C、高炉炼铁发生反应 , 升高温度,使反应物活化分子百分数增大 D、向反应体系中加入相同浓度的反应物,使活化分子百分数增大4. 在一定温度下的密闭容器中发生反应: , 平衡时测得X的浓度为 , 保持温度不变,将容器的容积扩大为原来的3倍,再次达平衡时,测得X的浓度为 , 下列有关判断正确的是( )A、 B、平衡向正反应方向移动 C、Y的转化率升高 D、Z的体积分数增大5. 向中分别加入10mL蒸馏水和 , 下列说法中错误的是( )A、加入蒸馏水后,溶液中的数目增大 B、加入蒸馏水后,溶液中减小 C、加入HCl后,溶液中减小 D、加入HCl后,溶液中6. 在下列溶液中,有关说法错误的是( )A、在30℃,测定某种酱油的 , 则该酱油中的 B、在常温下,某柠檬水的 , 其中的 C、体积相同、pH相同的和HF分别与NaOH溶液恰好中和时,前者消耗NaOH的物质的量较多 D、在常温下,的溶液中,由水电离出来的7. 下列装置的有关说法正确的是( )
 A、装置Ⅰ可验证与稀盐酸反应为吸热反应 B、装置Ⅰ可用于测定醋酸的浓度 C、装置Ⅲ可制备固体 D、装置Ⅳ可用于测定锌与稀硫酸反应生成氢气的速率8. 在酸催化作用下,丙烯水化法合成2-丙醇的反应历程如图所示。下列说法正确的是( )
A、装置Ⅰ可验证与稀盐酸反应为吸热反应 B、装置Ⅰ可用于测定醋酸的浓度 C、装置Ⅲ可制备固体 D、装置Ⅳ可用于测定锌与稀硫酸反应生成氢气的速率8. 在酸催化作用下,丙烯水化法合成2-丙醇的反应历程如图所示。下列说法正确的是( )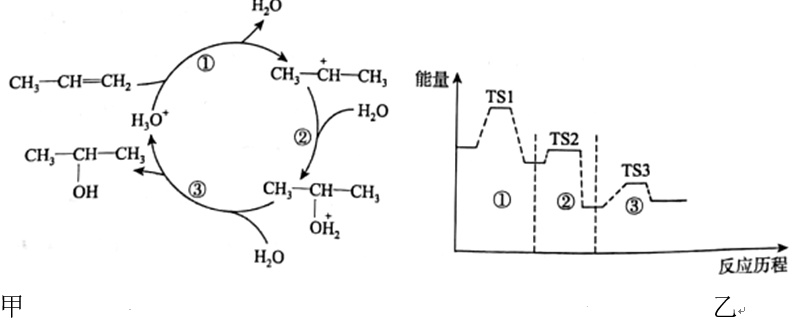 A、总反应的活化能等于各步反应活化能之和 B、步骤③是该反应的决速步骤 C、丙烯水化法合成2-丙醇反应的 D、升高温度可以同时加快步骤①②③的反应速率9. 现进行实验:
A、总反应的活化能等于各步反应活化能之和 B、步骤③是该反应的决速步骤 C、丙烯水化法合成2-丙醇反应的 D、升高温度可以同时加快步骤①②③的反应速率9. 现进行实验:将溶液和溶液等体积混合,得到悬浊液a;将悬浊液a过滤,得到滤液b和白色沉淀c。
向滤液b中滴加溶液,滤液出现浑浊。
向沉淀c中滴加溶液,沉淀变为黄色。
下列关于上述实验的分析错误的是( )
A、悬浊液a中存在沉淀溶解平衡: B、滤液b中不含 C、实验(3)表明转化为 D、实验可以证明10. 下列说法中正确的是( )A、10℃时,pH约为7.5的纯水呈碱性 B、常温下,当水电离出的为时,此溶液可能为溶液或溶液 C、常温下,的NaClO溶液稀释至1000mL,所得溶液的pH为6 D、常温下,将的NaCN和NaOH各1mL分别特释至100mL,所得NaCN溶液的pH大11. 氮氧化物的治理对大气环境的净化有着重要的意义,某化学兴趣小组查阅资料,乙烯酮自由基(HCCO)与在不同催化剂上反应历程如图所示。
下列叙述错误的是( )
A、选择合适催化剂能够加快反应速率,提高NO平衡产率 B、反应途径①比②更易发生 C、按上述反应过程生成1molNO,放热34.78kJ D、该反应的总方程式为12. 下列关于实验现象的解释或所得结论正确的是( )选项
实验操作
现象
解释或结论
A
向某无色溶液中滴加盐酸酸化的溶液
产生白色沉淀
该无色溶液中含有
B
用pH计分别测定相同浓度的和NaCl溶液的pH
溶液的pH较大
Cl的非金属性强于S
C
加水稀释溶液
由橙色变为黄色
, 增大体系中反应物的量,平衡正向移动
D
向含等浓度的和的混合溶液中加入少量NaOH溶液
产生蓝色沉淀
A、A B、B C、C D、D13. 已知反应:。测得在和时,在2L恒容密闭容器中充入3molX和足量的Y发生反应,X的浓度随反应时间的变化曲线如图所示。下列说法错误的是( )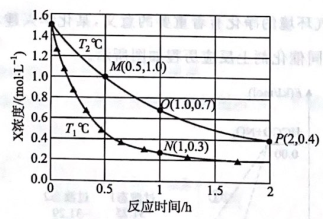 A、M、N、P、O四点的逆反应速率大小关系: B、时,用Z表示0~1h的平均反应速率为 C、P点不可能处于化学平衡状态 D、条件下,若在O点时再充入1.0molX,与原投料相比,X的平衡转化率增大14. 25℃时,某混合溶液中 , 、、和随pH变化的关系如图所示,为HCN的电离常数,下列说法错误的是( )
A、M、N、P、O四点的逆反应速率大小关系: B、时,用Z表示0~1h的平均反应速率为 C、P点不可能处于化学平衡状态 D、条件下,若在O点时再充入1.0molX,与原投料相比,X的平衡转化率增大14. 25℃时,某混合溶液中 , 、、和随pH变化的关系如图所示,为HCN的电离常数,下列说法错误的是( ) A、N点时, B、点过程中,水的电离程度逐渐增大 C、P点时,若溶液为HCN与NaCN的混合溶液,则此时 D、该溶液中,
A、N点时, B、点过程中,水的电离程度逐渐增大 C、P点时,若溶液为HCN与NaCN的混合溶液,则此时 D、该溶液中,二、实验题
-
15. 熟石灰、草酸氢钠和草酸钙均是生活中常见的化合物,广泛应用于工业生产中。查阅资料得到如下数据信息。
物质
或
25℃时
100℃时
25℃时
25℃时
25℃时
回答下列问题:
Ⅰ.25℃时,草酸氢钠与或反应的探究实验。
实验ⅰ:往溶液中滴加饱和溶液,产生白色沉淀。
实验ⅱ:往溶液中滴加溶液,产生白色沉淀。
已知:溶液混合后,溶液体积和温度变化忽略不计。
(1)、25℃时,溶液的pH7(填“>”“=”或“<”)。(2)、25℃时,和浓度均为的混合溶液中,各离子浓度由大到小的顺序为。(3)、实验ⅰ发生反应的离子方程式为。(4)、实验ⅱ随着溶液的加入,溶液中将(填“增大”“减小”或“不变”)。(5)、实验ⅱ中滴加溶液的体积时,溶液中。(6)、Ⅱ.不同温度下电导率的探究实验。①查阅资料
电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大:离子浓度一定时,稀溶液电导率随温度的升高面增大。
②设计实验、分析实验数据
取试样a、b、c[不同温度下配制的饱和溶液],在设定的测试温度下,进行表中实验ⅲ~ⅴ,记录数据。
实验数据表
实验序号
试样
测试温度/℃
电导率/()
ⅲ
a:25℃的饱和溶液
25
ⅳ
b:35℃的饱和溶液
35
ⅴ
c:45℃的饱和溶液
45
③数据分析,交流讨论
25℃的饱和溶液的(已知:)。
(7)、实验结果为 , 推测的原因为。三、填空题
-
16. 亚磷酸()为二元弱酸,是工业上生产农药草甘膦的主要原料,某化学小组利用氧化还原滴定法测定亚磷酸工业品的纯度。
实验步骤如下:
①配制样品溶液:精确称取1.0g样品,用蒸馏水溶解并定容到100mL容量瓶中得到样品溶液。
②滴定实验:取10.00mL样品溶液,加入酸性溶液(溶液过量),放置10min充分反应后,加入足量的KI,摇匀,在暗处放置5min。以淀粉作指示剂,用标准溶液滴定至终点,消耗溶液。
③空白实验:取溶液,加入足量的KI,摇匀,在暗处放置5min,以淀粉作指示剂,用标准溶液滴定至终点,消耗溶液。
已知:;
回答下列问题:
(1)、量取10.00mL亚磷酸样品溶液所用的仪器为(填仪器名称)。(2)、亚磷酸()与足量的NaOH溶液反应生成正盐的离子方程式为(3)、亚磷酸具有还原性,可被酸性溶液氧化为磷酸,锰元素转化为 , 请写出该反应的离子方程式:。(4)、步骤①中用不到的仪器有(填标号),还需要用到的硅酸盐仪器有。 (5)、滴定管在使用前需要 , 洗涤、润洗:滴定终点时溶液颜色的变化为。(6)、该样品中亚磷酸的含量为%(用含、的式子表示)。(7)、若空白实验过程中,量取溶液时,未润洗酸式滴定管,则所测得的样品中亚磷酸的含量将(填“偏高”“偏低”或“无影响”)。17. 从某废铁铬催化剂(含、、、及)中回收铁、铬的工艺流程如图所示:
(5)、滴定管在使用前需要 , 洗涤、润洗:滴定终点时溶液颜色的变化为。(6)、该样品中亚磷酸的含量为%(用含、的式子表示)。(7)、若空白实验过程中,量取溶液时,未润洗酸式滴定管,则所测得的样品中亚磷酸的含量将(填“偏高”“偏低”或“无影响”)。17. 从某废铁铬催化剂(含、、、及)中回收铁、铬的工艺流程如图所示:
已知ⅰ.25℃时,溶液中金属离子开始形成氢氧化物沉淀与刚好沉淀完全的pH如表:
金属离子
开始沉淀的pH
1.5
3.8
4.6
7.6
9.5
刚好沉淀完全的pH
2.8
4.7
6.8
9.7
11.1
ⅱ.已知Cr的金属性强于Fe。
回答下列问题:
(1)、废铁铬催化剂在“酸浸”前,送入球磨机进行粉碎,粉碎的目的是。(2)、“还原”步骤的目的为。(3)、调节的范围为。(4)、“氧化”步骤发生反应的离子方程式为。(5)、试剂X最适宜选用的试剂为____(填序号)。A、MgO B、稀 C、CaO(6)、“隔绝空气焙烧”步骤发生反应的化学方程式为;实际生产过程中还要加入适量CaO,其目的是。(7)、由滤液2得到结晶水合物的操作是、过滤、洗涤、干燥。(8)、滤液3中的铝元素恰好完全转化为沉淀的pH为(通常认为溶液中离子浓度小于为沉淀完全:;;)。18. 通过“—合成气—高附加值产品”的工艺路线,可有效实现的资源化利用。和合成甲醇的过程中会发生如下两个反应:Ⅰ:
Ⅱ:
下表是几种物质的标准生成热(由对应稳定单质生成1mol某种物质的焓变叫做该物质的标准生成热)。
物质
标准生成热
-393.5
-241.8
-201.2
0.0
回答下列问题:
(1)、反应Ⅰ的焓变。(2)、若在某绝热恒容容器中仅发生反应Ⅱ,则下列事实能说明反应达到平衡状态的是____(填序号)。A、容器内气体的压强不变 B、容器内温度不变 C、容器内气体的密度不再改变 D、容器内气体的平均相对分子质量不变(3)、已知反应Ⅱ的正反应速率 , 逆反应速率 , 、分别为正、逆反应的速率常数,(k表示或)与温度的关系如图甲所示,其中直线a、b分别表示、随温度的变化。则升高温度,反应Ⅱ的平衡常数K(填“变大”“变小”或“不变”)。(4)、在图甲A点对应的温度下,向某刚性密闭容器中按充入和 , 同时发生反应Ⅰ和反应Ⅱ,已知起始时容器内压强为90kPa,10分钟后体系达到平衡状态,容器内压强变为70kPa。①平衡时反应Ⅰ的平衡常数(用平衡分压表示平衡常数);平衡时氢气的转化率为。
②进一步提高氯气平衡转化率的方法有(写两种不同的方法),
(5)、电催化还原的方法具有催化效率更高、反应条件更温和的优点,在Au纳米颗粒表面电还原的进程如图乙所示,据此判断该过程的决速步骤为(填“a”“b”或“e”)。
-