河南省顶级实验中学2023-2024学年高三上学期期中考试化学试题
试卷更新日期:2024-04-03 类型:期中考试
一、选择题:(每小题3分,16小题,共48分,每小题只有一个选项符合题意)
-
1. 下列叙述中,错误的是( )A、固体氯化钠不能导电,但氯化钠是电解质 B、纯水的pH值随温度的升高而降低 C、pH= (为水的离子积常数)的溶液一定呈中性 D、用大量水稀释溶液,溶液中所有离子浓度都要减小2. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、标准状况下,2.24LCl2通入足量的水充分反应,溶液中N(Cl-)+N(HClO)+N(ClO-)的数目和为0.2NA B、反应N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol,若放出热量46.2kJ,则转移的电子数目为3NA C、常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-5NA D、将0.2 mol NH4Cl固体溶于一定量稀氨水,所得溶液呈碱性,则溶液中含数目大于0.2NA3. 下列指定反应的离子方程式错误的是( )A、向氢氧化镁悬浊液中加氯化铵溶液,加热沉淀溶解: B、用Na2CO3溶液处理水垢中的CaSO4: C、Na2SO3溶液吸收少量Cl2: D、Mg(HCO3)2溶液与过量NaOH溶液反应:4. 如图是硫酸试剂瓶标签上的部分内容。下列说法正确的是( )
 A、该硫酸的物质的量浓度为9.2mol·L-1 B、该硫酸与等体积的水混合所得溶液的质量分数小于49% C、配制250mL 4.6mol·L-1的稀硫酸需取该硫酸62.5 mL D、用该硫酸配置250mL 4.6mol·L-1的稀硫酸,若量取该硫酸时仰视,则所配稀硫酸浓度偏小5. 下列各组离子在指定溶液中可能大量共存的是( )A、中性溶液中:Fe3+、Al3+、、 B、lg=1010的溶液中:Na+、K+、CH3COO-、ClO- C、常温下由水电离出的c(H+)=10-13mol/L的溶液中:K+、Na+、、[Al(OH)4]- D、加入铝粉会产生H2的溶液中:Cu2+、Mg2+、、Cl-6. 以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是( )
A、该硫酸的物质的量浓度为9.2mol·L-1 B、该硫酸与等体积的水混合所得溶液的质量分数小于49% C、配制250mL 4.6mol·L-1的稀硫酸需取该硫酸62.5 mL D、用该硫酸配置250mL 4.6mol·L-1的稀硫酸,若量取该硫酸时仰视,则所配稀硫酸浓度偏小5. 下列各组离子在指定溶液中可能大量共存的是( )A、中性溶液中:Fe3+、Al3+、、 B、lg=1010的溶液中:Na+、K+、CH3COO-、ClO- C、常温下由水电离出的c(H+)=10-13mol/L的溶液中:K+、Na+、、[Al(OH)4]- D、加入铝粉会产生H2的溶液中:Cu2+、Mg2+、、Cl-6. 以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是( ) A、反应1中,每生成1molClO2有0.5molSO2被氧化 B、从母液中可以提取Na2SO4 C、反应2中,氧化剂与还原剂的物质的量之比为1∶2 D、采用减压蒸发可能是为了防止NaClO2受热分解7. 下列实验方案设计正确的是( )
A、反应1中,每生成1molClO2有0.5molSO2被氧化 B、从母液中可以提取Na2SO4 C、反应2中,氧化剂与还原剂的物质的量之比为1∶2 D、采用减压蒸发可能是为了防止NaClO2受热分解7. 下列实验方案设计正确的是( )选项
实验目的
实验方案
A
测定NaClO溶液的pH
取一张 pH 试纸放在表面皿上,用洁净的玻璃棒蘸取待测液滴于试纸的中部,与标准比色卡对比
B
探究浓度大小对反应速率的影响
取等体积不同浓度的KMnO4溶液,分别加入等体积等浓度的H2C2O4溶液,观察褪色的快慢
C
检验CH3CH2Br 中的溴原子
取少量CH3CH2Br与NaOH 水溶液共热,冷却,再加AgNO3溶液,观察产生沉淀的颜色
D
探究KI与FeCl3反应的限度
取5mL 0.1mol/L KI溶液于试管中,加入1mL 0.1 mol/L FeCl3溶液,充分反应后再加KSCN溶液,观察现象
A、A B、B C、C D、D8. MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):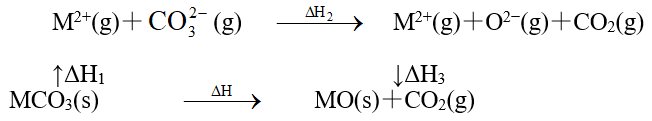
下列说法错误的是( )
A、ΔH1(MgCO3)>ΔH1(CaCO3)>0 B、ΔH2(MgCO3)=ΔH2(CaCO3)>0 C、ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) D、ΔH1+ΔH2>ΔH39. 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )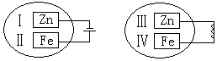 A、Ⅰ和Ⅲ附近 B、Ⅱ和Ⅲ附近 C、Ⅰ和Ⅳ附近 D、Ⅱ和Ⅳ附近10. 除去括号内杂质所用试剂和方法均正确的是( )
A、Ⅰ和Ⅲ附近 B、Ⅱ和Ⅲ附近 C、Ⅰ和Ⅳ附近 D、Ⅱ和Ⅳ附近10. 除去括号内杂质所用试剂和方法均正确的是( )选项
物质
所用试剂
方法
A
乙醇(水)
新制生石灰
蒸馏
B
甲烷(乙烯)
酸性高锰酸钾溶液
洗气
C
乙酸乙酯(乙酸)
氢氧化钠溶液
分液
D
饱和碳酸钠溶液
过滤
A、A B、B C、C D、D11. 利用传感技术可探究压强对2NO2(g) N2O4(g)化学平衡移动的影响。往注射器中充入适量NO2气体如图甲所示;再分别在t1、t2时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是( )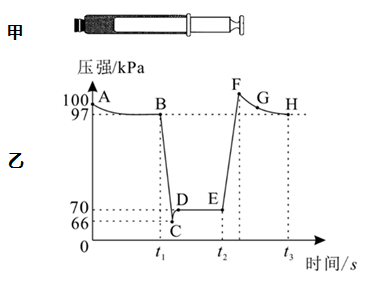 A、在B、E两点,对应的正反应速率: B、C到D点,平衡逆向移动,针筒内气体颜色比点深 C、在E,F,H三点中,H点的气体平均相对分子质量最大 D、B点处NO2的转化率为6%12. 利用无机物离子[(L)RuⅢ(H2O)]5-和CeⅣ , 实现了利用水制氧气。用H218O进行同位素标记实验,证明了产物氧气中的氧原子完全来自水,其相关机理如图所示。下列说法错误的是( )
A、在B、E两点,对应的正反应速率: B、C到D点,平衡逆向移动,针筒内气体颜色比点深 C、在E,F,H三点中,H点的气体平均相对分子质量最大 D、B点处NO2的转化率为6%12. 利用无机物离子[(L)RuⅢ(H2O)]5-和CeⅣ , 实现了利用水制氧气。用H218O进行同位素标记实验,证明了产物氧气中的氧原子完全来自水,其相关机理如图所示。下列说法错误的是( )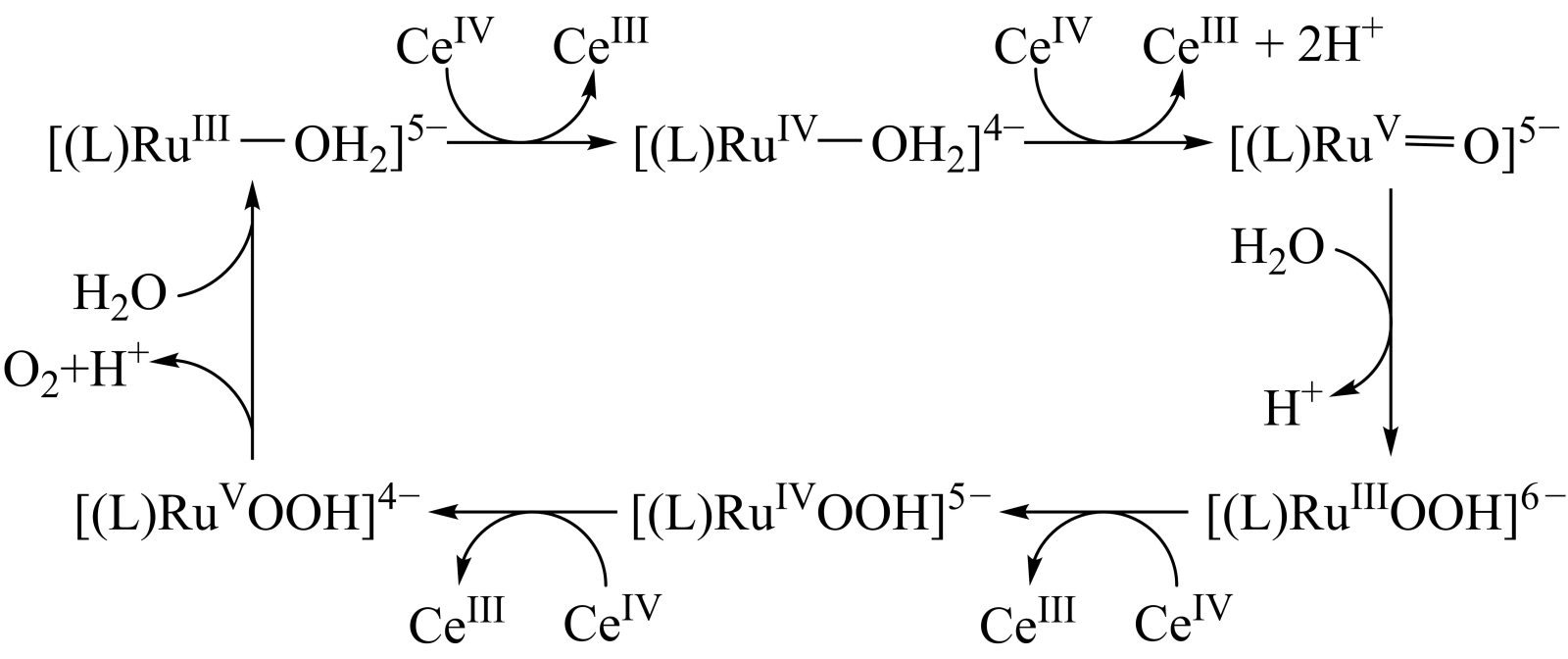 A、CeⅣ在反应中作氧化剂 B、催化氧化水的反应为2H2O O2↑+2H2↑ C、进行同位素标记实验前需排尽体系中的空气 D、若H218O参与反应,则[(L)RuⅢOOH]6-中存在18O13. 图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法错误的是( )
A、CeⅣ在反应中作氧化剂 B、催化氧化水的反应为2H2O O2↑+2H2↑ C、进行同位素标记实验前需排尽体系中的空气 D、若H218O参与反应,则[(L)RuⅢOOH]6-中存在18O13. 图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法错误的是( )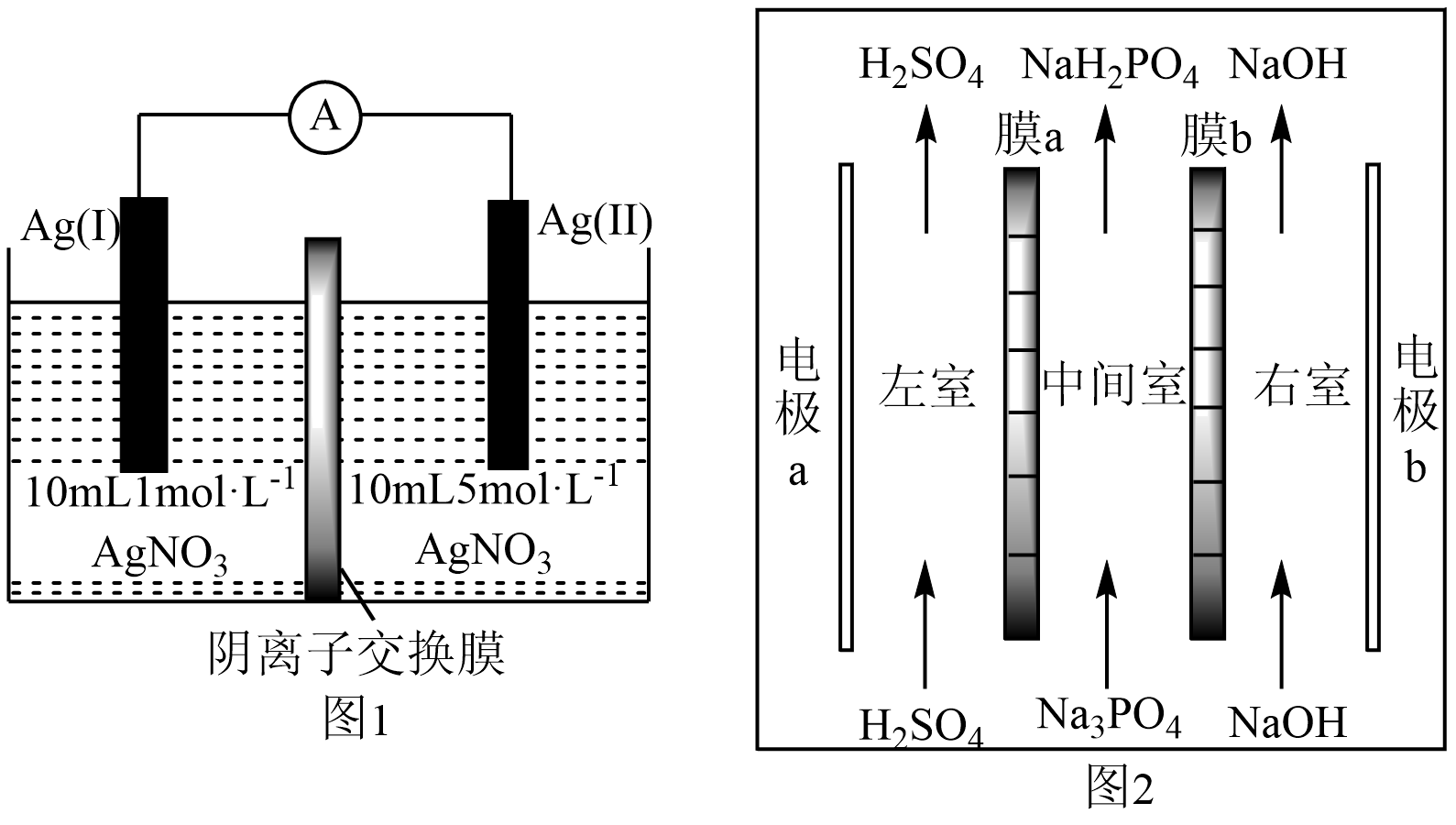 A、电极a应与Ag(II)相连 B、电渗析装置中膜b为阳离子交换膜 C、电渗析过程中左、右室中H2SO4和NaOH的浓度均增大 D、电池从开始到停止放电,理论上可制备2.4gNaH2PO414. 有研究认为,强碱性环境下反应:I-+ClO-IO-+Cl-可能分如下三步进行:
A、电极a应与Ag(II)相连 B、电渗析装置中膜b为阳离子交换膜 C、电渗析过程中左、右室中H2SO4和NaOH的浓度均增大 D、电池从开始到停止放电,理论上可制备2.4gNaH2PO414. 有研究认为,强碱性环境下反应:I-+ClO-IO-+Cl-可能分如下三步进行:第一步:ClO-+H2OHClO+OH- K1=3.3×10-10
第二步:…… K2=……
第三步:HIO+OH-IO-+H2O K3=2.3×103
下列说法正确的是( )
A、第二步反应的平衡常数表达式为K2= B、由K值大小可以判断第三步反应比第一步快 C、升高温度会使K1变小、K3变大 D、OH-是该反应的催化剂15. 可逆反应A(g)+xB(g)2C(g) 达平衡后,只改变反应的一个条件,测得容器中部分物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是( )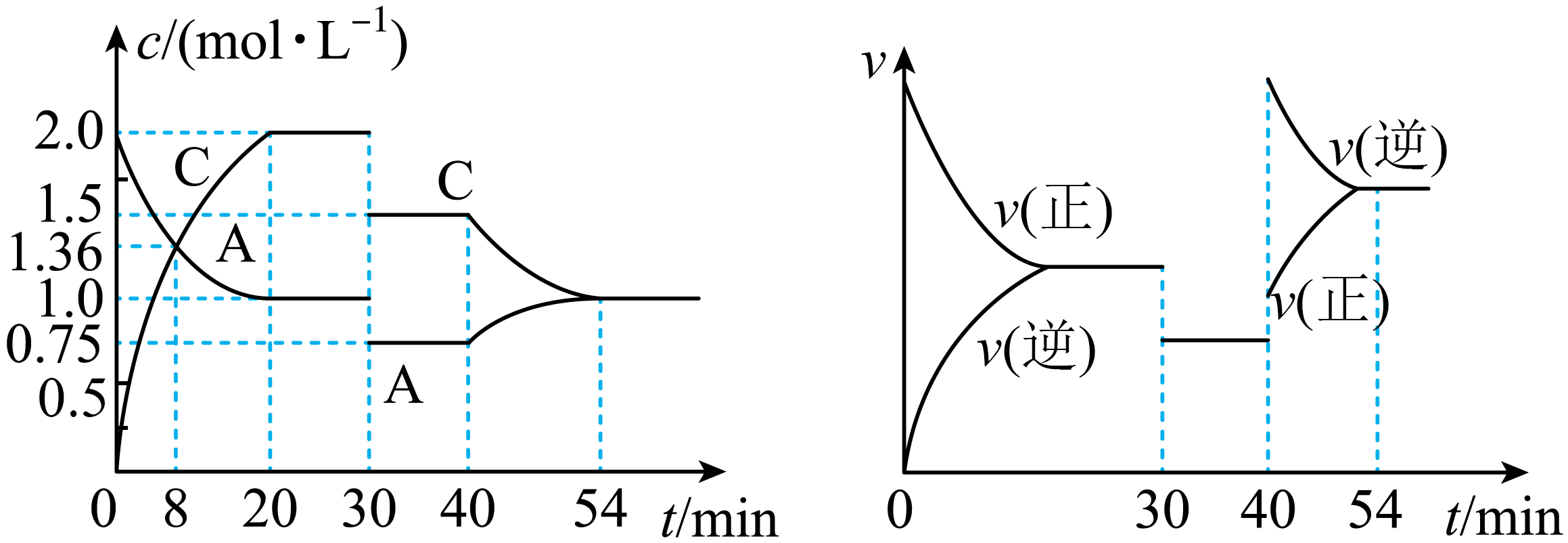 A、8min时反应达到平衡状态 B、该反应正反应为吸热反应 C、x=1 D、30min~40min间使用了催化剂16. 常温下,均为2、体积均为的溶液,分别加水稀释至体积为 , 溶液随的变化关系如图所示,下列叙述错误的是( )
A、8min时反应达到平衡状态 B、该反应正反应为吸热反应 C、x=1 D、30min~40min间使用了催化剂16. 常温下,均为2、体积均为的溶液,分别加水稀释至体积为 , 溶液随的变化关系如图所示,下列叙述错误的是( )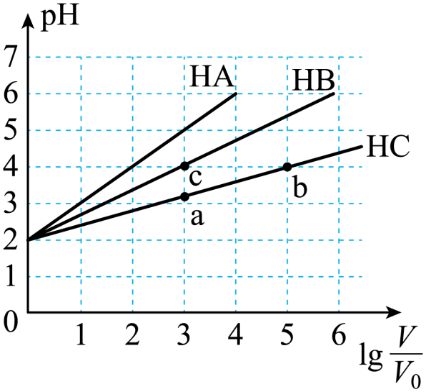 A、常温下:Ka(HB) > Ka(HC) B、的电离度:a点< b点 C、当时,升高温度,减小 D、恰好中和均为2、体积均为V0的三种酸溶液,消耗的NaOH溶液一样多
A、常温下:Ka(HB) > Ka(HC) B、的电离度:a点< b点 C、当时,升高温度,减小 D、恰好中和均为2、体积均为V0的三种酸溶液,消耗的NaOH溶液一样多二、非选择题(5个小题,共52分)
-
17. 磷化氢(PH3)是粮食储备常用的高效熏蒸杀虫剂。(1)、AlP遇水发生复分解反应生成PH3气体和(填化学式)。(2)、PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:。
□CuSO4+□PH3+□H2O = □Cu3P↓+□H3PO4+□H2SO4
(3)、工业制备PH3的原理如图所示:
①白磷和烧碱溶液反应的化学方程式为。
②从分类来看,NaH2PO2属于。
A.正盐B.酸式盐C.强电解质D.弱电解质
③NaH2PO2可将溶液中的Ag+还原为银,从而用于化学镀银。已知利用此原理进行化学镀银时氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为 (填化学式)。
18. 12.5g CuSO4﹒5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。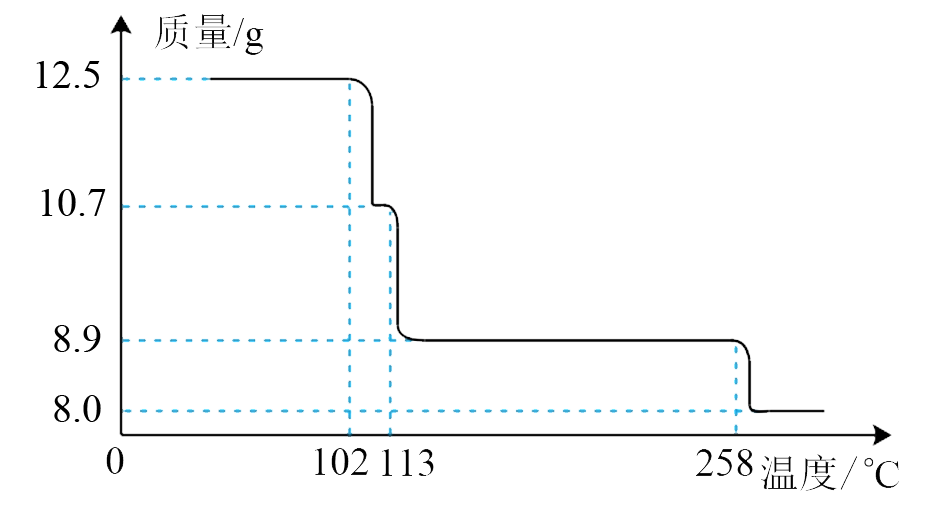
请回答下列问题:
(1)、试确定200℃时固体物质的化学式。(2)、取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有蓝色晶体析出,该晶体的化学式为 , 其存在的最高温度是。(3)、若在0.05mol·L-1硫酸铜溶液中通入足量 H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的pH值约为。19. 硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下: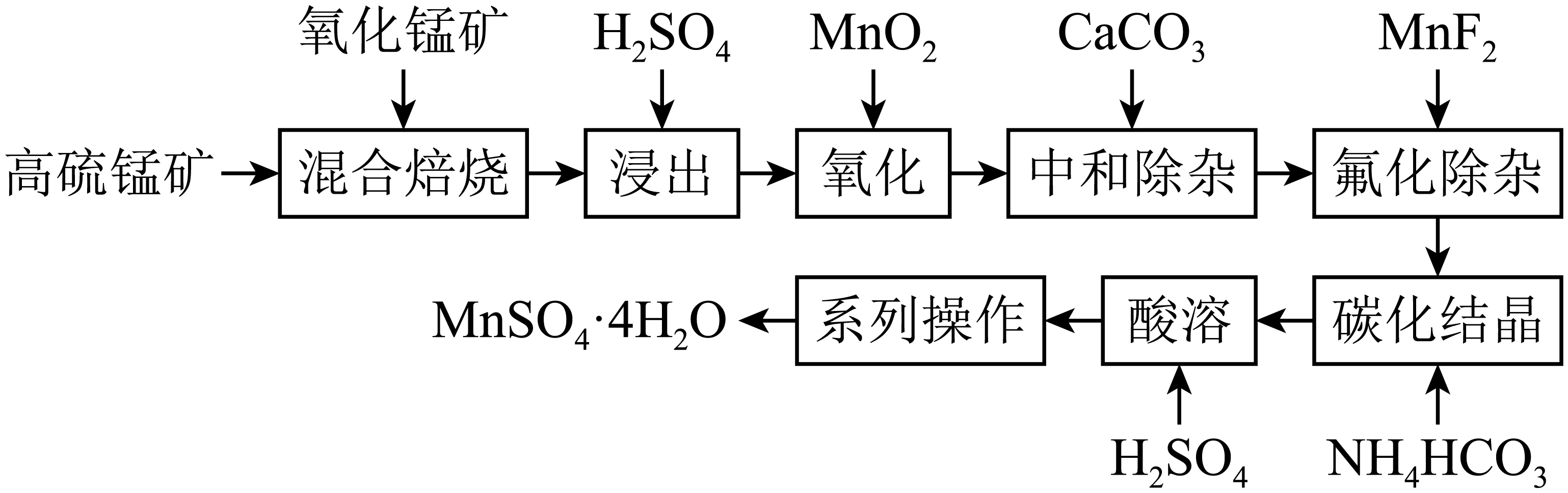
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO
② Ksp(MgF2)=6.4×10-10(mol/L)3;Ksp(CaF2)=3.6×10-12(mol/L)3
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答:
(1)、“氧化”时,发生反应的离子方程式为。(2)、“中和除杂”时,生成沉淀的主要成分为(填化学式)。(3)、“氟化除杂”时,使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于 mol/L。(4)、“碳化结晶”时,发生反应的离子方程式为。(5)、用惰性电极电解MnSO4溶液可制备MnO2 , 电解过程中阳极的电极反应式为。20. CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。(1)、I.可利用CH4与CO2制备合成气(CO、H2),在某一刚性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。研究表明CO的生成速率ν(CO)=1.28×10-2p(CH4)·p(CO2) (kPa·s-1),某时刻测得p(H2)=10kPa,则该时刻v(CH4)=kPa·s-1。(2)、达到平衡后,测得CO的产率为50%,则该反应的平衡常数Kp=。(3)、科学家提出制备“合成气反应历程分两步:反应①:CH4(g) C(ads) + 2H2(g) (慢反应),反应②:C(ads) + CO2(g) 2CO(g) (快反应),上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:CH4与CO2制备合成气的热化学方程式为 , 能量变化图中:E5+E1E4+E2(填“>”、“<”或“=”)。 (4)、II.利用CO2催化加氢制甲醇,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2 , 发生以下反应:
(4)、II.利用CO2催化加氢制甲醇,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2 , 发生以下反应:①CO2(g)+3H2(g) CH3OH (g)+H2O(g) ΔH1= -49.4kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
③CO(g)+2H2(g)CH3OH(g) ΔH3= -90.6kJ/mol
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
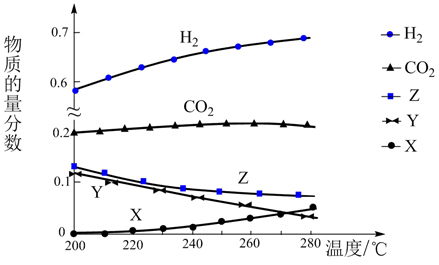
①体系中CO2的物质的量分数受温度的影响不大,原因是。
②如上图X、Y分别代表、(填化学式)。
21. 摩尔盐 (NH4)2Fe(SO4)2·6H2O是一种常见的复盐。以下是摩尔盐的制备流程。请回答相关问题。 (1)、步骤1中Na2CO3溶液的作用。(2)、抽滤装置如图所示。和普通过滤相比,抽滤的优点是。
(1)、步骤1中Na2CO3溶液的作用。(2)、抽滤装置如图所示。和普通过滤相比,抽滤的优点是。 (3)、步骤3中生成摩尔盐的反应方程式为。(4)、Fe3+含量是影响产品品质的关键指标。定量测定方法是:取1.00g产品于烧杯中,加入适量盐酸溶解,并加入3滴KSCN溶液,定容至50mL。取溶液置于比色管中,与标准色阶进行目视比色,确定产品级别。可以根据颜色确定产品级别的原理是。(5)、取30.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在250mL容量瓶中定容。取25.00mL于锥形瓶中,用0.1mol·L-1的KMnO4溶液滴定至终点。平行操作三次,消耗KMnO4溶液的平均体积为16.00mL。此样品中Fe2+含量为%(保留三位有效数字)。
(3)、步骤3中生成摩尔盐的反应方程式为。(4)、Fe3+含量是影响产品品质的关键指标。定量测定方法是:取1.00g产品于烧杯中,加入适量盐酸溶解,并加入3滴KSCN溶液,定容至50mL。取溶液置于比色管中,与标准色阶进行目视比色,确定产品级别。可以根据颜色确定产品级别的原理是。(5)、取30.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在250mL容量瓶中定容。取25.00mL于锥形瓶中,用0.1mol·L-1的KMnO4溶液滴定至终点。平行操作三次,消耗KMnO4溶液的平均体积为16.00mL。此样品中Fe2+含量为%(保留三位有效数字)。