山东省青岛市莱西市2023-2024学年高一上学期11月期中考试化学试卷
试卷更新日期:2024-04-03 类型:期中考试
一、本题共10小题,每小题2分,共20分。在每小题列出的四个选项中,只有一项符合题目要求。
-
1. 下列有关“绿色化学”或“绿色食品”的描述正确的是( )A、贴有“绿色”防伪标志的食品属于“绿色食品” B、“绿色化学”的核心是利用化学原理对环境污染进行治理 C、“绿色化学”中的“3R”原则(减量化、再利用和再循环)是开发和利用自然资源的基本原则 D、植物秸秆含大量钾元素,焚烧后作钾肥符合“绿色化学”的思想2. 化学与生活密切相关,下列说法错误的是( )A、因铝有强还原性,可用于制作门窗框架 B、因氧化钙易吸水,可用作干燥剂 C、核酸检测是判断是否感染新冠病毒的手段之一 D、豆浆能产生丁达尔效应是由于胶体粒子对光线的散射3. 能够在人体血管中通行的药物分子运输车-“纳米药物分子运输车”在中国科学院上海硅酸盐研究所研制成功,该“运输车”可提高肿瘤的治疗效果,其结构如图所示。下列有关说法正确的是( )
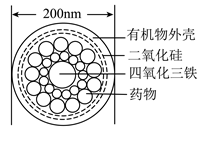 A、该“运输车”中四氧化三铁是碱性氧化物 B、该“运输车”的外壳一定含有碳元素 C、该“运输车”分散于水中所得的分散系属于胶体 D、二氧化硅不属于酸性氧化物4. 为阿伏加德罗常数的值,下列说法正确的是( )A、12g中含有0.2个阳离子 B、1.7g中含有氧原子数为0.2 C、标准状况下,22.4L中,含有H原子数目大于2 D、标准状况下,11.2L通入水中,溶液中氯离子数为0.55. 下列说法中正确的是( )
A、该“运输车”中四氧化三铁是碱性氧化物 B、该“运输车”的外壳一定含有碳元素 C、该“运输车”分散于水中所得的分散系属于胶体 D、二氧化硅不属于酸性氧化物4. 为阿伏加德罗常数的值,下列说法正确的是( )A、12g中含有0.2个阳离子 B、1.7g中含有氧原子数为0.2 C、标准状况下,22.4L中,含有H原子数目大于2 D、标准状况下,11.2L通入水中,溶液中氯离子数为0.55. 下列说法中正确的是( )①干冰、冰水混合物、四氧化三铁都是纯净物且为氧化物
②硫酸、纯碱、醋酸钠和烧碱分别属于酸、碱、盐和氧化物
③金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
④氢氧化铁胶体能比较稳定存在的主要原因是氢氧化铁胶体带正电
⑤胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥汽油属于有机化合物,为非电解质,生石灰可做食品干燥剂,为电解质
⑦使鲜花褪色,体现氯气漂白性
⑧12盐酸50与足量充分反应,转移电子数为0.3
A、2个 B、3个 C、4个 D、5个6. 下列粒子组能否大量共存的判断及分析正确的是( )选项
离子组
判断及原因
A
、、、
能大量共存
B
、、、
不能大量共存,因发生
C
、、、
不能大量共存,与发生反应:
D
、、、、
能大量共存,离子间不反应
A、A B、B C、C D、D7. 下列指定反应的离子方程式正确的是( )A、向含有和的混合溶液中通入少量: B、向次氯酸钙溶液通入足量二氧化碳: C、用醋酸除去水垢: D、溶液中滴入氯化钙溶液:8. 高铁酸钾是一种环保、高效、多功能饮用水处理剂,制备流程如图,下列叙述正确的是( ) A、反应Ⅰ产生的尾气可通入澄清石灰水中吸收 B、反应Ⅰ生成的会被氧化成 C、反应Ⅱ中每消耗3转移3电子 D、一定温度下,溶解度9. 氯化碘()在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,遇水易反应。实验室可用如图装置(部分夹持装置已略去)制取 , 制备的反应原理: , 下列说法不正确的是( )
A、反应Ⅰ产生的尾气可通入澄清石灰水中吸收 B、反应Ⅰ生成的会被氧化成 C、反应Ⅱ中每消耗3转移3电子 D、一定温度下,溶解度9. 氯化碘()在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,遇水易反应。实验室可用如图装置(部分夹持装置已略去)制取 , 制备的反应原理: , 下列说法不正确的是( ) A、利用装置甲选用药品可以是、 B、装置乙中长颈漏斗内液面上升说明丙装置可能发生堵塞 C、装置戊中碱石灰的作用是干燥 D、装置丁中生成 , 碘元素的化合价为+310. 在标准状况下,ag气体x与bg气体y的分子数相同,下列说法正确的是( )A、标准状况下,等质量的x和y体积之比为b:a B、同温同压下,气体x和气体y的密度之比为 b:a C、25℃时,1g气体x和1g气体y的原子数之比为b:a D、同物质的量的气体x和气体y的质量之比为b:a
A、利用装置甲选用药品可以是、 B、装置乙中长颈漏斗内液面上升说明丙装置可能发生堵塞 C、装置戊中碱石灰的作用是干燥 D、装置丁中生成 , 碘元素的化合价为+310. 在标准状况下,ag气体x与bg气体y的分子数相同,下列说法正确的是( )A、标准状况下,等质量的x和y体积之比为b:a B、同温同压下,气体x和气体y的密度之比为 b:a C、25℃时,1g气体x和1g气体y的原子数之比为b:a D、同物质的量的气体x和气体y的质量之比为b:a二、选择题(本题包括5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,漏选得2分,多选错选不得分)
-
11. 下列实验操作、现象和结论都正确的是( )
选项
操作
现象
结论
A

左边棉球变为橙色,右边棉球变为蓝色
氧化性:
B
向溶液中加入一小块钠
产生无色气泡,溶液底部有蓝色沉淀生成
水溶液中不能置换铜
C
向某溶液中加入盐酸产生无色气体,将该气体通入澄清石灰水
澄清石灰水变浑浊
该溶液中一定含有或
D
干燥的氯气依次通过干燥有色布条、湿润有色布条
干燥有色布条不褪色、湿润有色布条褪色
证明具有漂白性
A、A B、B C、C D、D12. 下列说法错误是( )A、该反应中氧化剂和还原剂个数比为3∶1 B、已知在碱性溶液中可发生反应: , 则中R的化合价是+6 C、已知 , 中显+1价,则1个参与反应时,整个反应转移1个电子 D、在碱性条件下可被氧化为 , 而被还原为 , 若反应中与的个数比为1∶16,则x值为513. 用如图所示装置进行下列实验,将①中液体滴入②中,预测现象不正确的是( )
选项
①中物质
②中物质
③中物质
预测现象
A
稀硫酸
粉末
饱和碳酸钠溶液
③中出现白色晶体
B
稀盐酸
粉末
-淀粉溶液
③中溶液变蓝色
C
稀盐酸
溶液
紫色石蕊试液
③紫色石蕊试液褪色
D
新制饱和氯水
粉末
湿润的红色石蕊试纸
②大理石表面有气泡产生,③中石蕊试纸变蓝
A、A B、B C、C D、D14. 某工业废水中含下表离子中的几种且每种离子数目相等( )阳离子
K+、Mg2+、Ba2+、Ag+
阴离子
Cl-、HCO、NO、SO
某同学欲探究废水的组成,进行了如下实验:
Ⅰ.取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ.向Ⅰ中所得的溶液中加入BaCl2溶液或AgNO3溶液都有白色沉淀生成。
下列推断不正确的是
A、溶液中一定含有的离子是K+、HCO、SO、Mg2+ B、Ⅰ中加入盐酸生成无色气体的离子方程式是HCO+H+=CO2↑+H2O C、原溶液中一定没有Ba2+、Ag+ , 但是Cl-、NO存在与否无法确定 D、Ⅱ中产生白色沉淀的一个离子方程式是:Ba2++SO=BaSO4↓15. KMnO4是实验室常见的氧化剂,实验室用MnO2等作原料制取少量KMnO4的实验流程如图:
下列说法正确的是( )
A、“熔融”过程中氧化剂是KClO3 , 还原剂是MnO2 B、“溶解”后的溶液中存在大量的K+、Cl-、MnO C、“K2MnO4歧化”时氧化剂与还原剂的分子个数比为1∶2 D、为了得到更多的晶体,结晶时应大火蒸干三、非选择题(本题包括5小题,共60分)
-
16. 漂白粉消毒是利用漂白粉的氧化作用对饮用水和废水进行杀菌的水处理过程。(1)、某品牌的漂白粉中,其有效成分的含量约为43%,写出工业上制漂白粉的化学反应方程式。(2)、某同学欲将该漂白粉配成450含有ClO-0.1的溶液。回答:

①写出在配制过程中,上图所示的仪器,用不到的仪器名称。
②配制过程中,需称量该漂白粉的质量为g
③该同学配制溶液后,发现溶液底部中有少量不溶物。请用化学方程式写出形成其不溶物的原因。
(3)、“84消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用98%(密度为1.84)的浓硫酸配制5002.3的稀硫酸用于增强“84消毒液”的消毒能力。①需用浓硫酸的体积为。
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是。
A.溶液中的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③在浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3有。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.定容时俯视观察液面
D.量取浓硫酸时俯视凹液面
17. 有些挂面在压制过程中会加入少量叫食用碱的碳酸钠。(一)工业上常采用侯氏制碱法制取碳酸钠,实验装置如图所示(夹持装置省略)。回答:
 (1)、实验时,先从管通入。(2)、有同学建议在b管下端连接多孔球泡装置,理由是。(3)、(二)碳酸钠样品中往往含有少量的 , 某学习小组设计质量差分析法测定样品中的质量分数。
(1)、实验时,先从管通入。(2)、有同学建议在b管下端连接多孔球泡装置,理由是。(3)、(二)碳酸钠样品中往往含有少量的 , 某学习小组设计质量差分析法测定样品中的质量分数。将一定质量的样品与足量的稀硫酸反应,采用如下图所示装置,通过称量反应前后盛有碱石灰的干燥管C的质量,利用其质量差计算样品的纯度。

①按照实验顺序排列下列操作步骤gdfch。(某些步骤可以重复)
a.检查装置的气密性 b.打开止水夹 c.缓慢鼓入空气数分钟
d.干燥管C内碱石灰质量为g e.取g样品装入广口瓶中
f.缓慢加入稀硫酸至不再产生气体为止 g.关闭止水夹
h.称量干燥管C质量为g()
②在操作h前,要缓慢鼓入空气数分钟,鼓入空气的作用是 , 装置A的作用是。
③若去掉装置D,对实验结果的影响是(读“偏大”,“偏小”或“无影响”),样品中的质量分数
18. 某小组通过实验探究氧化还原反应的规律。已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
物质
(酸化)
(酸化)
浓度
0.10M(M为物质的量浓度的单位)
电位值
171
1130
603
662
116
-361
根据表中数据,回答下列问题:
(1)、浓度相同的下列三种溶液,氧化性由强到弱的顺序为(填序号)。甲. 乙.酸性 丙.酸性
(2)、结合上述信息思考:对于、混合溶液,若控制性氧化而不氧化 , 请提出两种合理的氧化方案:①加入;②加入。(3)、向等浓度的和混合溶液滴加少量酸性溶液(对应还原产物为),发生反应的离子方程式为。(4)、已知下列四种氧化剂(均可氧化)对应的还原产物情况如下:氧化剂
还原产物
请判断,等物质的量的四种氧化剂分别与足量作用,得到最多的是。
(5)、造纸、印刷等工业废水中含有大量的硫化物(主要成分为),可用如图转化方式除去。
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为。
②在废水处理整个过程中,催化剂为 , 氧化剂为。
③反应Ⅲ中与等物质的量反应,写出反应的化学方程式。
19. 过氧化钙()广泛应用于水产养殖、污水处理,是优良的供氧剂。(1)、探究一:与水反应除生成氧气外,还生成什么物质?
取适量放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了 , 写出该反应的化学方程式:。(2)、此供氧剂长期暴露在空气中,会变质生成 , 为检验此供氧剂是否变质,某同学向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。其他同学不认同上述方案的理由是。(3)、探究二:测定久置过氧化钙纯度。方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
取一定质量的供氧剂溶于水,按照如图装置进行装配。读出体积时要注意:①该反应为放热反应。待气体恢复至室温再读数;②;③视线和凹液面最低处保持水平再读数。
 (4)、方案二:把样品中的转化为碳酸钙,通过测定碳酸钙沉淀的质量,求得的质量,具体流程如下:
(4)、方案二:把样品中的转化为碳酸钙,通过测定碳酸钙沉淀的质量,求得的质量,具体流程如下:
指出下图所示过滤操作中不规范之处。
 (5)、滴加的溶液要过量的原因是 , 计算样品中的物质的量为。20. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备和 , 探究其氧化还原性质。回答下列问题:
(5)、滴加的溶液要过量的原因是 , 计算样品中的物质的量为。20. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备和 , 探究其氧化还原性质。回答下列问题:已知:
 (1)、写出该装置中制备氯气的离子方程式 , a中的试剂为。(2)、b中氧化剂和还原剂的质量比为。c中采用冰水浴冷却的目是。(3)、d的作用是吸收多余的氯气,可选用试剂____(填字母)。A、 B、 C、 D、(4)、用制得的氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。
(1)、写出该装置中制备氯气的离子方程式 , a中的试剂为。(2)、b中氧化剂和还原剂的质量比为。c中采用冰水浴冷却的目是。(3)、d的作用是吸收多余的氯气,可选用试剂____(填字母)。A、 B、 C、 D、(4)、用制得的氯气做如图1的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。
①阶段①说明。
②阶段②的压强变小,该过程发生了氧化还原反应,氧化产物是。
③写出阶段③发生反应的离子方程式。