陕西省商洛市2023-2024学年高一上学期期末教学质量检测化学试题
试卷更新日期:2024-03-29 类型:期末考试
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
-
1. 中国传统文化蕴含了许多化学知识.下列说法错误的是( )A、活字印刷胶泥的成分 , 都属于金属氧化物 B、《本草图经》中记载“绿矾形似朴消而绿色”,其中“绿矾”是 C、陶弘景在《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”.钢是以铁为主的含碳合金 D、“早雾晴,晚雾阴”,雾是一种气溶胶,光束透过大雾可观察到丁达尔效应2. 下列化学用语书写错误的是( )A、的电子式为
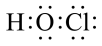 B、的电离方程式:
C、小苏打的化学式为
D、的结构示意图为
B、的电离方程式:
C、小苏打的化学式为
D、的结构示意图为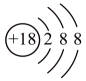 3. 邮票记载了我国发展历程,形象地呈现了人类与化学相互依存的关系,下列与邮票相关的叙述中没有发生化学变化的是( )
3. 邮票记载了我国发展历程,形象地呈现了人类与化学相互依存的关系,下列与邮票相关的叙述中没有发生化学变化的是( )A.建筑上用生石灰制熟石灰
B.炼钢厂将生铁炼成钢
C.液态水转化为水蒸气形成了云海
D.用侯氏制碱法生产纯碱



 A、A B、B C、C D、D4. 辛勤劳动才能创造美好生活.下列劳动项目与所涉及的化学知识不相符的是( )
A、A B、B C、C D、D4. 辛勤劳动才能创造美好生活.下列劳动项目与所涉及的化学知识不相符的是( )选项
劳动项目
化学知识
A
社区服务:草坪施肥
焰色试验呈紫色
B
家务劳动:柠檬煮水除去水壶中的水垢
柠檬酸可溶解碳酸钙等沉淀
C
趣味实验:用铝粉和氢氧化钠溶液疏通厨卫管道
铝粉与溶液反应放热并产生
D
学农活动:用厨余垃圾制肥料
厨余垃圾含N、P等元素
A、A B、B C、C D、D5. 下列有关合金的说法中,正确的是( )A、青铜比纯铜熔点高 B、合金不具有导热性 C、镁铝合金比纯铝硬度大 D、合金都不含非金属元素6. 碱金属元素是日本福岛第一核电站泄漏出的放射性污染物中的一种.下列说法错误的是( )A、是第六周期第族元素 B、的中子数为137 C、铯单质与水反应比钠单质剧烈 D、碱性:7. 下列物质中,只含有非极性共价键的是( )A、 B、 C、 D、8. 下列离子方程式中,正确的是( )A、与溶液反应: B、氯化铁溶液与过量的锌反应: C、溶液与溶液反应: D、溶液与溶液混合:9. 下列有关物质的性质与用途不具有对应关系的是( )A、铁粉能与O2反应,可用作食品保存的吸氧剂 B、纳米Fe3O4能与酸反应,可用作铁磁性材料 C、FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu D、聚合硫酸铁能水解并形成胶体,可用于净水10. 下列实验操作或装置设计合理的是( )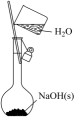
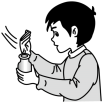
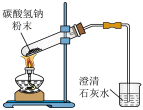

A.配制的溶液
B.闻气体气味
C.验证碳酸氢钠受热易分解
D.尾气最好用水吸收
A、A B、B C、C D、D11. 根据有关操作与现象,所得结论不正确的是( )选项
操作
现象
结论
A
向溶液中滴加、淀粉溶液
溶液变蓝
有还原性
B
向某溶液中滴加盐酸
产生气体
溶液中一定含有
C
向中分别滴加盐酸、溶液
溶解
氧化铝为两性氧化物
D
向酸性溶液中滴加溶液
紫色褪去
有还原性
A、A B、B C、C D、D12. 常用作媒染剂、脱色剂.某工艺通过如下流程制备氯化亚铜固体(已知容易被氧化):
下列说法正确的是( )
A、步骤①和②发生的反应均为氧化还原反应 B、所含质子数和电子数相等 C、和均为酸性氧化物 D、铜在潮湿的空气中可生成13. X、Y、Z、W、R为原子序数依次增大的短周期主族元素,元素X的原子核内只有1个质子,常温下,元素R的单质为气体,Y、Z、W、R在元素周期表中的相对位置如图.下列说法错误的是( )Y
Z
W
R
A、为强酸 B、非金属性: C、原子半径: D、分子的空间结构呈V形14. 现有由和组成的固体混合物,将该固体混合物全部加入稀盐酸中,恰好完全溶解,经测定溶液中的溶质仅为。将此固体混合物用充分还原,则生成的铁的质量为( )A、 B、 C、 D、二、非选择题:本题共4小题,共58分.
-
15. “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理.根据所学知识,回答下列问题:(1)、沾有水的铁锅在高温火焰上灼烧会发黑(黑色物质为),该反应的化学方程式为 .(2)、食用加碘食盐能消除碘缺乏病的困扰,碘的质量数是 .(3)、臭氧、“84”消毒液、二氧化氯、高铁酸钠等都是生活中常见的消毒剂.
①臭氧和氧气互为(填“同位素”或“同素异形体”).
②生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是
③是一种新型含氯消毒剂,在自来水消毒领域已经开始使用.中元素的化合价为价.
④高铁酸钠还是一种新型的净水剂.其净水过程中所发生的化学反应主要为(胶体) , 证明有胶体生成的实验操作为 .
(4)、汽车安全气囊弹出时发生反应: , 该反应中氧化剂为 .(5)、铝制器具不宜盛放碱性食物,请写出铝与溶液反应的离子方程式: .16. 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其他铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:步骤一:取10片补血剂研磨成粉末,加入的稀硫酸,充分溶解后过滤.
步骤二:取上述过滤后的滤液,滴加溶液,再加入过量的溶液,充分反应后,过滤.
步骤三:将步骤二过滤所得固体灼烧至恒重,称量,质量为 .
请回答下列问题:
(1)、实验室用的浓硫酸配制的硫酸溶液,所需浓硫酸的体积为(计算结果精确到小数点后一位).(2)、可使用容量瓶进行下列操作中的____(填标号).A、配制一定体积准确浓度的标准溶液 B、长期贮存溶液 C、代替量筒量取一定体积的液体(3)、的电子式为 , 步骤二中加入过量发生反应的离子方程式为 .(4)、每片补血剂中含硫酸亚铁的质量为g(用含a的代数式表示).(5)、用作补血剂使用时,医生建议与维生素C片同服,同学甲猜测维生素C可将转化为以利于人体吸收.为了验证这一猜想,设计如下实验:实验方案
实验现象
取适量溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液
溶液紫红色褪去
由上述实验能否得出维生素C可将转化为的结论?(填“能”或“否”),请说明理由: .
(6)、往溶液中滴加溶液,有白色沉淀A生成.某实验小组对所得白色沉淀A展开研究:查阅资料:在溶液中不存在 .
Ⅰ.取少量白色沉淀A,充分洗涤后,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
Ⅱ.向Ⅰ所得溶液中滴入试剂,溶液几乎不变色;
Ⅲ.向Ⅱ溶液中再滴入少量氯水,溶液立即变为红色.
根据以上现象,生成的白色沉淀A的化学式为 .
17. 有M、R、Q、Y、Z五种短周期主族元素,其中Z为短周期主族元素中原子半径最大的,Y的最高正价与最低负价的代数和为0,M、R、Q、Y四种元素在元素周期表中的相对位置如图.回答下列问题:M
Y
Q
R
(1)、R在元素周期表中的位置是 .(2)、写出单质Y的一种用途: .(3)、Z、M、Q的简单离子的半径由大到小的顺序为(用离子符号表示).(4)、写出的电子式: . 其所含的化学键类型为 .(5)、下列事实能作为比较元素Y与R的非金属性相对强弱依据的是____(填标号).A、常温下Y的单质呈固态,R的单质呈气态 B、最简单氢化物的稳定性: C、Y与R形成的化合物中Y呈正价 D、酸性:(6)、写出常温下,R的单质与Z的最高价氧化物对应水化物的稀溶液反应的离子方程式: .18. 氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含(难溶于稀硫酸),用硫酸渣制备铁红的过程如图: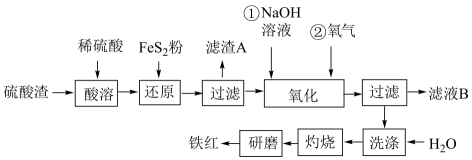 (1)、“酸溶”过程中,加入过量稀硫酸充分反应后的溶液中含有的阳离子除了 , 还有(填离子符号),写出与稀硫酸反应的离子方程式: .(2)、实验室中过滤需要用到的玻璃仪器有 .(3)、滤渣A的主要成分是是一种常见的酸性氧化物,与类似,可与强碱反应,写出与溶液反应的化学方程式: .(4)、“氧化”时,可观察到的现象为 . 若加入的溶液过量,则滤液B中的溶质除了外,还有(填化学式,下同);若加入的溶液不够,则制得的铁红中可能含有的杂质为 .
(1)、“酸溶”过程中,加入过量稀硫酸充分反应后的溶液中含有的阳离子除了 , 还有(填离子符号),写出与稀硫酸反应的离子方程式: .(2)、实验室中过滤需要用到的玻璃仪器有 .(3)、滤渣A的主要成分是是一种常见的酸性氧化物,与类似,可与强碱反应,写出与溶液反应的化学方程式: .(4)、“氧化”时,可观察到的现象为 . 若加入的溶液过量,则滤液B中的溶质除了外,还有(填化学式,下同);若加入的溶液不够,则制得的铁红中可能含有的杂质为 .