宁夏青铜峡市2023-2024学年高一上学期期末考试化学试题
试卷更新日期:2024-03-28 类型:期末考试
一、选择题(本大题共25个小题,每小题2分,共50分)
-
1. 胶体在人们的日常生活中随处可见。下列分散系属于胶体的是( )A、泥水 B、豆浆 C、生理盐水 D、油水混合物2. Co是γ放射源,可用于农作物诱变育种。 Co原子的核内中子数为( )A、60 B、33 C、87 D、273. 下列说法正确的是( )A、石墨导电,所以是电解质 B、SO2的水溶液导电,所以SO2是电解质 C、固体NaCl不导电,所以NaCl是非电解质 D、CaCO3虽然难溶于水但CaCO3是电解质4. 下列各组选项中属于同位素的是( )A、与 B、O2与O3 C、与 D、金刚石和石墨5. 下列生活中常见物质的俗名与化学式相对应的是( )A、纯碱—NaHCO3 B、石灰石—Ca(OH)2 C、铁红—FeO D、酒精—C2H5OH6. 下列物质中,既含有共价键又含有离子键的是( )A、HF B、NaCl C、HCl D、KOH7. 下列离子方程式书写正确的是( )A、氢氧化钠溶液和稀盐酸反应:H++OH-=H2O B、大理石与盐酸反应制取二氧化碳:+ 2H+=H2O + CO2↑ C、铁粉投入FeCl3溶液中:Fe + Fe3+=2Fe2+ D、用小苏打治疗胃酸过多:+ 2H+=CO2↑+H2O8. 在无色溶液中下列离子能大量共存的是( )A、Na+、H+、Cl-、 B、K+、Ba2+、OH-、Fe2+ C、Cu2+、Na+、Br-、Cl- D、Na+、K+、Cl-、9. 实验室制取氯气的化学方程式为: MnO2 + 4 HCl(浓)MnCl2+ Cl2↑+2H2O。下列有关该反应的说法正确的是( )A、MnO2是还原剂 B、MnO2中的Mn元素被还原 C、HCl中的氯元素得到电子 D、消耗4mol HCl转移4mol电子10. 下列说法正确的是( )A、H2的摩尔质量是2g B、18gH2O的物质的量是2mol C、阿伏加德罗常数符号为NA , 没有单位 D、标准状况下,气体摩尔体积约为22.4L•mol-111. NA表示阿伏加德罗常数,下列说法正确的是( )A、2.3克Na变为Na+时,失去的电子数为0.1NA B、18克H2O所含有的电子数为8NA C、28克N2所含的原子数为NA D、在标准状况下,11.2LO2所含的分子数为NA12. 同温同压下,同体积的甲、乙两种气体的质量比是17∶14,若乙气体是一氧化碳,则甲气体是( )A、O2 B、HCl C、CO2 D、H2S13. 下列溶液中,与100mL 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )A、100mL 0.5mol/L MgCl2溶液 B、200mL 0.25mol/L HCl溶液 C、50mLL1mol/L NaCl溶液 D、200mL0.25mol/L CaCl2溶液14. 下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al.
A、③④ B、②③④ C、①③④ D、全部15. 如下图所示的装置中A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶。下列说法正确的是( )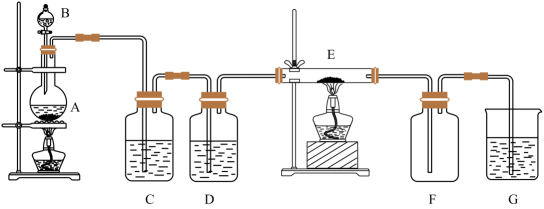 A、C瓶的作用是收集氯气 B、G中加入氢氧化钠溶液用于吸收多余的氯气 C、E中发生的化学反应为Fe+Cl2=FeCl2 D、用该装置制备氯气前不需要检查装置的气密性16. 铁与水蒸气反应的实验装置如图,下列说法正确的是( )
A、C瓶的作用是收集氯气 B、G中加入氢氧化钠溶液用于吸收多余的氯气 C、E中发生的化学反应为Fe+Cl2=FeCl2 D、用该装置制备氯气前不需要检查装置的气密性16. 铁与水蒸气反应的实验装置如图,下列说法正确的是( )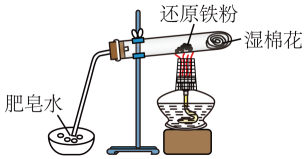 A、实验时,试管口应高于试管底 B、加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声 C、产生的气体在点燃前不需要检验纯度 D、试管中发生化合反应17. 检验久置的FeSO4溶液是否变质,最好选择的试剂是( )A、铁片 B、NaOH溶液 C、石蕊溶液 D、KSCN溶液18. 合金具有优良的机械性能,用途广泛.下列物质属于合金的是( )A、铝 B、青铜 C、石英 D、金刚石19. 除去铁粉中混有的少量铝粉,可加入的试剂是( )A、HCl B、NaOH C、CuCl2 D、H2O20. 配制100 mL 0.100 mol·Lˉ1 Na2CO3溶液时,有下列步骤:①溶解 ②转移 ③定容 ④计算 ⑤称量,正确的顺序为( )A、⑤④①②③ B、⑤④②①③ C、④⑤①②③ D、④③⑤①②21. F、Cl、Br都是VIIA族元素,关于这三种元素原子的说法正确的是( )A、原子半径:F>Cl>Br B、最外层电子数都相同 C、核外电子层数都相同 D、最外层电子数依次增多22. 下列有关物质的性质比较,错误的是( )A、非金属性:Cl>Br B、金属性:Al>Mg C、热稳定性:H2O>H2S D、酸性:HNO3>H3PO423. 铊是超导材料的组成元素之一,在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断一定不正确的是( )A、铊是易导电的银白色金属 B、能生成+3价离子化合物 C、Tl(OH)3是两性氢氧化物 D、Tl3+的氧化能力比Al3+弱24. 前三周期的四种主族元素X、Y、Z、W,X、Y、Z的相对位置如图所示。已知:X、Z两种元素的原子序数之和等于Y原子的原子序数,W与Z同周期且在同周期主族元素中W的原子半径最大。下列说法正确的是( )
A、实验时,试管口应高于试管底 B、加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声 C、产生的气体在点燃前不需要检验纯度 D、试管中发生化合反应17. 检验久置的FeSO4溶液是否变质,最好选择的试剂是( )A、铁片 B、NaOH溶液 C、石蕊溶液 D、KSCN溶液18. 合金具有优良的机械性能,用途广泛.下列物质属于合金的是( )A、铝 B、青铜 C、石英 D、金刚石19. 除去铁粉中混有的少量铝粉,可加入的试剂是( )A、HCl B、NaOH C、CuCl2 D、H2O20. 配制100 mL 0.100 mol·Lˉ1 Na2CO3溶液时,有下列步骤:①溶解 ②转移 ③定容 ④计算 ⑤称量,正确的顺序为( )A、⑤④①②③ B、⑤④②①③ C、④⑤①②③ D、④③⑤①②21. F、Cl、Br都是VIIA族元素,关于这三种元素原子的说法正确的是( )A、原子半径:F>Cl>Br B、最外层电子数都相同 C、核外电子层数都相同 D、最外层电子数依次增多22. 下列有关物质的性质比较,错误的是( )A、非金属性:Cl>Br B、金属性:Al>Mg C、热稳定性:H2O>H2S D、酸性:HNO3>H3PO423. 铊是超导材料的组成元素之一,在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断一定不正确的是( )A、铊是易导电的银白色金属 B、能生成+3价离子化合物 C、Tl(OH)3是两性氢氧化物 D、Tl3+的氧化能力比Al3+弱24. 前三周期的四种主族元素X、Y、Z、W,X、Y、Z的相对位置如图所示。已知:X、Z两种元素的原子序数之和等于Y原子的原子序数,W与Z同周期且在同周期主族元素中W的原子半径最大。下列说法正确的是( )X
Z
Y
A、简单离子半径:Z>Y>W B、原子序数:W>Y C、Z元素最高正化合价为+7价 D、X的最高价氧化物对应的水化物是一种强酸25. 下列电子式书写正确的是( )A、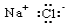 B、
B、 C、
C、 D、
D、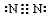
二、填空题(共50分)
-
26. 根据要求完成下列填空。(1)、标准状况下,33.6LHCl溶于水配成1L的溶液,则溶液的物质的量浓度为mol/L。(2)、钠是活泼金属,能与水剧烈反应,请写出反应的该反应的离子方程式。(3)、写出水和氯化镁的电子式:水、氯化镁。(4)、用电子式描述氯化钠和氯化氢的形成过程
氯化钠:。
氯化氢:。
27. 已知有以下物质相互转化试回答: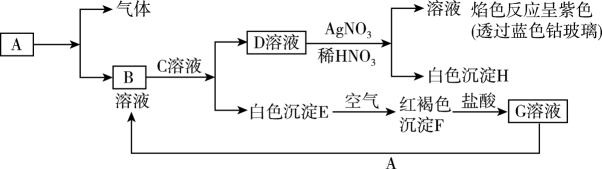 (1)、写出B、C、D三种溶液中溶质的化学式。
(1)、写出B、C、D三种溶液中溶质的化学式。B.、C.、D.。
(2)、写出由E转变成F的化学方程式。(3)、向G溶液加入A的有关离子反应方程式。(4)、列举一种检验G溶液中金属阳离子的方法:。28. 下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题: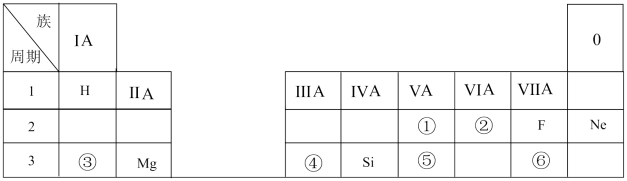 (1)、②表示的元素是(填元素符号)。(2)、①与⑤两种元素相比较,原子半径较大的是(填元素符号);其非金属性较强的是(填元素符号);其最高正价氧化物水化物酸性较强的是(填分子式)。(3)、⑥元素的单质可以用来制取漂白粉,其有效成分是(填化学式)。(4)、写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的离子方程式:。29. 实验室欲配制250mL0.10mol﹒L-1NaOH溶液,按要求填空:(1)、需NaOH的质量为。(2)、配制过程中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外,还有一种主要的仪器是;(3)、定容时,加水超过刻度线,处理的方法是(填序号)。
(1)、②表示的元素是(填元素符号)。(2)、①与⑤两种元素相比较,原子半径较大的是(填元素符号);其非金属性较强的是(填元素符号);其最高正价氧化物水化物酸性较强的是(填分子式)。(3)、⑥元素的单质可以用来制取漂白粉,其有效成分是(填化学式)。(4)、写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的离子方程式:。29. 实验室欲配制250mL0.10mol﹒L-1NaOH溶液,按要求填空:(1)、需NaOH的质量为。(2)、配制过程中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外,还有一种主要的仪器是;(3)、定容时,加水超过刻度线,处理的方法是(填序号)。①吸出多余液体,使凹液面与刻度线相切
②小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
③经计算加入一定量的浓盐酸
④重新配制
(4)、下列操作会引起所配溶液浓度偏高的是。①称量固体药品时所用的砝码是生锈的
②定容时俯视刻度线
③容量瓶不干燥,含有少量蒸馏水
30. 将10克的铜铝合金,投入到足量的稀盐酸中充分反应后,共收集到标准状况下氢气3.36升,计算:(不用书写过程)(1)、参加反应的HCl的物质的量;(2)、合金中金属铜的质量。