青海省西宁市大通县2023-2024学年高二上学期期末联考化学试题
试卷更新日期:2024-03-28 类型:期末考试
一、选择题(本大题共15小题,每小题3分,共计45分。在每小题列出的四个选项中,只有一项是符合题目要求的)
-
1. 化学与生产、生活关系密切。下列操作或应用错误的是( )A、将草木灰与铵态氮肥混合施用 B、用白醋除去热水瓶内的水垢 C、用高铁酸钾()作为净水剂 D、用活性炭去除冰箱里的异味2. 合成氨工业中采用循环操作,主要是为了( )A、增大化学反应速率 B、提高平衡混合物中氨的含量 C、降低氨的沸点 D、提高氮气和氢气的利用率3. 下列有关电解的叙述中错误的是( )A、与电源正极相连的是阳极 B、与电源负极相连的是阴极 C、在阴极上发生氧化反应 D、阴离子向阳极方向迁移4. 下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )A、 B、 C、 D、5. 下列叙述中错误的是( )A、生铁中含有碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈 C、在铁制品上镀铜时,铁制品为阳极,铜盐为电镀液 D、铁管上镶嵌锌块,铁管不易被腐蚀6. 与的反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
 A、反应①、反应②均为吸热反应 B、活化能:反应①<反应② C、反应速率:反应①>反应② D、7. 实验室用标准溶液滴定未知浓度的溶液,下列说法或操作正确的是( )A、滴定前锥形瓶用溶液润洗2~3次 B、将标准溶液置于碱式滴定管中备用 C、滴定前俯视读数、滴定后仰视读数会导致滴定结果偏高 D、当锥形瓶内溶液颜色由浅绿色变为紫红色时,立即记下滴定管液面所在刻度8. 恒温下气体反应达到化学平衡,平衡常数。恒容时,若降低温度,D的浓度增大。下列说法错误的是( )A、该反应的化学方程式为 B、增大、 , 减小 C、恒容时,向容器中充入 , 反应速率不变 D、正反应为放热反应9. 将金属X连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。下列有关说法错误的是( )
A、反应①、反应②均为吸热反应 B、活化能:反应①<反应② C、反应速率:反应①>反应② D、7. 实验室用标准溶液滴定未知浓度的溶液,下列说法或操作正确的是( )A、滴定前锥形瓶用溶液润洗2~3次 B、将标准溶液置于碱式滴定管中备用 C、滴定前俯视读数、滴定后仰视读数会导致滴定结果偏高 D、当锥形瓶内溶液颜色由浅绿色变为紫红色时,立即记下滴定管液面所在刻度8. 恒温下气体反应达到化学平衡,平衡常数。恒容时,若降低温度,D的浓度增大。下列说法错误的是( )A、该反应的化学方程式为 B、增大、 , 减小 C、恒容时,向容器中充入 , 反应速率不变 D、正反应为放热反应9. 将金属X连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。下列有关说法错误的是( )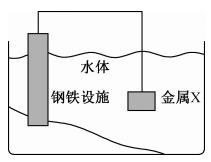 A、钢铁设施表面因有电子流入而被保护 B、钢铁设施的电极反应式为 C、形成电化学保护时,金属X作负极 D、通常情况下,钢铁设施在海水中的腐蚀速率比在河水中的快10. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、的溶液:、 , 、 B、含的溶液:、、、 C、滴加甲基橙试液显红色的溶液:、 , , D、水电离出来的的溶液:、、、11. 在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
A、钢铁设施表面因有电子流入而被保护 B、钢铁设施的电极反应式为 C、形成电化学保护时,金属X作负极 D、通常情况下,钢铁设施在海水中的腐蚀速率比在河水中的快10. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、的溶液:、 , 、 B、含的溶液:、、、 C、滴加甲基橙试液显红色的溶液:、 , , D、水电离出来的的溶液:、、、11. 在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )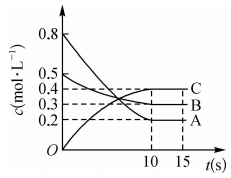 A、该反应的化学方程式为 B、反应物A的平衡转化率为60% C、0~10s内,A的平均反应速率为 D、在10~15s内,12. 下列装置或操作正确且对应的实验能达到实验目的的是( )A、测定溶液的浓度
A、该反应的化学方程式为 B、反应物A的平衡转化率为60% C、0~10s内,A的平均反应速率为 D、在10~15s内,12. 下列装置或操作正确且对应的实验能达到实验目的的是( )A、测定溶液的浓度 B、测定中和反应反应热
B、测定中和反应反应热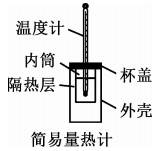 C、通过注射器活塞右移,验证与反应放热
C、通过注射器活塞右移,验证与反应放热 D、研究 , 对分解速率的影响
D、研究 , 对分解速率的影响 13. 现进行下列实验。
13. 现进行下列实验。将溶液和溶液等体积混合,得到悬浊液;将悬浊液过滤,得到滤液和白色沉淀。
向滤液中滴加溶液,滤液出现浑浊。
向沉淀中滴加溶液,沉淀变为黄色。
下列关于上述实验的分析错误的是( )
A、悬浊液中存在沉淀溶解平衡: B、滤液中不含 C、实验(3)表明转化为 D、实验可以证明的比的小14. 强碱的溶液和等体积、等物质的量浓度的弱酸的溶液混合后,溶液中有关离子浓度的大小关系是( )A、 B、 C、 D、15. 某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,装置如图所示。其中乙装置中X为阳离子交换膜。下列有关说法错误的是( )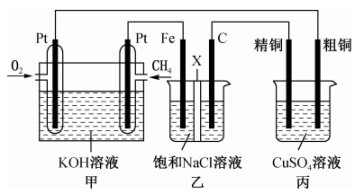 A、通入的极为正极,该电极反应式为 B、乙装置中铁电极为阴极,电极反应式为 C、反应一段时间后,乙装置中在铁电极区生成氢氧化钠溶液 D、反应一段时间后,丙装置中硫酸铜溶液浓度可能减小
A、通入的极为正极,该电极反应式为 B、乙装置中铁电极为阴极,电极反应式为 C、反应一段时间后,乙装置中在铁电极区生成氢氧化钠溶液 D、反应一段时间后,丙装置中硫酸铜溶液浓度可能减小二、非选择题(本题共4小题,共55分)
-
16. 在1L密闭容器中发生反应: , 其化学平衡常数与温度的关系如下表:
(℃)
650
700
800
830
1000
0.5
0.6
0.9
1.0
1.7
回答下列问题:
(1)、该反应的(填“>”或“<”)0。(2)、某温度时,测得平衡体系中各物质的物质的量浓度相等,则此时对应的温度为℃。保持温度和体积不变,充入一定量的 , 则平衡常数(填“增大”“减小”或“不变”)。(3)、下列措施不能提高的平衡转化率的是____(填字母)。A、选择适当的催化剂 B、增大压强 C、及时分离出 D、升高温度(4)、650℃时,将2mol和3mol投入上述容器中开始反应,达到平衡时的转化率为。(5)、800℃时,某时刻测得 , , ¹、 , 则此时反应是否达到平衡状态(填“是”或“否”),此时,(填“>”“<”或“=”)。17. 酸性锌锰干电池是一种常用的一次电池,其结构如图所示。该电池在放电过程中产生和。回答下列问题: (1)、该电池的正极为(填“”或“”)极,该电池总反应的化学方程式为。(2)、如图为电解100mL溶液的装置,该装置的电源为上述酸性锌锰干电池。
(1)、该电池的正极为(填“”或“”)极,该电池总反应的化学方程式为。(2)、如图为电解100mL溶液的装置,该装置的电源为上述酸性锌锰干电池。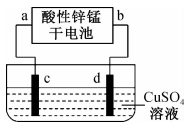
①电解一段时间后,石墨电极出现的现象为;石墨电极上的电极反应式为。
②当上述电池消耗3.25g时,电解后溶液中为(忽略电解前后溶液体积变化)。欲将电解后的溶液恢复至原溶液,应加入的试剂是 , 其质量为g。
18. 水溶液中的离子反应与平衡在生产和生活中有广泛的用途。回答下列问题:(1)、25℃时,若向氨水中加入少量硫酸铵固体,则溶液中将(填“增大”“减小”或“不变”)。(2)、25℃时,若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:;所得溶液的7(填“>”“<”或“=”),用离子方程式表示其原因:。(3)、25℃时,若向氨水中加入稀硫酸至溶液的 , 此时溶液中 , 则=。(4)、25℃时,为配制:溶液,取固体少许溶于2~3mL水中,有白色沉淀产生,此溶液的7(填“<”“>”或“=”),配制;溶液的正确方法是。(5)、在化学分析中,以标准溶液滴定溶液中的时,采用为指示剂,利用与反应生成砖红色沉淀指示滴定终点。当溶液中的恰好沉淀完全(浓度等于)时,溶液中= , =(结果保留两位有效数字。已知:25℃时、的分别为和。)19. 某含锰废料中主要含及少量的 , 、 , 以此为原料制备的流程如下: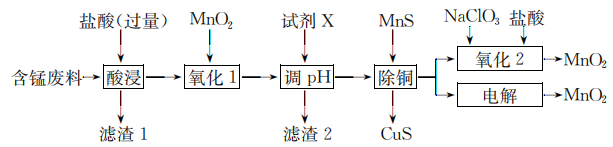
Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物
开始沉淀时
8.3
6.3
2.7
4.7
完全沉淀时
9.8
8.3
3.7
6.7
Ⅱ.常温下、。
回答下列问题:
(1)、滤渣1的主要成分是(填化学式)。(2)、“氧化1”的目的是(用离子方程式表示)。(3)、“调”时,试剂X为(任写一种),|的调节范围为。(4)、“除铜”时,当溶液中 , 溶液中=。(5)、“氧化2”制备(恰好完全反应)时,=();“电解”制备的阳极电极反应式为。