专题十 化学计算题--【高效二轮复习】2023-2024学年中考科学二轮复习(浙教版)
试卷更新日期:2024-03-27 类型:二轮复习
一、解答题
-
1. 某科学兴趣小组为测定氧化铜样品的纯度(即样品中氧化铜的质量分数),设计了如下实验(装置如图所示)。测得的实验数据如下:样品质量为20克,实验开始前B装置(U形干燥管)总质量为38克,实验结束后B装置总质量变为41.6克(此时已完全反应)。
 (1)、装置C的作用是。(2)、求反应生成的水的质量。(3)、求该氧化铜样品的纯度。(已知样品中杂质和氢气不会反应)2. 将12.9克NaCl和Na2CO3固体混合物完全溶于52.1克水中形成溶液,再将75克CaCl2溶液分5次加入到该溶液中,充分反应,测得的实验数据如下表。
(1)、装置C的作用是。(2)、求反应生成的水的质量。(3)、求该氧化铜样品的纯度。(已知样品中杂质和氢气不会反应)2. 将12.9克NaCl和Na2CO3固体混合物完全溶于52.1克水中形成溶液,再将75克CaCl2溶液分5次加入到该溶液中,充分反应,测得的实验数据如下表。实验序号
1
2
3
4
5
加入CaCl2溶液质量/克
15
15
15
15
15
生成沉淀的总质量/克
4
m
10
10
10
求:
(1)、表格中m的数值是。(2)、溶液中Na2CO3完全反应是在第次实验。(3)、固体混合物中Na2CO3的质量。(4)、请计算第三次加入CaCl2溶液后所得溶液中NaCl的溶质质量分数。(精确到0.1%)3. 生活中,经常有人通过用喝醋的方法去除卡在咽上的鱼刺,这种做法科学吗?小明查找资料知道:鱼骨的主要成分是有机物和无机物,有机物能燃烧,无机物主要是碳酸钙,碳酸钙能与醋酸发生化学反应,生成可溶性的物质,因而能使鱼骨软化使之从咽部脱落。现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。
提示:
①食醋的主要成分是醋酸(HAc),醋酸和碳酸钙反应的化学方程式为:
CaCO3+2HAc═Ca(Ac)2+H2O+CO2↑
②鱼骨中其它成分与食醋反应生成的气体可忽略不计。
(1)、该实验中浓硫酸的作用。(2)、小明通过图乙分析得出生成的二氧化碳的质量为克。(3)、小明老师认为这样的分析不够严谨。经过同组同学的讨论分析小明终于知道了。反应前锥形瓶中是空气,反应完之后锥形瓶中是二氧化碳。于是他们通过实验设计测出反应前后锥形瓶质量差值为0.11克。现在请你帮小明计算出鱼骨中碳酸钙的质量分数。(4)、最后小明得出,用喝醋的方法除去卡在咽上的鱼刺这种做法是不科学的。请你结合乙图及实验结果加以说明。4. 黄铜(由铜和锌形成的合金)有较强的耐磨性能,在生活中有广泛的用途。晓军同学为 了测定黄铜屑样品组成,分四组取样品与稀硫酸反应,其实验数据记录如下表:样 品
第 1 份
第2份
第3份
第4份
取样品质量(g)
25.0
25.0
25.0
25.0
取稀硫酸质量(g)
40.0
80.0
120.0
160.0
产生气体质量(g)
0.2
0.4
0.5
m
试计算:
(1)、上表中 m 的数值是;(2)、通过分析上述数据可知,当黄铜样品和稀硫酸的质量比为时,两者恰好完全 反应;(3)、求所用稀硫酸中硫酸的质量分数?5. 某科学兴趣小组测定某石灰石样品中碳酸钙的质量分数(样品中的杂质不与酸反应,也不溶于水),取6g样品置于质量为10g的烧杯中,再将50g稀盐酸分5次加入。每次加入后,待反应充分进行,对烧杯总质量进行称量,实验结果如下表所示:测量次数
第1次
第2次
第3次
第4次
第5次
加入稀盐酸的总质量(g)
10
20
30
40
50
烧杯总质量(g)
25.56
35.12
44.68
54.24
64.24
(1)、第次样品反应完全,生成的二氧化碳总质量为g。(2)、计算石灰石样品中碳酸钙的质量分数。(计算结果精确到0.1%)6. 实验室有一杯质量为50g的硫酸铜和稀盐酸混合溶液,缓慢加入未知浓度的氢氧化钡溶液,每次加入20g,共分6次加入,同时不断搅拌,使其充分反应,并测量每次反应后溶液总质量和沉淀质量,部分数据如下表所示。测量次数
第1次
第⒉次
第3次
第4次
第5次
第6次
加入氢氧化钡溶液质量/g
20
20
20
20
20
20
溶液总质量/g
65.34
80.68
100.68
118.72
136.76
m
沉淀质量
4.66
9.32
9.32
11.28
13.24
13.24
(1)、表格中m=。(2)、求实验使用的氢氧化钡溶液的溶质质量分数。(3)、第3次实验中沉淀质量没有增加,而第4次实验沉淀质量又增加的原因是。(4)、求原混合溶液中稀盐酸的溶质质量分数。7. 在实验室中,小宁同学发现了一瓶敞口的氢氧化钠固体。他对该固体的成分进行了定量实验分析:称取固体28 g放入锥形瓶中,加入一定量的水配制成50g溶液,再向锥形瓶中依次滴加30g溶质质量分数为14.6%的盐酸充分反应,测得部分数据如表。请根据有关信息回答问题。实验次数
第1次
第2次
第3次
第4次
第5次
第6次
第7次
加入盐酸的质量/g
30
30
30
30
30
30
30
锥形瓶中物质的质量/g
80
110
140
170
197.8
226.7
a
(1)、a的数值为。(2)、计算氢氧化钠固体中碳酸钠的质量分数(计算结果精确到0.1%)(3)、计算第5次加入盐酸后,氯化钠的质量分数。(计算结果精确到0.1%)8. 小宁同学用一定质量分数的FeCl3溶液和一定质量的NaOH固体粉末做实验。四次实验结果如表所示:实验次数
NaOH质量/g
FeCl3溶液质量/g
Fe(OH)3质量/g
1
6
100
5.35
2
12
100
10.7
3
24
150
16.05
4
30
200
a
根据实验结果回答下列问题:
(1)、实验过程中可以观察到有色沉淀生成。(2)、第次实验,FeCl3和NaOH恰好完全反应。(3)、表中的a值是。(4)、实验中所用FeCl3溶液中溶质的质量分数是多少?(写出计算过程)。9. 为了测定石灰石样品中碳酸钙的含量,小敏在15g样品中加入足量的稀盐酸进行实验(杂质不溶于水且不与酸反应,不考虑稀盐酸挥发氯化氢)。实验装置和有关数据如下: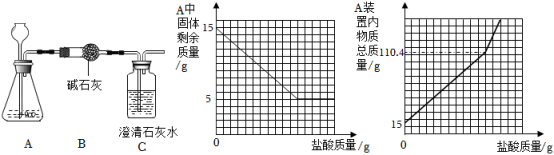
A装置中不再有气体产生时测得B装置质量增加了4.6g;C装置质量没有发生变化且无明显现象。请回答:
(1)、石灰石样品中碳酸钙的质量为g。(2)、请分析碱石灰的增重大于二氧化碳质量的原因:。(3)、所用稀盐酸的溶质质量分数是多少?10. 实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)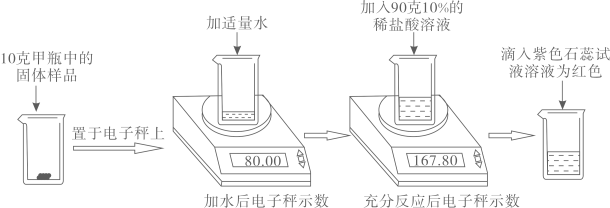 (1)、滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈性。(2)、上述实验中产生的二氧化碳气体质量为克.(3)、计算甲瓶固体样品中碳酸钠的质量分数。(4)、某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因.11. 农业上可用熟石灰改良酸性土壤。某小组做了Ca(OH)2溶液和稀盐酸反应的相关实验探究,如图所示。
(1)、滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈性。(2)、上述实验中产生的二氧化碳气体质量为克.(3)、计算甲瓶固体样品中碳酸钠的质量分数。(4)、某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因.11. 农业上可用熟石灰改良酸性土壤。某小组做了Ca(OH)2溶液和稀盐酸反应的相关实验探究,如图所示。 (1)、甲中酸与碱反应的化学方程式为 , 若酸碱恰好完全中和,观察到的实验现象是。(2)、往乙反应结束后的溶液中滴加质量分数为26.5%的Na2CO3溶液(如丙),溶液pH的变化如图丁所示。ab段反应结束后,b点对应溶液中所含的溶质为(填化学式)。(3)、丙实验结束后,产生沉淀的质量为g。c点后pH逐渐增大的原因是。12. 珍珠粉的主要成分是碳酸钙,其作为一种新型补钙剂,越来越受人们的青睐。兴趣小组利用图甲装置测定人工养殖珍珠中碳酸钙的含量。实验步骤如下:
(1)、甲中酸与碱反应的化学方程式为 , 若酸碱恰好完全中和,观察到的实验现象是。(2)、往乙反应结束后的溶液中滴加质量分数为26.5%的Na2CO3溶液(如丙),溶液pH的变化如图丁所示。ab段反应结束后,b点对应溶液中所含的溶质为(填化学式)。(3)、丙实验结束后,产生沉淀的质量为g。c点后pH逐渐增大的原因是。12. 珍珠粉的主要成分是碳酸钙,其作为一种新型补钙剂,越来越受人们的青睐。兴趣小组利用图甲装置测定人工养殖珍珠中碳酸钙的含量。实验步骤如下:
①检查装置气密性。
②注射器活塞推到底部,向装置内装入1.25g 磨成粉的珍珠样品,分液漏斗内加入足量稀盐酸,再次连接装置。
③打开分液漏斗活塞,将20mL足量稀盐酸加入装置后立即关闭活塞,充分反应后,观察到气泡不再产生,记录此时注射器的示数为240mL.资料:标准状况下,二氧化碳气体的密度约为2.0gL;珍珠粉中其它成分不与稀盐酸反应,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↓;甲装置固定装置略,不考虑活塞的摩擦和自重。
(1)、检查装置气密性:关闭分液漏斗活塞,将注射器活塞底部从0mL处向上拉至 100mL,如果气密性良好,松手后能观察到的现象是。(2)、求该人工养殖珍珠中碳酸钙的质量分数。(3)、结合图乙药房售卖的某品牌珍珠粉说明书,你认为上述人工养殖珍珠磨成粉是否可内服,你的理由是。