专题七 溶解度和溶质质量分数的计算--【高效二轮复习】2023-2024学年中考科学二轮复习(浙教版)
试卷更新日期:2024-03-27 类型:二轮复习
一、选择题
-
1. 如图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )
 A、从N→M:向N中加入适量固体A B、从N→M:先将N降温到t1℃,再加入适量固体A C、从M→N:先将M降温到t1℃,再将其升温 D、从M→N:先将M升温到t3℃,再加入适量的水2. a、b、c三种物质的溶解度曲线如图所示,下列说法正确的是( )
A、从N→M:向N中加入适量固体A B、从N→M:先将N降温到t1℃,再加入适量固体A C、从M→N:先将M降温到t1℃,再将其升温 D、从M→N:先将M升温到t3℃,再加入适量的水2. a、b、c三种物质的溶解度曲线如图所示,下列说法正确的是( ) A、t1℃时,a、b、c 三种物质的溶解度由大到小的顺序是b>a>c B、t2℃时,30 g a物质加入50g水中不断搅拌,所得溶液中溶质的质量分数为37.5% C、t2℃时,将相同质量的a、b、c三种物质的饱和溶液降温到t1℃ ,析出晶体最多的是a物质 D、将t1℃时c的饱和溶液升温到t2℃,变为不饱和溶液3. 甲、乙两种物质的溶解度曲线如下图所示。下列说法正确的是( )
A、t1℃时,a、b、c 三种物质的溶解度由大到小的顺序是b>a>c B、t2℃时,30 g a物质加入50g水中不断搅拌,所得溶液中溶质的质量分数为37.5% C、t2℃时,将相同质量的a、b、c三种物质的饱和溶液降温到t1℃ ,析出晶体最多的是a物质 D、将t1℃时c的饱和溶液升温到t2℃,变为不饱和溶液3. 甲、乙两种物质的溶解度曲线如下图所示。下列说法正确的是( )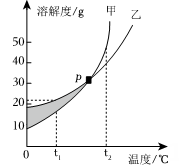 A、阴影部分的任意点表明甲、乙两种溶液都是饱和溶液 B、P点时,甲、乙两种溶液的溶质质量分数相等 C、t₂℃时,在100g水中加入60g甲,形成不饱和溶液 D、t₁℃时,甲、乙的饱和溶液升温至t₂℃,溶液的溶质质量分数甲>乙4. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
A、阴影部分的任意点表明甲、乙两种溶液都是饱和溶液 B、P点时,甲、乙两种溶液的溶质质量分数相等 C、t₂℃时,在100g水中加入60g甲,形成不饱和溶液 D、t₁℃时,甲、乙的饱和溶液升温至t₂℃,溶液的溶质质量分数甲>乙4. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( ) A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,水的质量分数不断增大 D、在②→④过程中,氯化钠的质量分数先不变后增大5. 为探究硝酸钾(KNO3)的溶解性,进行了如图所示实验(实验过程)结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是( )
A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,水的质量分数不断增大 D、在②→④过程中,氯化钠的质量分数先不变后增大5. 为探究硝酸钾(KNO3)的溶解性,进行了如图所示实验(实验过程)结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是( )
温度/℃
10
20
30
40
50
60
KNO3溶解度/g
20.9
31.6
45.8
63.9
85.5
110.0
A、①③中的溶液均为不饱和溶液 B、②③中溶液的质量:③>② C、②③④中溶液的溶质质量分数:③>②>④ D、④中析出晶体的质量是0.9g6. 如表是不同温度时硝酸钾的溶解度,有关说法正确的是( )温度/℃
0
20
40
60
80
100
溶解度/克
13.3
31.6
63.9
110
169
246
A、20℃时,100克水中溶解的硝酸钾越多溶解度就越大 B、40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克 C、100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多 D、0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小7. 下表是不同温度时NaCl、KNO3的溶解度.则下列说法正确的是( )温度/℃ 0 20 40 60 80 溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 KNO3 13.3 31.6 63.9 110 169 A、将60℃时KNO3的饱和溶液降温至20℃,溶质、溶剂的质量都会减少 B、将80℃时NaCl、KNO3两种饱和溶液降温至20℃,析出晶体的质量一定是:KNO3>NaCl C、40℃时,将5gNaCl、5gKNO3分别加入10g水中,所得溶液的溶质质量分数不相等 D、用上表数据绘制成NaCl、KNO3的溶解度曲线,两条曲线交点对应的温度范围是0~20℃8. 已知在20℃和60℃时, CaCl2的溶解度分别为74.5g和137g。现配制5%CaCl2溶液如图,下列说法正确的是 A、②和③中溶液分别为20°℃和60℃时的饱和溶液 B、②到③的过程中溶质质量分数不变 C、③稀释至④的过程需加水1420g D、③中溶液的溶质质量大于④中溶液的溶质质量
A、②和③中溶液分别为20°℃和60℃时的饱和溶液 B、②到③的过程中溶质质量分数不变 C、③稀释至④的过程需加水1420g D、③中溶液的溶质质量大于④中溶液的溶质质量二、填空题
-
9. 硝酸钾和硝酸钠在不同温度时的溶解度如下表所示:
温度/℃
0
10
20
30
40
50
60
70
80
90
100
溶解度
/g
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110
138
246
202
150
硝酸钠
73
80
87
95
103
114
125
136
169
163
170
(1)、20℃时,向100g水中加入35g硝酸钾,要使其完全溶解,应溶液温度。(2)、现有80℃的硝酸钠饱和溶液250g,要使其析出晶体70g,应降温至℃。(3)、硝酸钾和硝酸钠在t℃时的溶解度均为W,分析上表可推知,W的数值所在的最小范围是;将溶剂质量相同的硝酸钾和硝酸钠的饱和溶液从t1℃降温至t2℃,前者析出的晶体比后者多,则t1、t2的取值范围正确的是(填字母)。A.仅B.仅 C.
10. 向50mL水(密度为1g/mL)中溶解一定量固体的操作如下,请你根据如图实验现象和溶解度曲线回答。
①A、B、C中一定是饱和溶液的是 , 一定是不饱和溶液的是;(填字母)
②当x=g时,B中恰好没有固体剩余;
③硝酸钾从溶液中析出晶体常用方法.
11. 甲、乙两种不含结晶水的固体物质的溶解度曲线如图1所示。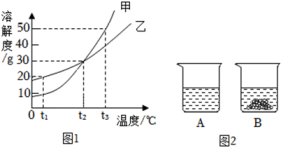 (1)、t1℃时,将等质量的甲、乙两种物质分别加入盛有100g水的A、B两只烧杯中,充分搅拌后现象如图2所示,烧杯A中溶解的溶质是(填“甲”或“乙”)。(2)、将t3℃时甲的饱和溶液150g稀释成质量分数为10%的甲溶液,需加水mL(水的密度为1g/cm3)。(3)、现有t2℃时的甲的饱和溶液和乙的饱和溶液。下列说法正确的是____(填字母)。A、两溶液中溶质的质量均为30g B、分别升温至t3℃,所得溶液中溶质的质量分数一定相等 C、分别降温到t1℃,析出甲的质量一定大于析出乙的质量 D、保持温度不变,分别加入等质量的水,混匀后所得溶液中溶质的质量分数一定相等12. 小温学习了有关溶液的知识后,进行了如下探究:(已知;氯化钾(KCl)的溶解度随温度升高而增大)
(1)、t1℃时,将等质量的甲、乙两种物质分别加入盛有100g水的A、B两只烧杯中,充分搅拌后现象如图2所示,烧杯A中溶解的溶质是(填“甲”或“乙”)。(2)、将t3℃时甲的饱和溶液150g稀释成质量分数为10%的甲溶液,需加水mL(水的密度为1g/cm3)。(3)、现有t2℃时的甲的饱和溶液和乙的饱和溶液。下列说法正确的是____(填字母)。A、两溶液中溶质的质量均为30g B、分别升温至t3℃,所得溶液中溶质的质量分数一定相等 C、分别降温到t1℃,析出甲的质量一定大于析出乙的质量 D、保持温度不变,分别加入等质量的水,混匀后所得溶液中溶质的质量分数一定相等12. 小温学习了有关溶液的知识后,进行了如下探究:(已知;氯化钾(KCl)的溶解度随温度升高而增大) (1)、实验一中ABCD四个烧杯中的液体,一定是饱和溶液的是(填字母)。(2)、实验一中A→D过程中,氯化钾的溶解度(选填”一直增大”、”不变”、“先增大后不变”)(3)、实验二中①③④三个烧杯溶质质量分数由大到小的顺序是(用序号表示)。
(1)、实验一中ABCD四个烧杯中的液体,一定是饱和溶液的是(填字母)。(2)、实验一中A→D过程中,氯化钾的溶解度(选填”一直增大”、”不变”、“先增大后不变”)(3)、实验二中①③④三个烧杯溶质质量分数由大到小的顺序是(用序号表示)。三、解答题
-
13. 盐水选种是一种巧妙的挑选优质种子的方法。长得很饱满的小麦种子,密度超过1.2×103kg/m3;长得很饱满的水稻种子,密度超过1.1×103kg/m3;干瘪的和被虫子蛀坏的种子的密度都比饱满种子的密度都要小得多。下表为食盐溶液其溶质质量分数与密度关系。
溶质质量分数
5%
10%
15%
20%
26%
溶液密度(g/cm3)
1.03
1.07
1.10
1.15
1.20
请回答下列问题:
(1)、应选用表中溶质质量分数为的食盐溶液才能挑选出很饱满的水稻种子。(2)、配制200千克质量分数为20%的食盐溶液需要食盐千克。(3)、若取上述配制好的质量分数为20%的食盐溶液60千克,能配制质量分数为15%的食盐溶液多少千克?需加多少体积的水?
14. 溶解度研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据
温度/℃
20
30
40
50
60
80
100
溶解度/g
21.8
39.7
48.8
47.3
46.4
45.1
44.7
(1)、由表中数据可知,20℃时,碳酸钠饱和溶液的溶质质量分数是(精确到1%)。(2)、小东同学进行了如图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入g 碳酸钠;升温至60℃时,烧杯④中会出现的现象是 。 (3)、20℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是(填字母序号),该物质形成的溶液中存在的微粒有。A.氢氧化钠 B.碳酸钙 C.硝酸铵 D. 氯化钠15. 请根据下图A、B、C三种固体物质的溶解度曲线,回答下列问题:
(3)、20℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是(填字母序号),该物质形成的溶液中存在的微粒有。A.氢氧化钠 B.碳酸钙 C.硝酸铵 D. 氯化钠15. 请根据下图A、B、C三种固体物质的溶解度曲线,回答下列问题: (1)、在℃时,A、C两种物质的溶解度相等。(2)、若A物质中混有少量B物质,最好采用的方法提纯。(填“降温结晶”或“蒸发结晶”)。(3)、 在t2℃时向盛有50gA物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数。16. 项目学习小组在食盐溶液的学习中,通过实验测定“析出食盐晶体后所得溶液的溶质质量分数”(饱和溶液的浓度),并制定评价量规如表一,其中两种方案的实验过程记录如下:
(1)、在℃时,A、C两种物质的溶解度相等。(2)、若A物质中混有少量B物质,最好采用的方法提纯。(填“降温结晶”或“蒸发结晶”)。(3)、 在t2℃时向盛有50gA物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数。16. 项目学习小组在食盐溶液的学习中,通过实验测定“析出食盐晶体后所得溶液的溶质质量分数”(饱和溶液的浓度),并制定评价量规如表一,其中两种方案的实验过程记录如下:(已知烧杯质量为50克,蒸发皿质量为20克,甲烧杯中含有50克蒸馏水与30克食盐。实验时室温为20℃,查阅资料发现此温度下饱和食盐水的浓度为26.5%)
方案Ⅰ:取甲烧杯中部分溶液加入蒸发皿,垫上石棉网,用酒精灯内焰加热蒸发结晶,发现有少量晶体溅出,当即停止加热。相关数据记录在如下流程中。实验共用时18分钟。
方案Ⅱ:用胶头滴管直接往烧杯中逐次加入蒸馏水并充分搅拌,记录相关数据。共用时7分钟。

表一:评价指标
优秀(各5分)
合格(各3分)
待改进(各0分)
指标一、用时合理
实验时间10分钟内
实验时间10-20分钟内
实验时间20分钟以上
指标二、操作规范
操作过程无科学错误
操作中出现1处不规范
操作中出现2处及以上不规范
指标三、结果精确
误差小于真实值5%比例
误差在5%~10%比例之间
误差比例大于真实值10%比例
(1)、如图甲烧杯中所得溶液一定是饱和溶液,其依据是:。(2)、根据方案Ⅱ的数据,计算饱和溶液的浓度。若计算结果与真实值有差异,请写出可能原因之一。(3)、结合评价量规和过程记录,将方案Ⅰ相关指标的评价得分填在答题卷表格中。17. 分析处理图表中的信息是学习化学的一种重要方法.(1)、如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)温度(℃)
0
10
20
30
40
50
60
70
80
90
100
KNO3
13.3
20.9
32
45.8
64
85.5
110
138
169
202
246
NaCl
35.7
35.8
36
36.3
36.6
37
37.3
37.8
38.4
39
39.8
Ⅰ.20℃时,NaCl的溶解度是 g.
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为(只列计算式,不需要计算结果).
Ⅲ.KNO3中含少量氯化钠时,提纯硝酸钾的一般方法是 .
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是 .
(2)、如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答.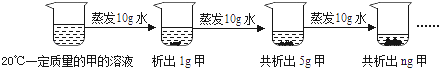
Ⅰ.蒸发前原溶液是(填“饱和”或“不饱和”)溶液.n的数值是 .
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是(填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.
18. 分析处理图表中的信息是学习化学的一种重要方法.(1)、如表是硝酸钾、氯化钠在不同温度下的溶解度(单位:g/100g水)温度(℃)
0
10
20
30
40
50
60
70
80
90
100
硝酸钾
13.3
20.9
32
45.8
64
85.5
110
138
169
202
246
氯化钠
35.7
35.8
36
36.3
36.6
37
37.3
37.8
38.4
39
39.8
Ⅰ.30℃时,硝酸钾溶液的最大浓度(溶质质量分数)为(只列计算式,不需要计算结果).
Ⅱ.硝酸钾中含少量氯化钠时,提纯硝酸钾的一般方法是 .
Ⅲ.根据表内数据可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度X g,则X的取值范围是 .
(2)、如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答.
Ⅰ. n的数值是。
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是(填字母)。
A.随温度升高而增大 B.随温度升高而减小 C.无法判断